不同花期芍花精油的成分及抗氧化活性研究
2019-01-11权春梅丁瑞苹刘超祥张晴晴周光姣
权春梅,曹 帅,丁瑞苹,刘超祥,张晴晴,周光姣
(1.亳州职业技术学院 药学院,安徽 亳州 236800;2.亳州学院 中药学院,安徽 亳州 236800)
芍花为毛茛科植物芍药Paeonia lactiflora Pall.的花,花色艳丽、香气浓郁,有“一花之下,万花之上”的美称。芍花有较高的药用价值,有抗氧化,抗菌、抗病毒,抗癌,抗神经退行性疾病,抗心血管疾病和抗肾脏、肺纤维化,抗炎活性[1],同时具有很高的活性氧自由基的清除能力,富含总酚类、黄酮类、多糖物质等活性成分[2]。但是芍花常常被作为废弃物丢掉而造成极大的浪费。因此对芍花的开发利用势在必行。芍花一般4月底或5月初花朵初开,先是花蕾期,而后进入盛开期。当前,有不少国内外学者对很多花卉精油的提取工艺及抗氧化活性成分进行了研究[3-7],但是对不同花期芍花精油的成分及活性研究尚未见报道。
文章利用超临界CO2流体萃取法对花蕾期和盛开期芍花进行精油的提取,采用气-质联用色谱法对其进行成分研究,对比两种花期芍花精油的成分差异;另外,采用DPPH法和ABTS法对以上两种花期的芍花精油进行抗氧化活性研究,为芍花的采收期提供依据,同时也为芍花精油作为天然抗氧化剂的开发奠定基础。
1 实验部分
1.1 材料及仪器
1.1.1 材料
芍花,采收于安徽省亳州市谯东镇,经亳州职业技术学院刘耀武教授鉴定为芍药Paeonia lactifloraPall.的花;CO2(食品级,纯度99%以上);无水乙醚(分析纯,天津市科密欧化学试剂有限公司,批号:20170803);无水硫酸钠(天津市科密欧化学试剂有限公司,批号:20160809);DPPH(Sigma公司,批号:43654-357);ABTS(Sigma公司,批号:30931-67-0);磷酸二氢钠(天津市博迪化工有限公司,批号:20170706);磷酸氢二钠(天津市致远化学试剂有限公司,批号:20170312);过二硫酸铵(江苏强盛功能化学股份有限公司,批号:20160915);无水乙醇(天津市致远化学试剂有限公司,批号:20170312);娃哈哈纯净水(合肥娃哈哈饮料有限公司)。
1.1.2 仪器
超临界萃取装置(HA220-50-06,江苏南通华安超临界萃取公司);摇摆式高速万能粉碎机(DFY-400,温岭市林大机械有限公司);电子计重计数天平(LQ-1230,上海瑶新电子科技有限公司);电子天平(FA21048,上海菁海仪器有限公司);蒸馏装置(上海书培实验设备有限公司);UV紫外分光光度计(上海佑科仪器仪表有限公司);Trace1310型气相色谱仪与ISQ单四级杆质谱联用仪(美国Thermo)。
1.2 方法
1.2.1 超临界CO2流体萃取法
依据权春梅[8]等人对超临界CO2流体萃取芍花精油的方法研究,设置萃取条件分别为萃取Ⅰ压力12 MPa、萃取Ⅰ温度35 ℃、分离Ⅰ温度36.5 ℃、分离Ⅱ温度35.7 ℃及泵频率15 Hz,萃取得芍花精油。
1.2.2 芍花精油的GC-MS测定
采用石英毛细管柱TG-5MS,30 m×0.25 mm,载气为He。程序升温从40 ℃开始,以4 ℃/min升到150 ℃保持5 min,再以6 ℃/min升温至250 ℃保持5 min,载气He,柱流量1.0 mL/min,进样口温度250 ℃,进样量1 μL,分流比80∶1。
质谱条件:EI源;电离电压70 Ev,离子源温度230 ℃,扫描质量范围(m/z):30~500。
1.2.3 DPPH自由基清除率的测定
将花蕾期和盛开期的芍花精油、BHT试剂,用无水乙醇作为溶剂,配成浓度分别为1.25、3.12、6.25、12.5、25.0、50.0 mg/L的样品溶液,参照文献[12]方法测定待测样品对DPPH自由基的清除能力。于光径1 cm的比色皿管内加入6.5×10-5mol/L的DPPH乙醇溶液2.5 mL,再加入0.5 mL待测样品溶液,摇匀,室温下避光放置20 min后测定混合溶液在517 nm处的吸光度。每一浓度下的吸光度平行测3次,结果平均值,清除活性按下式计算:
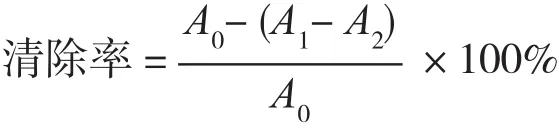
式中:A1为DPPH溶液2.5 mL+样品乙醇溶液0.5 mL的吸光度;A2为样品乙醇溶液0.5 mL+无水乙醇2.5 mL的吸光度;A0为DPPH溶液2.5 mL+无水乙醇0.5 mL。公式中引入A2是为了消除样品溶液本身颜色对实验结果的干扰。
1.2.4 ABTS自由基清除率的测定
ABTS自由基清除能力的测定参照文献[9-11]的方法,用蒸馏水将ABTS配制成7 mmol/L储备液,将上述储备液与2.45 mmol/L(NH4)2S2O8水溶液混合均匀,于室温避光16 h后备用,反应产生ABTS自由基,将ABTS自由基溶液用磷酸缓冲液(5 mmol/L,pH7.4)稀释,使其在734 nm下测得吸光度A在0.700±0.020,用无水乙醇将将花蕾期和盛开期的芍花精油、BHT试剂,配成浓度分别为1.25、3.12、6.25、12.5、25.0、50.0 mg/L的样品溶液,将0.5 mL不同质量浓度样品溶液与5 mL ABTS+自由基溶液充分混匀,在室温下放置10 min后每隔5 min测其吸光度A样品,按下式计算清除率:

A样品为加样品溶液后的ABTS+自由基溶液的吸光度,A空白为不加样品溶液ABTS自由基溶液的吸光度。
2 结果与分析
2.1 花蕾期芍花精油的GC-MS分析
花蕾期芍花精油的GC-MS总离子流色谱图如图1。

图1 花蕾期芍花精油的总离子流色谱图
通过对图1的分析结合计算机检索得出该芍花精油含有8种主要化学成分,结果见表1。
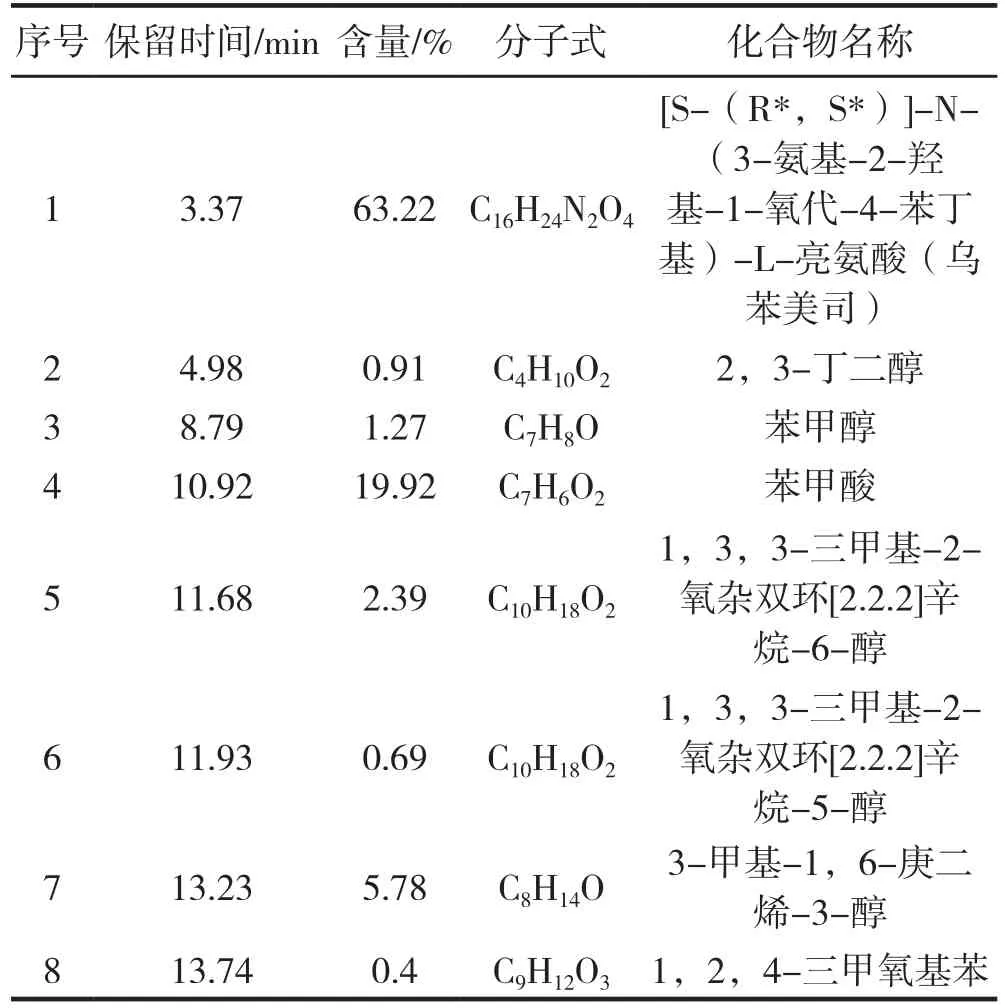
表1 花蕾期芍花精油的主要成分及含量
由表1可以看出,花蕾期芍花精油的主要成分 为[S-(R*,S*)]-N-(3-氨 基-2-羟 基-1-氧代-4-苯丁基)-L-亮氨酸(乌苯美司),含量高达63.22%,除此之外还有苯甲酸,相对含量为19.92%,另外含有少量的其他醇。
2.2 盛开期芍花精油的GC-MS分析
盛开期芍花精油的总离子流色谱图如图2。
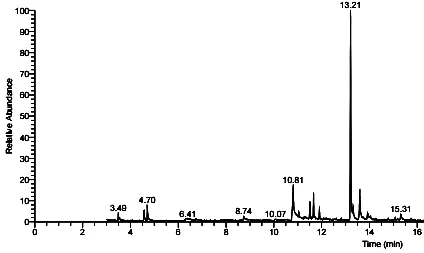
图2 盛开期芍花精油的总离子流色谱图
通过对图2的分析结合计算机检索可以得出该芍花精油含有10种主要化学成分,结果见表2。

表2 盛开期芍花精油的主要成分及含量
由表2可以看出,盛开期芍花精油的主要成分为3-甲基-1,6-庚二烯-3-醇,含量达45.69%,另外还含有13.16%的苯甲酸,除此之外还含有其他的醇类及少量的酮。
2.3 不同花期芍花精油对DPPH自由基的清除能力
通过实验得出花蕾期和盛开期芍花精油对DPPH自由基的清除率结果见图3。
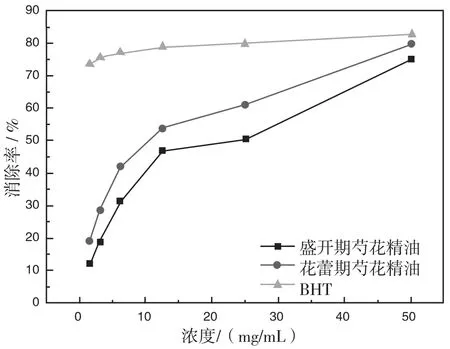
图3 清除DPPH自由基的能力
通过图3可以看出两种花期的芍花精油对DPPH自由基的清除能力均随着精油浓度的增大而增强,相同浓度下花蕾期的芍花精油对DPPH自由基的清除能力稍高于盛开期的芍花精油,但二者对DPPH自由基的清除率均小于BHT。在1.56-50 mg/mL浓度范围内,以α=0.05检验水平,两者对DPPH自由基的清除率整体差异明显。
2.4 不同花期芍花精油对ABTS自由基的清除能力
通过实验得出花蕾期和盛开期的芍花精油对ABTS自由基的清除率结果见图4。
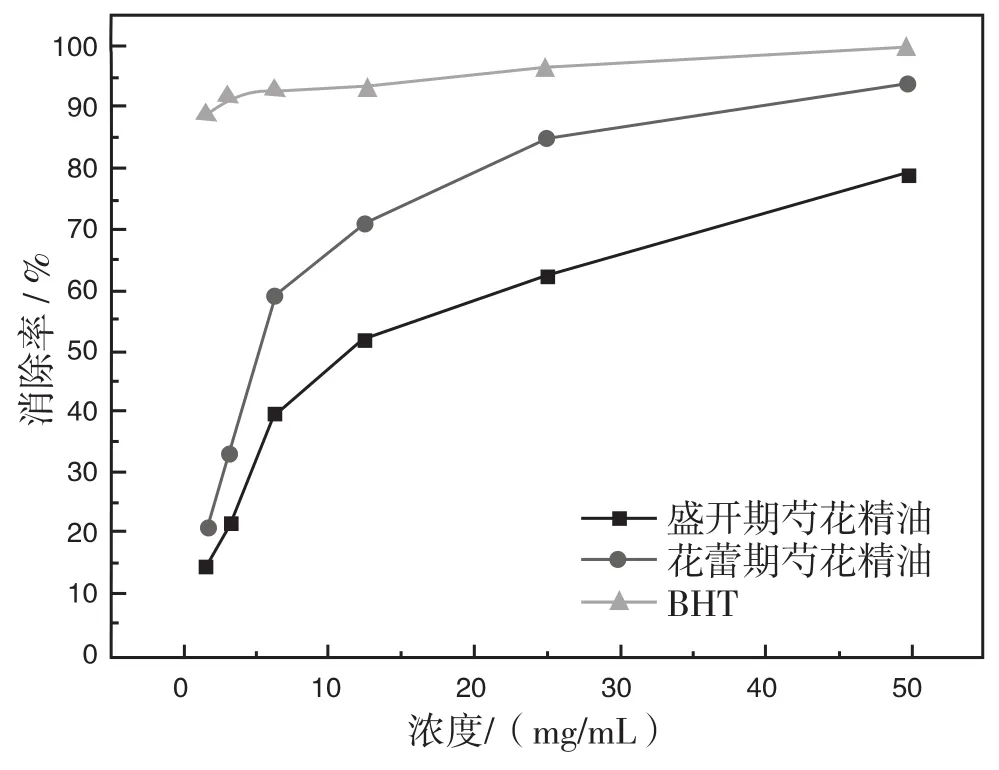
图4 清除ABTS自由基的能力
通过图4可以看出两种花期的芍花精油对ABTS自由基的清除率能力均随着精油浓度的增大而增强,相同浓度下花蕾期的芍花精油对ABTS自由基的清除能力明显高于盛开期的芍花精油,但二者对ABTS自由基的清除率均小于BHT。在1.56-50 mg/mL浓度范围内,以α=0.05检验水平,两者对ABTS自由基的清除率整体差异明显。
3 结论
通过以上实验可以看出,花蕾期和盛开期的芍花精油的成分差异很大,花蕾期芍花精油的主要成分为[S-(R*,S*)]-N-(3-氨基-2-羟基-1-氧代-4-苯丁基)-L-亮氨酸(乌苯美司),该成分具有提高免疫力的功能,临床上常用于抗癌化疗、放疗的辅助治疗,老年性免疫功能缺陷等。因此,对于花蕾期芍花精油进一步的分离及研究将具有重要意义。
以上实验研究也表明,在相同浓度下花蕾期的芍花精油对DPPH自由基和ABTS自由基的清除能力均高于盛开期的芍花精油。另外,两种花期的芍花精油对ABTS自由基的清除能力均高于对DPPH自由基的清除能力。综合课题组利用超临界CO2流体萃取法对不同花期芍花精油提取率的研究,从经济效益及抗氧化活性的角度考虑,建议芍花的采收期为花蕾期。
芍花精油作为一种天然抗氧化剂将有很大的潜能,在化妆品、食品、医疗、化工等领域将具有广阔的应用前景。该研究为芍花的采收期及芍花精油的抗氧化研究奠定了基础,同时也为提升芍花的附加值拓宽了途径。
