68Ga-DOTA-TATE正电子发射断层显像/计算机断层显像对 99mTc-HYNIC-TOC单光子发射断层显像阴性瘤源性骨软化症致病肿瘤的定位价值
2019-01-07邢海群
张 姝,王 玲,王 瞳,邢海群,霍 力,李 方
中国医学科学院 北京协和医学院 北京协和医院 1核医学科 2核医学分子靶向诊治北京市重点实验室,北京 100730
肿瘤源性骨软化症(tumor-induced osteomalacia,TIO)是由于肿瘤分泌成纤维细胞生长因子影响肾脏对磷的重吸收引起的肾脏排磷增加而引起的骨软化,是低磷性骨软化症的少见病因。对于TIO患者,手术切除致病肿瘤可以实现临床痊愈,所以准确定位致病肿瘤对患者的预后至关重要。但是TIO肿瘤多无局部症状,且位置隐匿,体积常较小,定位较困难。目前有多种方法定位责任肿瘤,包括常规影像学检查(如计算机断层显像、磁共振成像)、生长抑素受体显像和系统性静脉采样测成纤维细胞生长因子23。其中,生长抑素受体显像为目前定位TIO致病肿瘤最重要的影像学检查方法,包括111In奥曲肽单光子发射计算机断层显像(single photo emission computered tomography,SPECT)、99mTc-HYNIC-TOC SPECT、68Ga-DOTA-TATE正电子发射断层显像/计算机断层显像(positron emission tomography/computered tomography,PET/CT)[1-2]。99mTc-HYNIC-TOC SPECT作为目前最常用于定位TIO致病肿瘤的核医学检查方法,灵敏度可达到86.3%[3],但临床工作中发现部分TIO患者99mTc-HYNIC-TOC SPECT显像为阴性。68Ga-DOTA-TATE是一种生长抑素受体正电子显像剂,有报道其在TIO致病肿瘤检出方面具有更高的灵敏度和特异度[4]。本研究回顾性分析37例经临床及病理确诊的99mTc-HYNIC-TOC SPECT显像结果阴性的TIO患者的68Ga-DOTA-TATE PET/CT图像特点,探讨68Ga-DOTA-TATE PET/CT对其致病肿瘤定位的价值。
对象和方法
对象选取北京协和医院2016年6月至2018年5月符合以下标准的患者。纳入标准:(1)经临床及病理确诊为TIO的患者;(2)99mTc-HYNIC-TOC SPECT显像结果阴性。排除标准:具有低磷性骨软化症家族史;因原发性甲状旁腺功能亢进、肾小管酸中毒、长期阿德福韦酯药物使用史等其他可能原因致低磷骨软化患者。共纳入37例患者,其中男性22例、女性15例。平均年龄(44±13)岁(17~75岁)。本研究通过本院伦理委员会审查,所有患者检查前均签署知情同意书。
68Ga-DOTA-TATEPET/CT显像
68Ga-DOTA-TATE合成:用5.0 ml HCl(0.05 mol/L)淋洗68Ge/68Ga发生器,以5个1.5 ml EP管收集,选取68Ga浓度较高的第3管淋洗液用于标记;在EP管中加入47 μl HOAc-NaOAc缓冲液(1.25 mol/L),混匀后(pH值3.5~4.5),加入50 μl DOTA-TATE,置于100 ℃恒温金属浴加热10 min。然后取出反应管室温冷却5 min,用薄层色谱分析法测定放化纯。过无菌滤膜注入无菌密封瓶中,得到注射液。
68Ga-DOTA-TATE PET/CT扫描:静脉注射44.4~111 MBq68Ga-DOTA-TATE后40~60 min行PET/CT(德国Siemens Biograph 64)显像,扫描范围从头顶到脚趾。共采集9~11个床位,2 min/床位。以有序子集最大期望方法(ordered subsets expectation maximization,OSEM)重建图像。
图像分析由2位有经验的核医学科医师采用Siemens工作站Syngo via对68Ga-DOTA-TATE PET/CT图像进行独立分析,观察阳性病灶所在位置、形态、密度、有无周围软组织受累,当意见不一致时协商达成一致。勾画感兴趣区,测量病灶大小、标准化摄取最大值(maximum standardized uptake value,SUVmax)及标准化摄取平均值(mean standardized uptake value,SUVmean),分别测量3次,取平均值。
结 果
临床表现37例确诊为TIO的患者,平均病程(4.2±3.3)年(0.75~17年)。均有进行性骨痛、活动受限,部分患者伴有双下肢乏力和/或身高下降。血磷均有不同程度降低,平均血磷(0.5±0.1) mmol/L(0.28~0.67 mmol/L);大部分患者血钙正常(n=30),少部分降低(n=7),平均血钙 (2.21±0.11) mmol/L(1.96~2.58 mmol/L);大多数患者血碱性磷酸酶不同程度升高(n=34),少数正常(n=3),平均血碱性磷酸酶 (279.35±134.39) U/L(78~687 U/L);平均血清1,25 (OH)2D3(19.20±15.87) pg/ml(0.01~50.27 pg/ml);血甲状旁腺激素 (70.14±48.99) pg/ml(18.0~264.9 pg/ml);24 h尿磷(17.99±18.98) mmol(0.21~56.32 mmol)。25例患者术前行磷廓清实验,计算磷廓清指数均有不同程度减低,平均值0.44±0.12(0.08~0.60)。
68Ga-DOTA-TATEPET/CT影像学表现37例TIO致病肿瘤68Ga-DOTA-TATE PET/CT均为阳性,表现为放射性摄取浓聚灶,病灶均为单发,平均最大径为(2.0±0.8) cm(1.2~4.0 cm),平均SUVmax为8.0±5.5(1.7~23.8),平均SUVmean为4.8±3.0(1.2~12.6)。按肿瘤发病部位,19例位于下肢、11例位于躯干、5例位于上/下颌骨、2例位于上肢。24例位于骨组织病灶,同机CT 14例可见溶骨性骨质破坏,局部可见软组织密度影(图1、2),9例呈硬化型骨质改变,可见局灶性骨质密度增高(图3),1例未见明显骨质异常改变;1例位于肋骨病灶呈膨胀性骨质破坏,并累及周围软组织,余未累及周围软组织;13例发生于长骨病灶,均位于下肢,8例呈偏心性生长(图2),其中3例可见骨皮质破坏或不连续。13例位于软组织病灶,分布于皮下、骨皮质旁、肌间隙及腰椎管内,均呈等或稍低密度结节(与肌肉密度比较)(图4);其中10例边界清楚,3例边界不清,与邻近肌肉分界不清;大多数病灶密度均匀,其中1例位于胸膜病灶,内可见斑点状钙化(图5)。
病理诊断37例经术后病理证实确诊为TIO,其中31例病理为磷酸盐尿性间叶组织肿瘤,2例未行免疫组织化学染色,病理为梭形细胞瘤。
讨 论
TIO是一种临床少见的获得性低磷性骨软化症,临床表现突出,但是无特异性,包括进行性骨痛、四肢乏力、活动受限、身高缩短等,严重影响患者的生活质量。病程早期常被误诊为强直性脊柱炎、骨质疏松、腰椎间盘突出等[5-6]。当患者生化检查结果表现为血磷水平降低、尿磷排出增多、磷廓清指数降低、碱性磷酸酶升高、血l,25(OH)2D3水平降低时,需要考虑到TIO的可能,但是需要除外遗传性低磷性骨软化症、肾小管酸中毒、范可尼综合征、原发性甲状腺旁腺亢进等其他原因所致的低磷性骨软化症。本研究37例确诊为TIO的患者,均符合上述临床症状及生化特点。
TIO的致病肿瘤大多数为良性肿瘤,来源于间叶组织,最常见的病理类型为磷酸盐尿性间叶组织肿瘤,其他还包括神经纤维瘤、血管外皮细胞瘤、腱鞘巨细胞瘤、前列腺癌、霍奇金淋巴瘤、多骨型骨纤维异常增殖综合征等[6-9]。本研究35例TIO肿瘤病理证实为磷酸盐尿性间叶组织,2例未行免疫组织化学染色,病理为梭形细胞瘤,但是磷酸盐尿性间叶组织肿瘤形体学上主要是由弥漫或成束排列的梭形或星芒状细胞组成[10],所以形态学上符合磷酸盐尿性间叶组织肿瘤的特征。

TIO:瘤源性骨软化症;PET/CT:正电子发射断层显像/计算机断层显像;SPECT:单光子发射断层显像:PMT:磷酸盐尿性间叶组织肿瘤;SUVmax:标准化摄取最大值;SUVmean:标准化摄取平均值
TIO:tumor-induced osteomalacia;PET/CT:positron emission tomography/computered tomography;SPECT:single photo emission computered tomography;PMT:phosphaturic mesenchymal tumor;SUVmax:maximum standardized uptake value;SUVmean:mean standardized uptake value
A.99mTc-HYNIC-TOC SPECT未见异常放射性摄取增高灶,为假阴性;B.68Ga-DOTA-TATE PET最大灰度投影图像显示位于下颌部放射性摄取增高灶(箭头);C.68Ga-DOTA-TATE PET 横轴位图像显示下颌部摄取增高灶(箭头),SUVmax为2.97,SUVmean为1.75;D. PET/CT 融合图像显示高摄取灶位于下牙槽骨(箭头);E.同机CT显示局部溶骨性骨质破坏(箭头)
A.99mTc-HYNIC-TOC SPECT showed normal result,which was false negative;B. the68Ga-DOTA-TATE PET maximal intensity projection image showed a small focus of elevated activity in the lower jaw(arrow);C. intense uptake of68Ga-DOTA-TATE PET was observed (arrow),with the SUVmax and the SUVmean up to 2.97 and 1.75 on the axial PET image;D. the axial PET/CT fusion image showed the lesion was located in the inferior alveolar bone (arrow);E. osteolytic change was observed in the inferior alveolar bone (arrow) on the axial CT image
图1男,40岁,TIO患者,68Ga-DOTA-TATE PET/CT检出99mTc-HYNIC-TOC SPECT呈阴性的位于下颌骨的PMT
Fig1A 40-year-old male patient was diagnosed with TIO,68Ga-DOTA-TATE PET/CT detected the PMT located in the inferior alveolar bone,which was miss-diagnosed by99mTc-HYNIC-TOC SPECT

A.68Ga-DOTA-TATE PET横轴位图像显示位于右下肢放射性摄取增高灶(箭头),SUVmax和SUVmean分别为3.8和3.0;B. PET/CT融合图像示高摄取灶位于右侧股骨远端(箭头);C. 同机 CT示病灶呈溶骨性骨质破坏,局部可见软组织密度影(箭头)
A. the axial PET image of68Ga-DOTA-TATE showed an intense activity in the lower extremity (arrow),with the SUVmax and SUVmean up to 3.8 and 3.0;B. the PET/CT fusion image showed the lesion was located in the distal femur (arrow);C. the lesion presented accentric osteolytic change with soft-tissue density on corresponding CT image (arrow)
图2女,17岁,TIO患者,68Ga-DOTA-TATE PET/CT发现右侧股骨下端致病肿瘤病灶,病理为PMT
Fig2A 17-year-old female TIO patient,68Ga-DOTA-TATE PET/CT detected the culprit tumor located in the distal femur,which was pathologically confirmed as PMT

A.99mTc-HYNIC-TOC SPECT未见放射性摄取增高灶,呈假阴性;B.68Ga-DOTA-TATE PET最大灰度投影图像显示位于右下肢放射性浓聚灶(箭头);C. 横轴位PET图像显示位于右下肢摄取增高灶(箭头),SUVmax和SUVmean分别为6.95和4.17;D. PET/CT融合图像示68Ga-DOTA-TATE高摄取灶位于右侧股骨头(箭头);E. 同机CT显示局部结节状骨质硬化影(箭头)
A.99mTc-HYNIC-TOC SPECT showed normal result,which was false negative;B.68Ga-DOTA-TATE PET maximum intensity projection image showed a small focus of increased activity in the right lower extremity(arrow);C. the axial PET image showed an increased activity (arrow)with the SUVmax and SUVmean up to 6.95 and 4.17;D. the PET/CT fusion image showed the lesion was located in the right femur head(arrow);E. corresponding CT image revealed an nodular osteosclerotic change(arrow)
图3男,49岁,TIO患者,68Ga-DOTA-TATE PET/CT发现99mTc-HYNIC-TOC SPECT呈阴性的位于右侧股骨下端病灶,行右侧髋关节置换术,术后病理为PMT
Fig3A 49-year-old male TIO patient,68Ga-DOTA-TATE PET/CT detected the culprit tumor located in the right femur head,which was negative on99mTc-HYNIC-TOC SPECT,the lesion was pathologically confirmed as PMT after total hip replacement
在影像学上,1996年Reubi等[11]报道多种间叶组织来源肿瘤表达生长抑素受体(somatostatin receptor,SSTR),尤其是SSTR2受体,故生长抑素受体显像成为寻找TIO致病肿瘤主要检查手段。单光子显像剂包括99mTc-HYNIC-TOC、111In-octreotide。正电子显像剂主要为68Ga标记的生长抑素受体奥曲肽(68Ga-DOTA-TOC、68Ga-DOTA-NOC或68Ga-DOTA-TATE)。文献报道99mTc-HYNIC-TOC SPECT 在TIO诊断效能方面,具有较高的灵敏度和特异度[3,12],Jing等[3]研究发现99mTc-HYNIC-TOC奥曲肽显像在定位TIO致病肿瘤方面,其灵敏度、特异度和准确性分别达86.3%、99.1%和93.4%。但是笔者在临床工作中发现仍会有部分TIO致病病灶呈阴性。68Ga标记的生长抑素受体奥曲肽是一种正电子核素标记的多肽类显像剂,其合成工艺简单,标记率较高,68Ga半衰期(68 min)与肽类分子体内清除的时间相一致,在近年来检出生长抑素受体表达增高肿瘤方面发挥着重要作用。Antunes等[13]和于江媛等[14]研究发现,68Ga标记的生长抑素受体奥曲肽与111In-octreotide比较,与SSTR2受体结合力更强,肿瘤摄取更高。国内外有研究比较68Ga-DOTA-TATE PET/CT、99mTc-HYNIC-TOC SPECT、111In-octreotide SPECT显像在神经内分泌肿瘤患者的临床价值,发现68Ga-DOTA-TATE PET/CT在探测小病灶及解剖结构相对复杂的病灶方面更具有优势。另外,68Ga-DOTA-TATE与68Ga-DOTA-TOC、68Ga-DOTA-NOC比较,与SSTR2受体的亲和力更强[13],故本研究使用的是68Ga-DOTA-TATE显像剂,并成功检出了99mTc-HYNIC-TOC SPECT显像漏诊的TIO病例,分析其原因,可能有以下3个方面:(1)PET图像较SPECT图像空间分辨率更高,信噪比更高,由于磷酸盐尿性间叶组织肿瘤体积通常较小,所以SPECT可能会遗漏一些小病灶和放射性摄取低的病灶;(2)99mTc-HYNIC-TOC SPECT为平面显像,而68Ga-DOTA-TATE PET/CT一次扫描获得的是全身断层图像,可检出平面显像由于与肝脏、脾脏、肾脏等脏器重叠而遗漏的病灶;(3)TATE与TOC相比SSTR2结合力更强[15-16],而磷酸盐尿性间叶组织肿瘤表面主要表达SSTR2,所以肿瘤对68Ga-DOTA-TATE 的摄取较99mTc-HYNIC-TOC更多,68Ga-DOTA-TATE PET/CT的病灶检出率也更高。
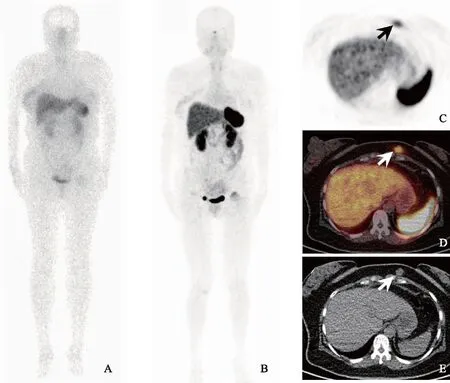
A.99mTc-HYNIC-TOC SPECT未见放射性摄取增高灶;B.68Ga-DOTA-TATE PET 最大灰度投影图像未见放射性摄取增高灶;C. PET横轴位图像显示前胸壁放射性摄取增高灶(箭头),SUVmax和SUVmean分别为3.8和 3.0;D. PET/CT融合图像示病灶位于前胸壁皮下软组织(箭头);E. 同机CT横轴位图像示病灶呈边界清楚软组织密度结节(箭头)
A.99mTc-HYNIC-TOC SPECT showed normal result,without no elevated activity;B.68Ga-DOTA-TATE PET maximum intensity projection image showed normal result,without no elevated activity;C. the axial PET showed an intense activity in the anterior chest wall (arrow),with the SUVmax and SUVmean up to 3.8 and 3.0;D. the PET/CT fusion image showed that the lesion was in the subcutaneous region of chest wall(arrow);E. corresponding CT image revealed a well-circumscribed isodense nodule (arrow)
图4女,48岁,TIO患者,68Ga-DOTA-TATE PET/CT检出99mTc-HYNIC-TOC SPECT呈阴性的位于前胸壁的致病肿瘤,肿物手术切除后,病理为PMT
Fig4A 48-year-old female TIO patient,68Ga-DOTA-TATE PET/CT detected the culprit tumor located in the subcutaneous region of chest wall,which was negative on99mTc-HYNIC-TOC SPECT,the lesion was confirmed as PMT after surgical resection
TIO肿瘤体积较小,平均最大径为2.0 cm。最小的病灶位于腰部皮下,最大径只有1.2 cm,行常规影像学检查容易被忽略。68Ga-DOTA-TATE PET/CT的优势在于根据PET图像提示的生长抑素受体表达增高的位置,并结合同机CT局部影像学表现确定TIO致病病灶。本研究总结37例确诊为TIO的致病肿瘤的68Ga-DOTA-TATE PET/CT图像特点,致病肿瘤均为单发,按发病部位,多数位于四肢,按组织起源,多数病灶位于骨组织,与文献报道的肿瘤好发部位一致[3,6,17-18]。文献报道位于骨组织的TIO致病肿瘤多呈溶骨性骨质破坏[19-21],而本研究发现位于骨组织病灶除了表现为溶骨性骨质破坏,仍有部分病灶呈硬化型改变,表现为局灶性骨质密度增高,甚至有2例诊断性CT将其误诊为骨岛,考虑与病灶内骨化成分增多相关。本研究超过半数TIO骨内肿瘤位于下肢长骨,多呈偏心性生长,少数累及骨皮质,可见骨皮质溶骨性骨质破坏,极少累及周围软组织。位于软组织的病灶,分布无明显特点,可位于皮下、骨皮质旁和肌肉间隙内,另有1例起源于胸膜,比较罕见,目前也只有少数个案报道[22]。如果局部见边界清楚、密度均匀的等或稍低密度结节(与肌肉密度比较),则为TIO致病肿瘤的可能性大。由于炎性细胞表面可有生长抑素受体表达[23],且68Ga-DOTA-TATE PET/CT具有较高的灵敏度,所以笔者在临床工作中发现,部分炎性病变,如牙周炎、关节面下非特异性炎症或骨折后炎性修复改变可形成假阳性病灶,此时需要结合局部CT图像特征,如果局部可见骨折线、条状骨质密度增高,考虑为骨折或骨折后修复改变可能性大,如果局部未见明确的骨质异常改变,需行诊断性CT或磁共振成像检查进一步明确有无占位性病变。

A.99mTc-HYNIC-TOC SPECT未见异常放射性摄取增高灶,为假阴性;B.68Ga-DOTA-TATE PET最大灰度投影图像显示左胸部放射性摄取增高灶(箭头);C. PET横轴位图像示左胸部放射性摄取增高灶(箭头),SUVmax和SUVmean分别为10.4和5.6;D. PET/CT融合图像示病灶位于左侧胸膜(箭头);E. 同机CT显示局部胸膜结节样增厚,内可见点状钙化(箭头)
A.99mTc-HYNIC-TOC SPECT showed normal result,which was false-negative;B.68Ga-DOTA-TATE PET maximum intensity projection image showed an elevated activity in the chest (arrow);C. the axial PET showed the lesion was in the chest wall(arrow),with the SUVmax and SUVmean up to 10.4 and 5.6;D. the PET/CT fusion image showed the lesion was in the pleura (arrow);E. nodular thickening of pleura was observed on corresponding CT image,with spot calcification in it(arrow)
图5女,24岁,TIO患者,68Ga-DOTA-TATE PET/CT检出位于胸膜上的PMT,而SPECT呈阴性
Fig5A 24-year-old female TIO patient,68Ga-DOTA-TATE PET/CT detected the PMT located in the pleura,which was miss-diagnosed by SPECT
本研究存在回顾性研究常见缺陷,另外其样本量较小,今后需纳入更多的病例,进一步验证本研究所总结的TIO致病肿瘤68Ga-DOTA-TATE PET/CT影像学特点,以提高TIO致病肿瘤的诊断准确性。未来研究中可以纳入99mTc-HYNIC-TOC SPECT显像结果阳性的TIO患者,分析68Ga-DOTA-TATE PET/CT对这部分TIO患者致病肿瘤的检出率及其图像特征,进一步探讨两种检查方法各自的优势。
综上,对于临床疑诊为TIO,99mTc-HYNIC-TOC SPECT显像结果阴性的患者,68Ga-DOTA-TATE PET/CT可作为补充检查有效地检出TIO致病肿瘤。TIO致病肿瘤68Ga-DOTA-TATE PET/CT图像上均可见生长抑素受体高度表达。另外,同机CT具有一定的特点,骨组织肿瘤局部可见溶骨性骨质破坏或局灶性骨质密度增高,四肢长骨病变常呈偏心性生长,部分累及骨皮质;软组织肿瘤多呈密度均匀等或低密度结节,具有以上影像学特点倾向于TIO致病肿瘤的诊断。
