逆境胁迫对菜豆黄化苗转绿过程中交替呼吸途径与叶绿素荧光特征的影响
2019-01-04芦丽娜冉瑞兰冯汉青
芦丽娜,冉瑞兰,冯汉青
(西北师范大学 生命科学学院, 兰州 730070)
铅(Pb)在土壤、水源中广泛存在,其通过吸收进入植物体内而对植物产生严重的毒害,被认为是一种主要的植物重金属毒性物质[1]。已有研究表明,铅胁迫会导致植物细胞膜透性的改变、线粒体及细胞核等细胞器结构破坏、抗坏血酸含量减少、硝酸还原酶和脱氢酶等酶活力降低以及DNA的损伤;此外,铅胁迫能阻止Ca2+的跨膜内流,使钙调素和Ca-ATP酶无法被激活,并抑制有丝分裂的进行,甚至导致植物细胞的死亡[2-3]。同时,高温、干旱、盐渍等诸多逆境均会导致植物遭受渗透胁迫,其被认为是限制植物正常生长发育的主要环境因素[4]。而渗透胁迫也会破坏植物细胞生物膜系统,改变膜的透性,导致植物细胞核和线粒体等细胞器超微结构的破坏;此外,渗透胁迫还会引起植物细胞离子外漏,影响生物大分子生物合成,改变饱和脂肪酸含量,阻碍根系生长和营养吸收,从而严重影响植物的正常生长[5]。
在高等植物中,线粒体呼吸存在两条不同的途径:细胞色素途径和交替呼吸途径[6]。交替氧化酶是存在于植物细胞线粒体交替呼吸途径的末端氧化酶,交替呼吸途径可以使电子从泛醌处分支,绕过线粒体电子传递链中的两个ATP形成位点(复合物Ⅲ和复合物Ⅳ),直接由交替氧化酶催化分子氧的4个电子还原成水[7-8]。因此,与细胞色素途径相比,交替呼吸途径的运行减少了ATP的产生,而将本应生成ATP的能量以热的形式释放[9]。研究发现,当外界环境对植物造成胁迫时,交替呼吸途径能够通过减少细胞内活性氧(ROS)的产生、维持呼吸的运行、加速碳骨架的供应等多种方式降低环境胁迫对植物造成的压力[6-9]。
黑暗下生长的黄化状态的幼苗通过光照转绿是一个涉及到叶绿素生物合成、光合机构装配和叶绿体发育的过程[10-11]。植物黄化幼苗为研究外在环境和内部因素对植物叶绿素合成以及光合机构建成的影响等工作提供了良好的材料[12]。有研究表明,铅或渗透胁迫均可以影响正常生长的植物的叶绿素合成和光化学反应[3,5,13],但对于在植物黄化叶片转绿过程中Pb或渗透胁迫对于植物叶绿素合成和光化学反应的影响鲜有报道。另据报道,交替呼吸途径能够调节植物的叶绿素合成和光化学反应[14-15]。然而,在铅或渗透胁迫影响黄化状态植物转绿的过程中,交替呼吸途径所起的生理学角色在国内外尚无研究。
基于此,本研究以菜豆黄化幼苗为实验材料,以叶绿素含量和叶绿素荧光参数作为菜豆黄化幼苗转绿进程的衡量指标,探讨了在Pb胁迫或PEG诱导的渗透胁迫下交替呼吸途径对菜豆黄化幼苗转绿过程中叶绿素含量及叶绿素荧光特性的影响,该工作有助于进一步了解和丰富在逆境胁迫下植物交替呼吸途径的生理学作用。
1 材料和方法
1.1 材料培养
本试验所用菜豆(PhaseolusvulgarisL.)品种为‘农普12号’,种子由广州市农业科学院提供。使用W/V为1% 的 NaClO溶液对菜豆种子表面消毒10~15 min,之后充分冲洗(清除残留的NaClO)。将用蒸馏水浸湿的多层纱布覆盖于培养皿中,再将已消毒的种子置于纱布中覆盖,将培养皿置于恒温培养箱于26 ℃黑暗下进行萌发。选取萌发均一的种子在含有Hoagland培养液的锥形瓶中于26 ℃下继续黑暗培养,每2 d更换营养液1次。
1.2 材料处理
选取8 d龄,长势均一的菜豆黄化幼苗作为供试材料,并进行如下两个实验处理,分别在实验1和实验2光照0、24、48、72 h时测量叶绿素含量和叶绿素荧光参数,且分别在实验1光照0 h、24 h、72 h时测量交替呼吸途径容量。
实验1:以Hoagland 培养液为溶剂,配制0、0.3、0.6、1 mmol/L的Pb(NO3)2溶液,或以Hoagland培养液为溶剂,配制0、5%、10%、15%的PEG-6000溶液。将黄化幼苗置于上述溶液中于黑暗下预处理12 h(温度26 ℃),之后在26 ℃下给予光强为(170±30) μmol·m-2·s-1光照72 h。
实验2:配制1 mmol/L 的水杨基氧肟酸(salicylhydroxamic acid,SHAM,交替氧化酶的抑制剂),溶剂为质量体积比为1%的乙醇。用1 mmol/L的SHAM或1%的乙醇喷洒叶片,于黑暗中孵育4 h,之后移入含有或不含有0.3 mmol/L的 Pb(NO3)2的Hoagland营养液中,或移入含有5% PEG-6000的Hoagland营养液中,然后将上述溶液中黄化幼苗置于黑暗下预处理12 h(温度26 ℃),后在26 ℃下给予光强为(170±30) μmol·m-2·s-1光照72 h。
1.3 测定指标及方法
1.3.1叶绿素含量参考李祖祥等[16]的方法并略加修改,将研磨提取法修改为暗处丙酮浸泡提取法,以减少叶绿素在提取过程中的损耗。具体方法:称取叶片材料0.05 g,剪碎,加入3 mL 80%(体积比)丙酮提取液,暗处浸提过夜,用分光光度计分别测定在663 nm和645 nm下光吸收值,空白对照为80%(体积比)丙酮。
1.3.2叶绿素荧光参数使用叶绿素荧光仪IMAGING-PAM(Waltz, Germany)进行叶绿素荧光参数的测定。将待测叶片经过充分的暗适应后,打开测量光,测定初始荧光(Fo)和最大荧光(Fm),之后打开光化光,当实时荧光(Fs)达到稳态后打开饱和脉冲光,测得最大荧光(Fm′),关闭光化光,在远红光下测得最小荧光(Fo′)。根据以上参数计算出潜在最大光化学量子效率[Fv/Fm=(Fm-Fo)/Fm)]、最大光化学效率 [Fv′/Fm′ =(Fm′-Fo′)/Fm′)]、实际光化学效率 [Y(Ⅱ)=(Fm′-Ft)/Fm′]、光化学猝灭系数 [qP=(Fm′-Ft)/(Fm′-Fo)]和非光化学猝灭系数[NPQ=Fm/Fm′-1]等参数。
1.3.3交替呼吸途径容量交替呼吸途径容量的测定参照Clark型氧电极方法[17]进行:将叶片材料剪碎,在KCN存在下测量叶片耗氧速率;并在KCN和SHAM共同存在下测量剩余呼吸,交替呼吸途径容量为在KCN存在下测得的叶片耗氧速率与剩余呼吸的差值。
1.4 数据分析
上述检测均为4次独立重复实验结果的平均值,采用Excel和Origin统计软件完成试验原始数据处理:计算平均值、标准差、显著性差异检验(t-检测,a=0.05),并完成图表绘制工作。
2 结果及分析
2.1 Pb或PEG胁迫对菜豆黄化幼苗转绿过程中叶绿素含量的影响
图1显示,在经历24、48、72 h光照后,各浓度Pb或PEG胁迫处理黄化菜豆叶片叶绿素含量均比照光前明显上升;随着光照时间延长,对照(CK)、各浓度Pb胁迫处理黄化菜豆叶片叶绿素含量均逐渐增加,而各浓度PEG胁迫处理的叶绿素含量均逐渐降低;在相同光照时间内,各浓度Pb或PEG胁迫处理黄化菜豆叶片叶绿素含量均比相应对照显著降低,且胁迫浓度越高下降幅度越大。其中,在光照72 h 后,菜豆黄化幼苗叶片的叶绿素含量在 0.3、0.6、1.0 mmol/L的Pb(NO3)2胁迫下分别比同期对照(CK)显著降低了22.73%、34.18%和55.8%,而在5%、10%、15%的PEG胁迫下分别比同期对照显著降低89.4%、91.22%和92.267%(P<0.05)。上述结果表明,Pb或者PEG胁迫下菜豆黄化幼苗叶片转绿过程中叶绿素的合成受到显著抑制;随着胁迫浓度的增大和时间的延长,叶绿素的合成受到抑制越严重,且PEG胁迫对叶绿素含量的影响趋势显著强于Pb(NO3)2胁迫。
2.2 Pb或PEG胁迫对菜豆黄化幼苗转绿过程中叶绿素荧光参数的影响
由表1、2可知,在经历24、48、72 h光照后,Pb或PEG胁迫黄化菜豆幼苗叶片的Fv/Fm、Fv′/Fm′、Y(Ⅱ)、qP、NPQ均较照光前(0 h光照)大幅度增加。在光照24 h后,随光照时间继续增加,正常转绿的叶片(CK)的Fv/Fm、Fv′/Fm′、Y(Ⅱ)、qP均持续增加,而其NPQ则逐渐降低;各浓度Pb或PEG胁迫处理叶片的Fv/Fm、Fv′/Fm′、Y(Ⅱ)、qP随光照时间继续增加均逐渐降低,而其 NPQ 则持续增加。在相同光照时间内,与正常转绿的叶片(CK)相比,各浓度Pb或者PEG胁迫黄化幼苗转绿过程中叶片Fv/Fm、Fv′/Fm′、Y(Ⅱ)、qP数值均显著下降,但NPQ数值同时显著增加,且胁迫浓度越高各叶绿素荧光参数的升降幅度越大。其中,在光照72h后,0.3、0.6、1mmol/L的Pb(NO3)2 溶液处理菜豆幼 苗 叶 片 Fv/Fm 分 别 比 对 照 (CK)显 著 降 低27.3%、35.79% 和 36.4%,Fv′/Fm′分 别降低12.43%、16.13%和24.7%,Y(Ⅱ)分别降低27.71%、34.47%和44.8%,qP分别降低25.13%、31.57%和39.86%,而NPQ分别显著增加222%、283%和413%(P<0.05);同时,在光照72h后,5%、10%、15%的PEG胁迫菜豆叶片的Fv/Fm分别比对照(CK)显著降低31.48%、39.61%和48.09%,Fv′/Fm′分别显著降低46.29%、50.39%和55.42%,Y(Ⅱ)分别显著降低54.82%、45.78%和74.31%,qP分别显著降低38.20%、60.28%、67.94%,但NPQ分别显著增加257%、395.7%和514%(P<0.05)。以上结果说明Pb或PEG胁迫会引起菜豆黄化幼苗叶片转绿过程中PSⅡ开放程度的降低,对电子的接受、传递能力下降,抑制 PSⅡ对光能的吸收以及运行效率,使得更多的光能无法被利用,而是以热的形式耗散掉,即 Pb或 PEG 胁迫显著降低了 PSⅡ对光能的利用率。

同期不同小写字母表示处理之间在0.05水平存在显著性差异(P<0.05);以下图表同。图1 不同浓度Pb(NO3)2(A)或PEG(B)胁迫下转绿过程中菜豆叶片叶绿素含量的变化Different lower cases with the same time indicate significant differences between treatments at 0.05 level (P<0.05); the same as below table and figuresFig.1 The change of chlorophyll content in greening leaves of bean seedlings under Pb(NO3)2 (A)or PEG(B) stress
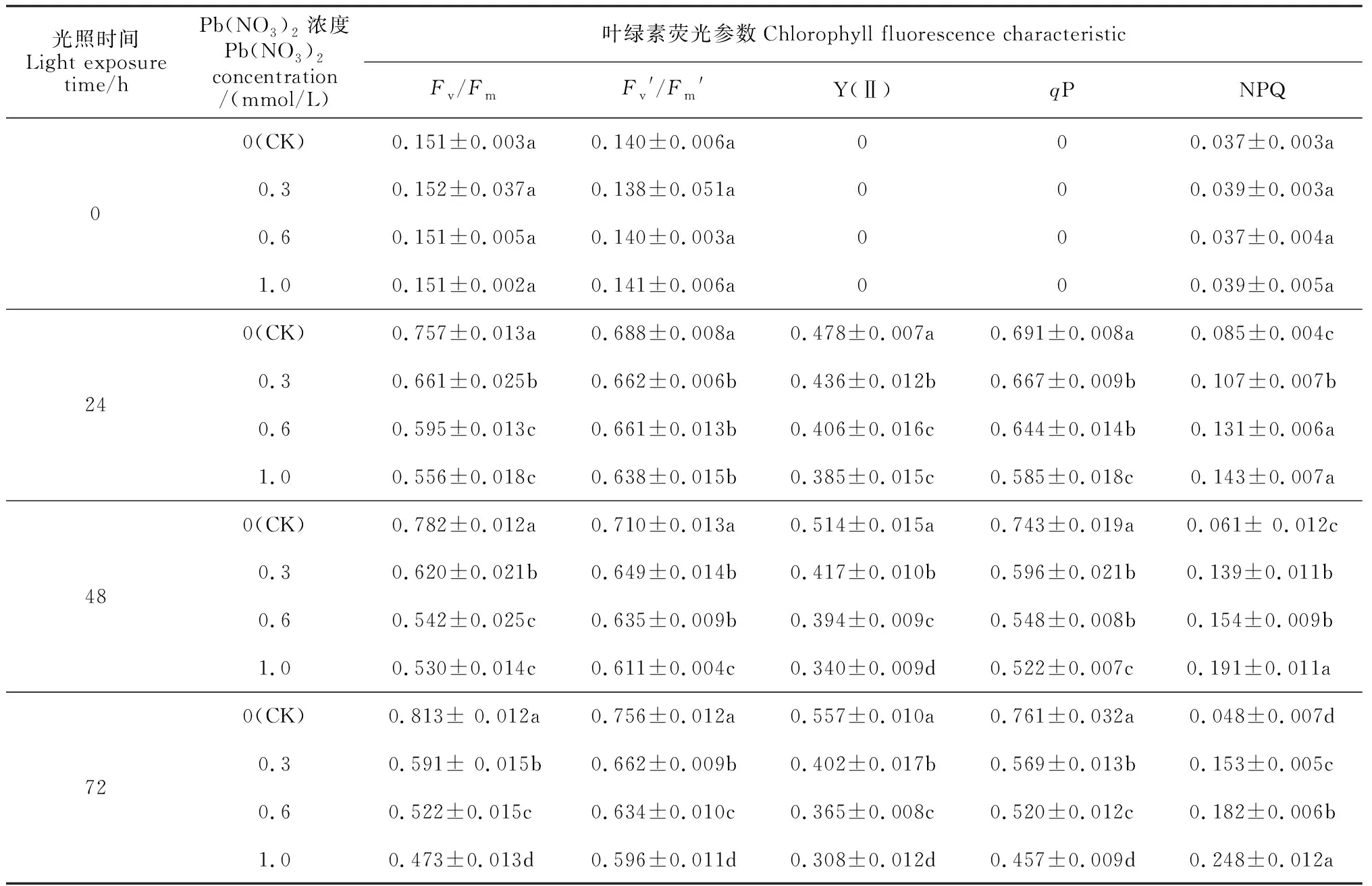
表1 Pb(NO3)2胁迫下转绿过程中菜豆叶绿素荧光参数的变化
注:Fv/Fm. PSⅡ潜在最大光化学量子效率;Fv′/Fm′.光适应下最大光化学效率; Y(Ⅱ).PSⅡ光适应下实际光化学效率;qP.光化学荧光猝灭系数;NPQ.非光化学猝灭系数;下同
Note:Fv/Fm. The potential maximal photochemical efficiency of PSⅡ;Fv′/Fm′. The maximum quantum efficiency of PSⅡ photochemistry at illumination; Y(Ⅱ). Effective photochemical quantum yield of PSⅡphotochemistry at illumination;qP. Photochemical quenching coefficient; NPQ. Non-photochemical quenching; The same as below
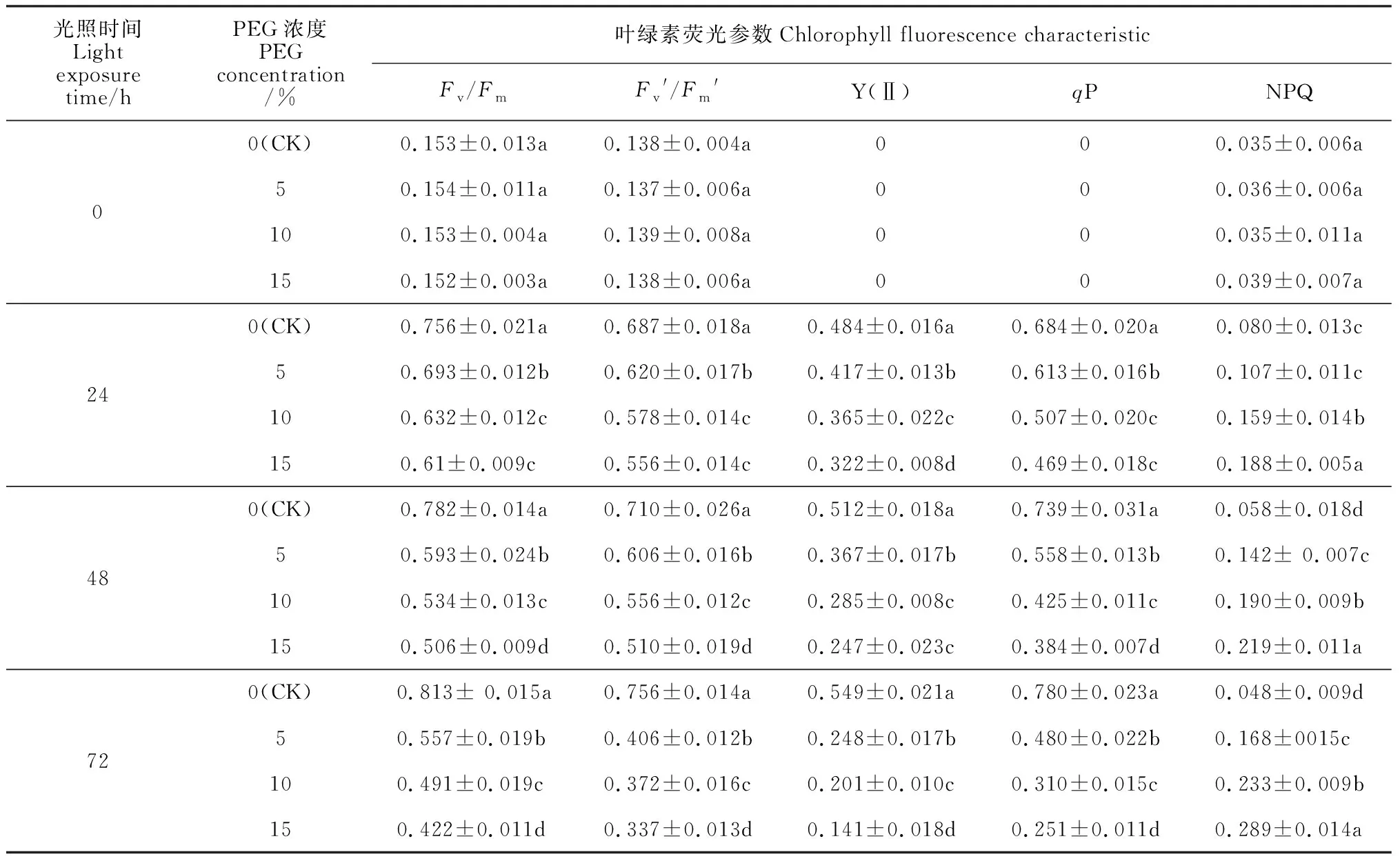
表2 PEG胁迫下转绿过程中菜豆叶绿素荧光参数的变化
2.3 Pb或PEG胁迫对菜豆黄化幼苗叶片转绿过程中交替呼吸途径容量的影响
由图2可看出,在经历24、72 h光照后,各处理黄化的菜豆幼苗叶片交替呼吸途径容量均比照光前(0 h)大幅上升,且光照时间越长增幅越大。在相同光照时间内,转绿过程中菜豆黄化幼苗叶片交替呼吸途径容量随着Pb(NO3)2浓度的升高而逐渐增加,而随着PEG胁迫浓度的增加而先上升后降低,并在10%PEG胁迫下达到最大值,且各浓度Pb或者PEG胁迫处理均显著高于同期对照(CK)。其中,经72 h光照后,菜豆黄化幼苗叶片抗氰呼吸途径容量在0.3、0.6、1 mmol/L的Pb(NO3)2胁迫处理下分别比对照显著增加632.8%、816.6%、1 065%、1 129.6%,在5%、10%、15% PEG胁迫下分别显著上升479.9%、555%、629.6%、374.8%。以上结果说明不同浓度的Pb或PEG胁迫均显著增加了菜豆黄化幼苗转绿过程中叶片交替呼吸途径容量。
2.4 Pb或PEG胁迫下SHAM对黄化叶片转绿过程中叶绿素含量的影响
为了研究在Pb或PEG胁迫下交替呼吸途径对菜豆黄化幼苗转绿过程中叶绿素含量的影响,我们分别在0.3 mmol/L Pb(NO3)2和5% PEG胁迫下考察了交替呼吸途径抑制剂SHAM(1 mmol/L)处理叶片在转绿过程中叶绿素含量的变化。图3显示,在菜豆幼苗叶片正常(无胁迫)转绿过程中,单独经过SHAM处理(1 mmol/L)的叶片叶绿素含量未受到显著影响。然而,Pb(NO3)2+SHAM处理均使黄化菜豆叶片转绿过程中叶绿素含量比Pb(NO3)2胁迫处理显著下降,且降幅随光照时间的延长进一步加大。相似地,PEG胁迫下,PEG+ SHAM处理也使得黄化菜豆叶片转绿过程中叶绿素含量比PEG胁迫处理进一步显著下降,并以PEG+ SHAM处理降幅更大,且下降幅度随光照时间的延长而加剧。另外,随着胁迫浓度的增大及时间的延长,PEG胁迫下交替呼吸途径对黄化菜豆叶片叶绿素含量的影响程度显著高于相应Pb胁迫。以上结果说明Pb(NO3)2或PEG胁迫下交替呼吸途径受到的抑制导致了黄化菜豆幼苗转绿过程中叶绿素含量进一步下降,因此交替呼吸途径在植物细胞内很有可能是通过调节叶绿素的含量来促进植物在环境胁迫下维持PSⅡ正常运行。
2.5 Pb或PEG胁迫下SHAM对菜豆黄化幼苗叶片转绿过程中叶绿素荧光参数的影响
由表3、4可知,菜豆黄化幼苗正常转绿过程中,单独1 mmol/L SHAM处理均没有使得叶片各叶绿素荧光参数发生显著变化;在Pb或者PEG胁迫下,SHAM处理使得黄化菜豆叶片转绿过程中Fv/Fm、Fv′/Fm′、Y(Ⅱ)和qP均比相应的Pb或者PEG胁迫处理显著下降,而同期却均NPQ则显著上升,且各参数的升降幅度随着光照时间的延长而加大。以上结果说明抑制交替呼吸途径会加剧Pb或PEG胁迫对光系统Ⅱ(PSⅡ)反应中心活性的进一步抑制,还原力的积累加剧,造成热耗散进一步增加,这可能暗示在胁迫条件下交替呼吸途径是有助于缓解PSⅡ的过度还原,帮助维持其正常运行。

图2 Pb(NO3)2(A)或PEG(B)胁迫下转绿过程中菜豆叶片交替呼吸途径容量的变化Fig.2 The capacity of alternative respiratory pathways in greening leaves of bean seedlings under Pb(NO3)2 (A)or PEG(B) stress
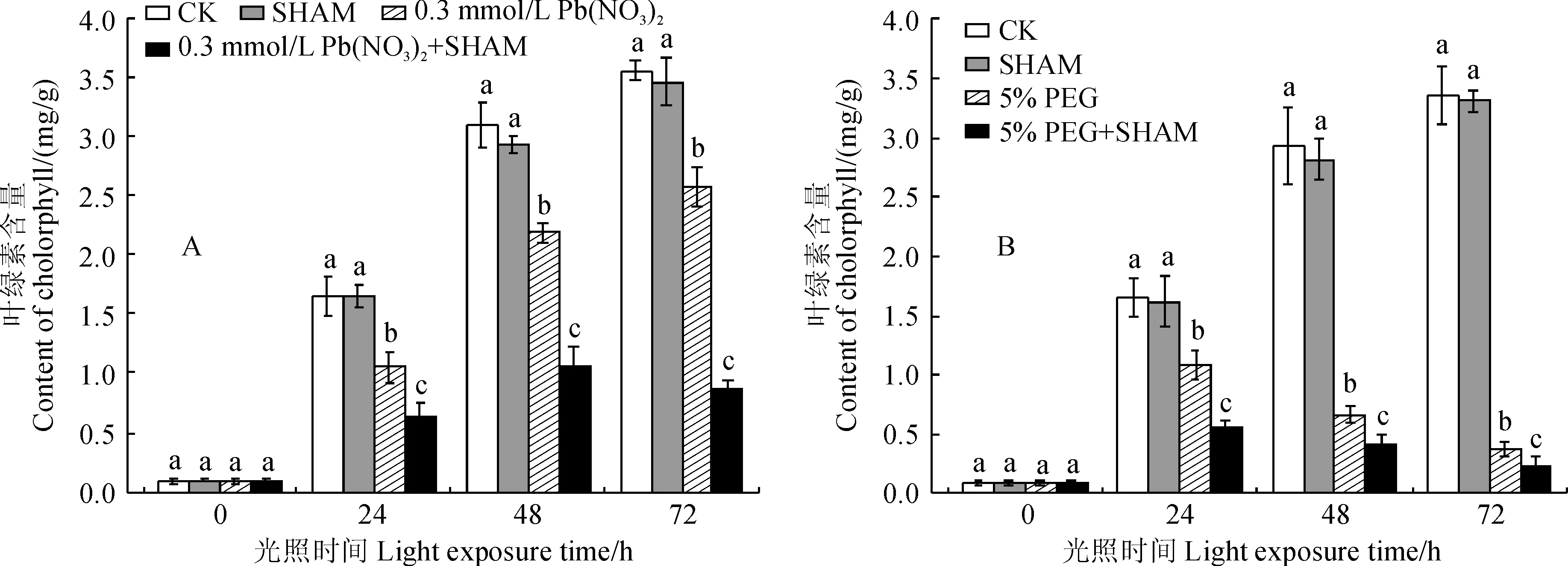
图3 Pb(NO3)2(A)或PEG(B)胁迫下SHAM处理对转绿过程中菜豆叶片叶绿素含量的影响Fig.3 The effects of SHAM treatment on chlorophyll content in greening leaves of bean seedlings under Pb(NO3)2(A) or PEG(B) stress

表3 Pb(NO3)2胁迫下SHAM处理对转绿过程中菜豆叶片叶绿素荧光参数的影响

表4 PEG胁迫下SHAM处理对转绿过程中菜豆叶片叶绿素荧光参数的影响
3 讨 论
许多研究表明,环境胁迫会影响正常生长的植物叶绿素的合成和光化学反应的进行[18-21]。同时,在环境胁迫下, PSⅡ比PSⅠ更易受到环境胁迫的损伤,其运行水平的下降是植物光化学反应能力在环境胁迫下降低的主要原因[22-23]。本研究显示,较之正常转绿的菜豆黄化幼苗,Pb或PEG胁迫导致黄化幼苗在转绿过程中叶绿素含量、Fv/Fm、Fv′/Fm′、Y(Ⅱ)明显下降,同时NPQ显著增加。这一观察结果表明,黄化幼苗在转绿过程中,Pb或PEG胁迫阻碍了叶绿素的合成,降低了PSⅡ的容量和运行水平。以前的研究发现,光合电子传递链中原初电子受体还原性的增加会阻碍光合电子传递链相关蛋白以及叶绿素合成酶等重要蛋白质向质体的输入[14-15]。qP反映了光合电子传递链原初电子受体氧化还原状态。本研究发现,Pb或PEG胁迫均导致了黄化幼苗在转绿过程中qP明显下降,表明Pb或PEG胁迫增加了转绿过程中光合电子传递链原初电子受体的还原性。因此,Pb或PEG胁迫导致的转绿过程中叶绿素合成受阻以及PSⅡ容量和运行水平的下降可能均与光合电子传递链中原初电子受体还原性的增加有关。
同时,本研究中发现,在菜豆黄化幼苗转绿进程中,交替呼吸途径的容量随着光照时间而不断上升,而Pb(NO3)2或PEG胁迫使得交替呼吸途径的容量进一步增加。为了进一步查明在Pb或PEG胁迫下交替呼吸途径与转绿过程的关系,我们比较了在Pb或PEG胁迫下交替呼吸途径的抑制剂SHAM对转绿过程中幼苗叶绿素含量和叶绿素荧光参数水平的影响。本实验室之前工作显示,对菜豆叶片喷洒1 mmol/L的SHAM可有效抑制其交替呼吸途径的水平[24-25]。在无胁迫条件下,对菜豆黄化幼苗叶片施加1 mmol/L SHAM并未引起黄化幼苗转绿过程中叶绿素含量和叶绿素荧光参数水平的显著性变化;而在Pb或PEG胁迫下,对菜豆黄化幼苗叶片施加1 mmol/L SHAM导致了其叶绿素含量、Fv/Fm、Fv′/Fm′、Y(Ⅱ)和qP的进一步下降和NPQ的进一步增加。表明在Pb或PEG胁迫下,抑制交替呼吸途径会加剧Pb或PEG胁迫对菜豆叶绿素合成的抑制,并导致了PSⅡ的容量和运行水平的进一步下降和PSⅡ反应中心非还原性QB相对比例的进一步增加。有研究发现,植物能够通过苹果酸穿梭途径以及光呼吸途径将叶绿体中过多的还原性物质(如NADPH)转移至线粒体中,并通过交替呼吸途径将这些还原性物质消耗掉,从而有效阻止了质体中过多还原性物质的积累,降低了光合电子传递链的还原性[26-27]。据此我们推测,当Pb或PEG胁迫阻碍了菜豆黄化幼苗转绿进程时,交替呼吸途径水平的增加能够通过缓解光合电子传递链的过度还原而使得叶绿素合成酶等重要蛋白质向质体的输入维持在一定的水平,从而缓解了Pb或PEG胁迫对幼苗转绿进程的阻碍作用。但具体的机制仍需要进一步的详细研究。综上,Pb或PEG胁迫阻碍了菜豆黄化幼苗转绿进程,而交替呼吸途径可在一定程度上缓解Pb或PEG胁迫对转绿进程的不良影响。
