当归MYB4转录因子基因的克隆及表达分析
2019-01-03彩霞
, ,彩霞,, ,*
(1.甘肃中医药大学 药学院,甘肃 兰州 730000; 2.甘肃中医药大学 科研实验中心,甘肃 兰州 730000)
当归(Angelicasinensis)是伞形科多年生草本植物,其干燥根是我国传统的大宗药材之一,具有补血活血、调经止痛、润肠通便等功效[1],药用历史悠久,在方剂中的应用甚广[2]。阿魏酸是当归的主要药效成分之一,具有抗血小板聚集、增强前列腺素活性、镇痛、缓解血管痉挛等作用,是治疗心脑血管疾病药品的基本原料[3]。阿魏酸能清除自由基,增强谷胱甘肽转移酶活性,抑制酪氨酸酶促反应,调节人体免疫机能,在医疗保健、美容护肤、食品等行业用途广泛[4-6]。阿魏酸是苯丙烷代谢的中间产物,其生物合成途径由苯丙烷代谢最初的苯丙氨酸解氨酶开始,经过一系列酶促催化反应生成阿魏酸及其衍生物[7]。阿魏酸作为当归的代谢产物,在植物中的合成可能受诱发因子作用下的信号转导、转录因子活性、结构基因调控等多个因素影响[8]。
转录因子是一类能与真核基因启动子中顺式作用元件发生相互作用的DNA结合蛋白,从而激活或抑制特定代谢途径中多个基因的协调表达,进而启动次生代谢途径[9]。转录因子的结构由4个功能区组成,根据高度保守的DNA结合域进行分类,其中MYB转录因子以含有1~3个串联且不完全重复的DNA结构域为共同特征,是数量最多且功能最广泛的一类转录因子[10]。转录因子中提高目的基因表达量的一类称为激活型转录因子,而少数降低目的基因表达量的一类则称为抑制型转录因子[11]。现已发现MYB4参与苯丙烷代谢途径,下调相关代谢支路中多个酶基因的表达,是一类起负调控作用的抑制型转录因子[12]。阿魏酸的合成与苯丙烷代谢具有共同的路径,因此推测MYB4转录因子可能参与阿魏酸的生物合成过程。
迄今为止,对当归中阿魏酸的生物合成研究还仅限于关键酶基因的克隆和分析,而基于当归中阿魏酸生物合成转录因子的克隆和表达的研究还未见报道。本研究采用同源克隆联合RACE的方法克隆当归MYB4基因(AsMYB4)的cDNA全长序列,并对其序列结构特征、系统聚类做初步分析,预测其生物学功能。利用qRT-PCR分析该基因的组织表达特异性,构建当归MYB4基因的大肠杆菌表达菌株,并进行目的蛋白的表达分析,为进一步探索MYB蛋白结构和功能提供重要工具,为阐明阿魏酸生物合成的分子机制奠定理论基础。
1 材料和方法
1.1 试验材料
1.1.1 植物材料 供试当归植株于2017年8月采自甘肃岷县。
1.1.2 菌株与质粒 克隆菌株大肠杆菌(E.coli)DH5α、表达菌株E.coliBL21(DE3)均由甘肃中医药大学科研实验中心实验室保存;克隆载体pMD19-T质粒购自宝日医生物技术(北京)有限公司,表达载体pGEX-4T-3质粒购自Promega公司(美国)。
1.1.3 酶与试剂 GoTaq®Real-Time PCR Systems试剂盒购于Promega公司(美国);SMARTerTMRACE cDNA Amplication Kit、Prime Script RT reagent Kit、In-Fusion®HD Cloning Kit购自宝日医生物技术(北京)有限公司;IPTG(异丙基硫代-β-D-半乳糖苷)、氨苄青霉素、SDS-PAGE凝胶制备试剂盒购自Solarbio公司(北京);氯霉素购自青岛生工生物科技有限公司;质粒DNA小提试剂盒、DNA胶回收与纯化试剂盒购自北京全式金有限公司。
1.1.4 仪器与设备 仪器与设备包括PCR仪(Bio-Rad icycler IQ,美国)、qRT-PCR仪(枫岭FTC-3000P,加拿大)、超微量分光光度计(Thermo BioMate 3S,美国)、B2级生物安全柜(HFsafe-1200 B2,上海)、电泳系统(DYY-5,北京)、气浴恒温摇床(GFL3033,德国)、全波长酶标仪(Bio-Rad Bench mark plus,美国)、多功能成像系统(Azure Biosystems Inc C300,美国)、低温高速离心机(Biofuge fresco ZY-064-1,美国)等。
1.2 试验方法
1.2.1 当归总RNA提取及cDNA的合成 根据温随超等[13]的CTAB法提取总RNA,-75 ℃保存备用。采用PrimeScriptTM逆转录试剂盒合成cDNA的第1链,-20 ℃保存备用。利用10 g/L琼脂糖电泳检测RNA的完整性,以分光光度计法测定RNA浓度及纯度。
1.2.2 当归MYB4基因的保守区克隆 根据同源比对获得MYB4基因的保守区,设计简并引物MYB4-F、MYB4-R(表1),以cDNA为模板扩增MYB4基因核心片段,依据PremixTaq说明书建立PCR反应体系:2×PremixTaq10 μL、cDNA 1 μL、正反向引物各0.5 μL、ddH2O 8 μL。反应条件:94 ℃预变性3 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 1 min,32个循环;72 ℃ 10 min。PCR产物经1.0%琼脂糖凝胶电泳检测后切胶回收,并连接至pMD19-T载体上,热击法转化E.coliDH5α感受态细胞,在抗性平板上随机挑取阳性单克隆,经PCR验证后测序分析。

表1 基因克隆、表达分析和载体构建所需引物序列
1.2.3 当归MYB4基因cDNA末端扩增 使用SMARTerTMRACE cDNA Amplication Kit合成3′-RACE和5′-RACE cDNA。根据测序获得的MYB4保守区序列,设计3′端、5′端克隆的特异引物3′GSP1、3′GSP2、5′GSP(表1),进行RACE扩增。PCR产物经电泳检测后进行TA克隆。
1.2.4 当归MYB4基因全长扩增 将测序正确的MYB4末端序列和核心片段进行拼接,获得当归MYB4基因cDNA全长序列,由编码区序列设计全长扩增引物MYB4-S和MYB4-A(表1)。以5′-RACE cDNA为模板进行PCR扩增,除退火温度为56 ℃外,反应体系及反应程序同1.2.2。PCR产物经检测后进行TA克隆,分析测序结果与理论全长序列的一致性。
1.2.5 生物信息学分析 以NCBI的ORF Finder寻找当归MYB4基因的开放阅读框;采用NCBI的Blast功能执行核苷酸及氨基酸序列的同源搜索,利用DNAMAN软件对同源物种的氨基酸序列进行多重比对,以MEGA 5.0软件中的邻位归并法做聚类分析并构建系统进化树。分别运用ExPASy在线服务器的ProtParam、ProtScale分析该基因编码蛋白质的理化性质;采用SignalP 4.1 Serve(http://www.cbs.dtu.dk/services/SignalP)进行信号肽预测;使用TMHMM server v.2.0(http://www.cbs.dtu.dk/services/TMHMM)预测蛋白质的跨膜区结构特征;借助Psort(http://psort. hgc. jp/form. Html)进行亚细胞定位预测分布区域;应用ScanProsite(https://prosite.expasy.org/)分析氨基酸序列的保守结构域;采用PBIL(https://prabi.ibcp.fr/htm/site/web/login)分析当归MYB4基因编码蛋白质的二级结构;利用SWISS-MODEL(http://swissmodel.expasy.org/)建立蛋白质三维空间结构模型。
1.2.6 当归MYB4基因表达分析 以当归GAPDH基因为内参基因,设计引物GAPDH-qF、GAPDH-qR(表1),由当归MYB4基因的特异性序列设计定量PCR引物MYB4-qF、MYB4-qR(表1),以当归叶片、叶柄、根部的cDNA为模板,参照GoTaq®Real-Time PCR Systems试剂盒说明书,进行实时荧光定量PCR分析。反应体系:2×qPCR Master Mix 10 μL、cDNA 1 μL、上下游引物各0.8 μL、无RNase水7.4 μL。扩增程序:95 ℃预变性3 min;95 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,40个循环。每个组织样品设置3个平行,利用2-ΔΔCt方法进行数据分析。
1.2.7 原核表达载体的构建 根据当归MYB4基因的ORF序列设计含EcoRⅠ酶切位点的特异引物MYB4-tF和MYB4-tR(表1),以测序后全长序列正确的质粒为模板,除退火温度为58 ℃外,反应体系和反应程序同1.2.2。PCR产物经电泳鉴定后,切胶回收目的DNA。
提取pGEX-4T-3载体质粒,用EcoRⅠ单酶切,回收载体。采取In-Fusion®HD Cloning Kit构建目的片段与载体的重组质粒,采用热击法将重组产物转入E.coliBL21(DE3)感受态细胞中,筛选阳性单菌落,经PCR验证后进行测序分析。确定目的序列与载体组装无误后,将重组后的载体命名为pGEX-4T-3-AsMYB4。
1.2.8 当归MYB4基因的原核表达 将含pGEX-4T-3-AsMYB4质粒的阳性克隆接种于10 mL LB液体培养基(含氨苄青霉素、氯霉素)中,振荡培养过夜。次日进行亚培养至A600约为0.6时,吸取2 mL菌液作为0 h的非诱导样品,在剩余菌液中加入终浓度为0.5 mmol/L的IPTG,23 ℃、160 r/min诱导6 h。取2 mL菌液,低温离心收集菌体,加少量1×PBS缓冲液(含溶菌酶、蛋白酶抑制剂)混匀,加入适量4×SDS上样缓冲液,沸水煮5 min,冷却后利用10% SDS-PAGE检测。同时,以含空载体质粒菌作为对照。
1.2.9 重组蛋白表达鉴定 诱导结束后,4 ℃、5 000 r/min离心15 min,收集菌体。加入适量的1×PBS缓冲液重悬菌体,于冰浴中超声破碎菌体至破碎完全,4 ℃、12 000 r/min离心10 min,吸取上清并保留菌体沉淀,分别进行10% SDS-PAGE检测。
2 结果与分析
2.1 当归总RNA质量分析
从当归不同组织提取的总RNA的A260/A280为1.9~2.0,表明RNA质量较好。RNA电泳检测结果显示,样品RNA的28S rRNA信号强于18S rRNA,证明RNA完整性好,无降解(图1)。
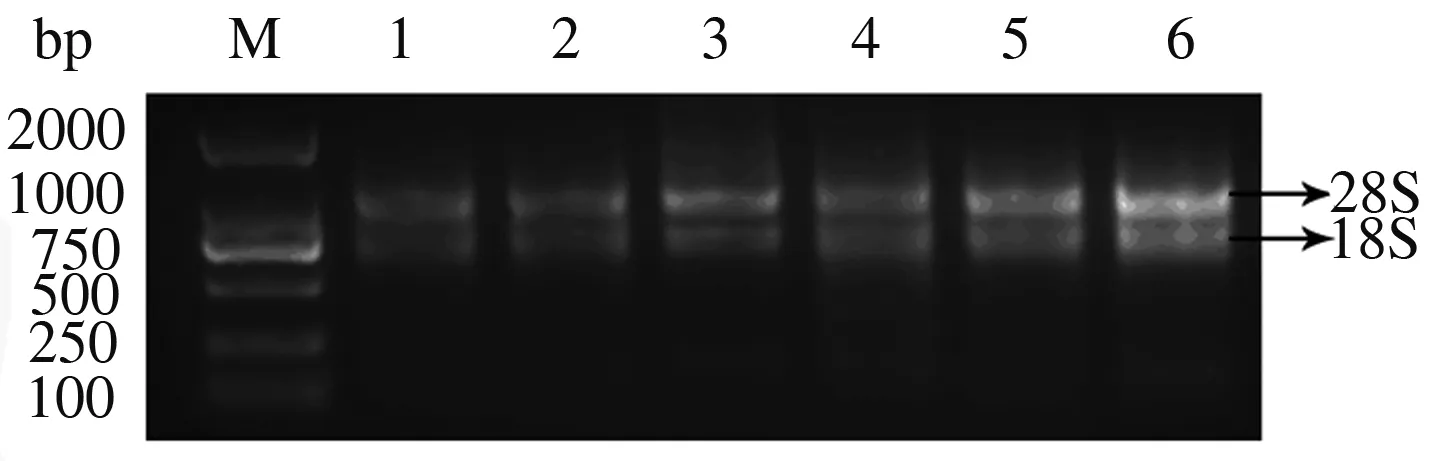
M:DNA分子质量标准;1—2:根RNA;
2.2 当归MYB4基因全长cDNA的克隆
MYB4基因保守区扩增得到1个长291 bp的DNA片段;5′端扩增得到1个长486 bp的片段,与核心片段部分重叠,并含有起始密码子;3′端扩增得到1个长927 bp的带有多聚A尾巴的片段,且与保守区部分重叠;全长扩增获得1条约1 000 bp的特异条带。上述测序结果均与预测结果一致(图2)。
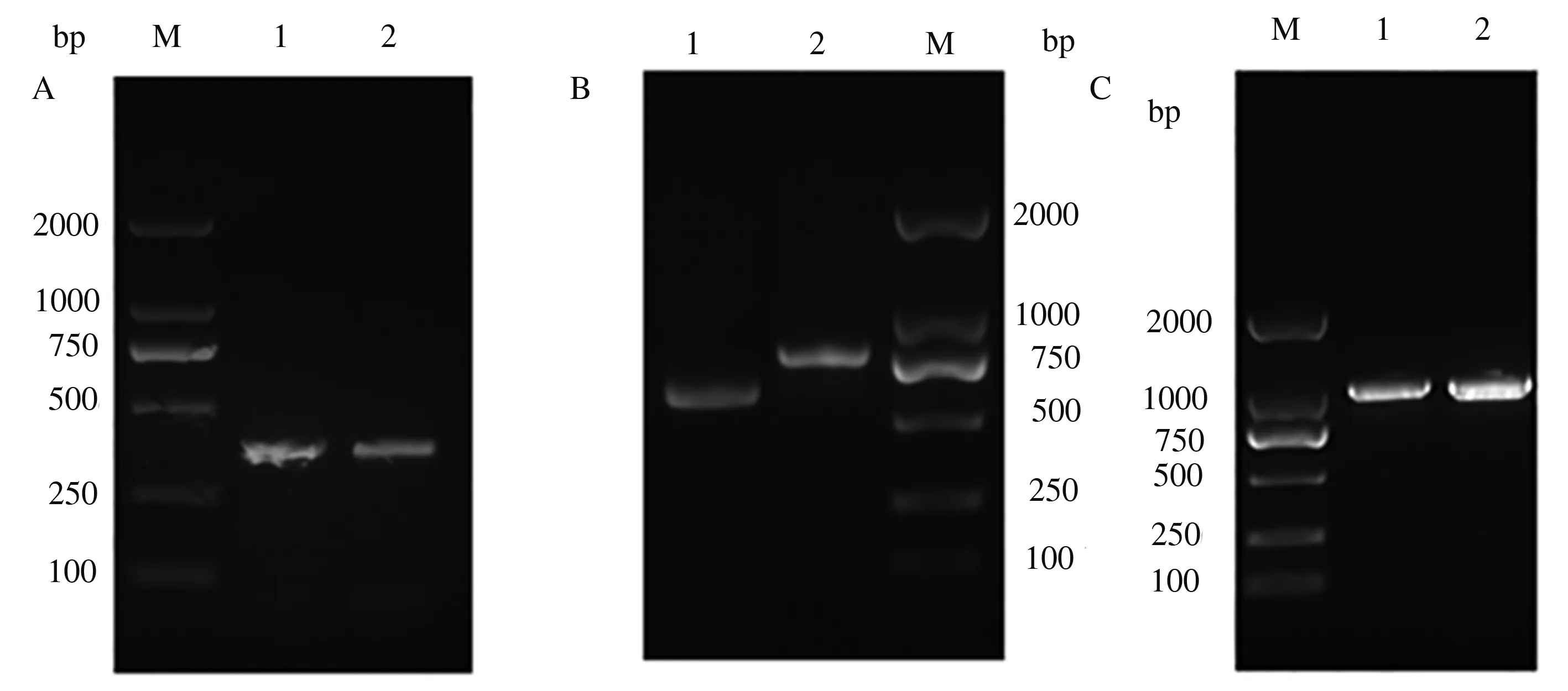
A:AsMYB4基因保守区,M为DNA分子质量标准,1—2为AsMYB4基因保守区PCR产物;B:RACE产物,M为DNA分子质量标准,1为5′-RACE产物,2为3′-RACE产物;C:AsMYB4基因全长,M为DNA分子质量标准,1—2为AsMYB4基因全长PCR产物
根据测序结果,得到1条长为1 189 bp的当归MYB4基因cDNA全长序列,ORF包含804个核苷酸,编码的多肽链由267个氨基酸构成,3′、5′非翻译区分别为207、178 bp,ATG、TAA分别位于起始密码子、终止密码子处(图3)。Blast比对分析结果显示,当归MYB4与胡萝卜MYB308的一致性达到93%,与柠条锦鸡儿MYB4、中国辣椒MYB4、陆地棉MYB308、黄瓜MYB308等氨基酸序列同源性达到74%以上。本研究结果进一步证实,获得的序列是源于当归MYB4基因的全长cDNA,命名为AsMYB4(GenBank登录号:MG736315)。上述与当归MYB4一致性较高的MYB转录因子,大多与苯丙烷代谢相关[10-12],推测当归MYB4参与苯丙烷代谢调控。

下划线处表示起始密码子,方框内表示终止密码子
2.3 AsMYB4基因的生物信息学分析
2.3.1 AsMYB4蛋白的理化性质 AsMYB4蛋白的预测分子质量为30 ku,分子式为C1 280H2 046N390O404S19,理论等电点为8.45,负电荷残基总数(Asp+Glu)为33,正电荷残基总数(Arg+Lys)为37,不稳定系数为48.41,属于不稳定蛋白;亲水性得分为-0.743,为亲水蛋白(图4)。
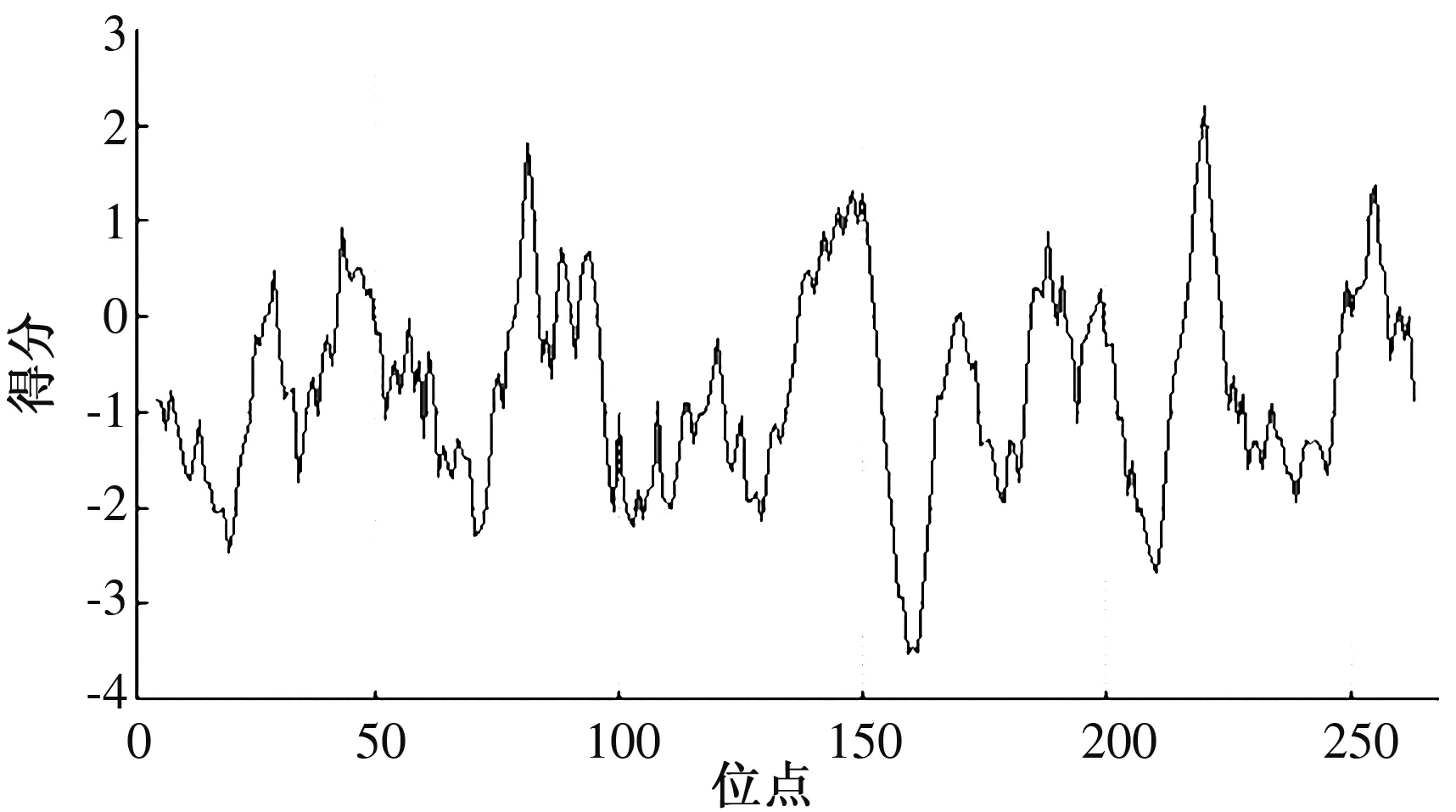
图4 AsMYB4蛋白亲水/疏水性预测
2.3.2 AsMYB4蛋白的结构特征 保守结构域分析结果显示,AsMYB4氨基酸序列的N端构成了R2、R3 两个典型的MYB-DNA结合结构域,由2个HTH结构形成,为MYB蛋白的典型结构特征。如图5所示,AsMYB4氨基酸序列的DNA结合结构域分别有3、2个具有高度保守性的色氨酸,间隔18~19个氨基酸均匀排列,且存在MYB蛋白N端的特征序列(MGR[A/T]PCC[E/D]K[V/I]G)[14]。在AsMYB4的DNA结合结构域中,存在1个和bHLH转录因子相互作用的结构域([D/E]Lx2[R/K]x3Lx6Lx3R)[15],推测AsMYB4可能与其他bHLH型转录因子形成转录复合体,共同调节靶基因的表达。
AsMYB4蛋白二级结构主要由30.34%的α螺旋、46.07%的随机卷曲、少量的延伸链、β转角组成(图6)。三维建模结果显示,AsMYB4蛋白与胡萝卜MYB308蛋白的空间结构相近,即在DNA结合域构成2个螺旋-转角-螺旋(helix-turn-helix,HTH)结构,在空间上形成2个环状的沟槽,符合R2R3-MYB蛋白的构型(图7)。
2.3.3 AsMYB4蛋白的功能预测 AsMYB4的氨基酸序列中没有跨膜结构或者膜结合区域,可能是膜外蛋白。AsMYB4蛋白不具有信号肽,说明AsMYB4蛋白不是一个分泌蛋白。AsMYB4蛋白存在于核内的可能性最大,究其原因可能是转录因子蛋白运输到细胞核,与靶基因的顺式作用元件结合才能调控基因的表达[16]。因此,亚细胞定位的预测进一步证明AsMYB4是一个MYB类转录因子。

方框中为R2R3-MYB的N端特征序列,圆圈中为与bHLH蛋白相互作用的特征序列

h:α螺旋;c:随机卷曲;e:延伸链;t:β转角
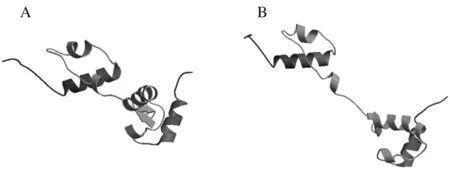
A:当归MYB4蛋白的三级结构模型;
2.3.4 AsMYB4蛋白的同源比对及系统进化树分析 同源比对分析结果表明,AsMYB4氨基酸序列在N端存在保守的2个DNA结合结构域,且与其他MYB转录因子的同源区都集中在这一区域。C端同源性极低,对C端进行搜索发现,AsMYB4的C端有2个与转录抑制相关的保守基序C1(PDLNL[D/E]LxI[G/S])、C2(RGIDPxTHRP[L/I]NE),这与其他MYB类转录抑制因子的结构特征一致[17](图8)。
系统进化树分析表明,AsMYB4与胡萝卜MYB308聚为一类,与黄瓜MYB308、大豆MYBZ2、麻风树MYB308、柠条锦鸡儿MYB4的亲缘关系较近,与石榴MYB1、葡萄MYB4、野茶树MYB4等也聚为一类,但亲缘关系相对较远(图9)。研究表明,上述MYB蛋白在调节苯丙烷类代谢过程中起负调控作用[18-19]。由于在该系统树上,功能相关的MYB大都聚到一起,结合前面的结构和功能域的分析,推测AsMYB4属于R2R3类MYB蛋白的第4亚家族[12],作为转录抑制因子下调苯丙烷代谢途径中相关酶基因的表达。
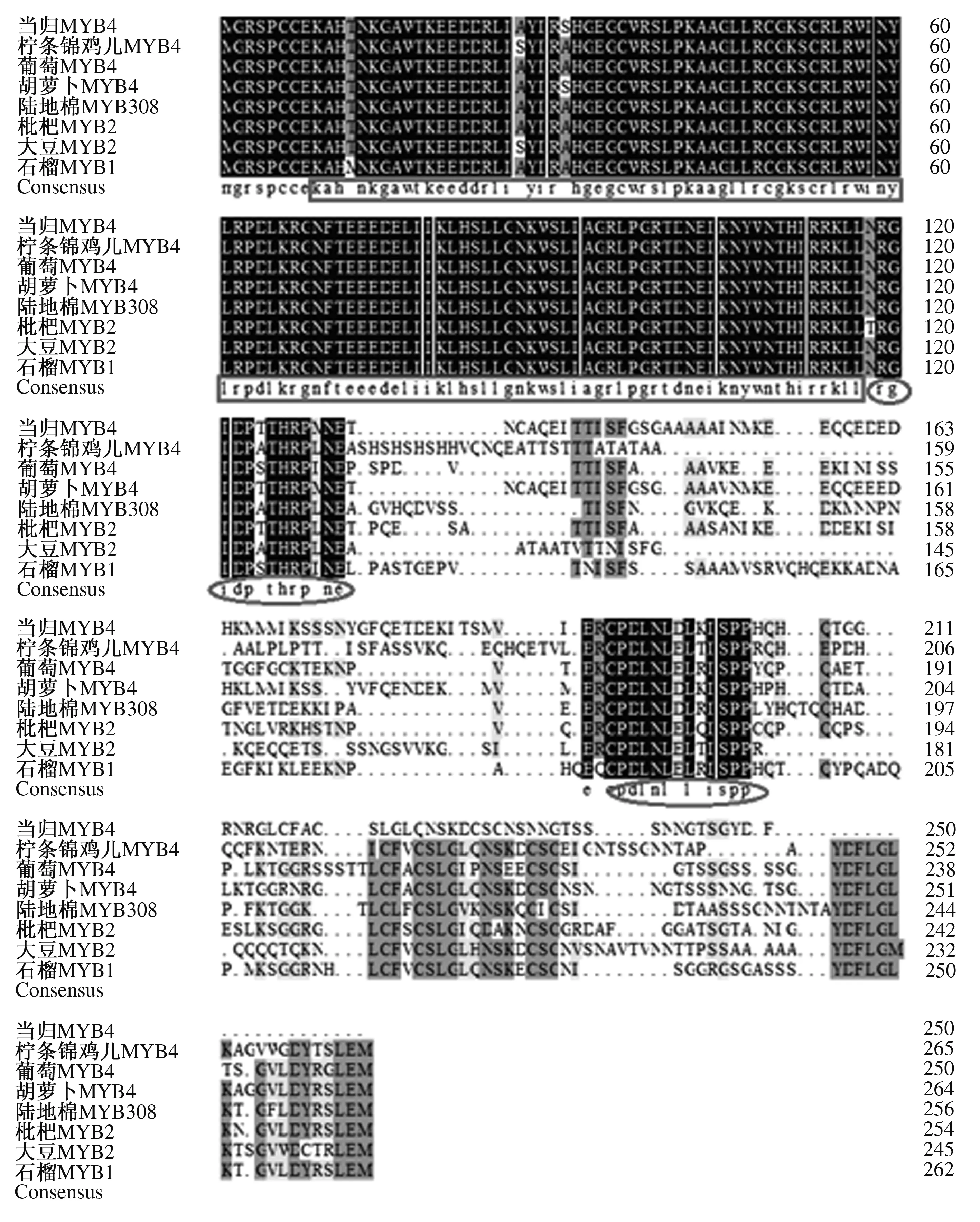
方框中由上至下为2个DNA结合结构域,圆圈中由上至下分别为C1、C2转录抑制保守基序
2.4 AsMYB4基因组织特异性表达分析
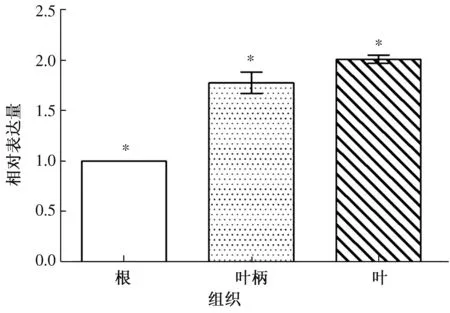
利用qRT-PCR检测AsMYB4的表达量,结果表明,AsMYB4基因在当归不同组织中的表达量不同,且差异达到显著水平,叶片中表达量最高,分别是叶柄、根的1.1、2.0倍(图10)。
2.5 AsMYB4基因原核表达菌株的鉴定
随机挑取6个单菌落,用目的基因引物进行PCR验证,电泳检测结果显示,特异条带大小均接近804 bp(图11),表明AsMYB4片段已插入表达载体中。菌样测序结果与AsMYB4基因的编码区序列完全一致,表明原核表达菌株构建成功。
2.6 AsMYB4蛋白原核表达分析
经10% SDS-PAGE电泳检测,与含空载体质粒菌及未诱导的重组菌相比,IPTG诱导的重组菌在56 ku处出现特异条带,其中包含大小为26 ku的GST标签蛋白,则AsMYB4蛋白大小约为30 ku(图12)。检测结果与预期一致,初步认为获得了目的蛋白。AsMYB4蛋白在上清液中几乎没有,主要存在于沉淀中,即目的蛋白以胞内不溶性状态存在,可能是目的蛋白表达后未能正常折叠,不能形成有活性的成熟蛋白[20],后续将对培养条件进行优化。

图中数字表示Bootstrap验证中基于1 000次重复该节点可信度
*表示0.05水平显著性差异
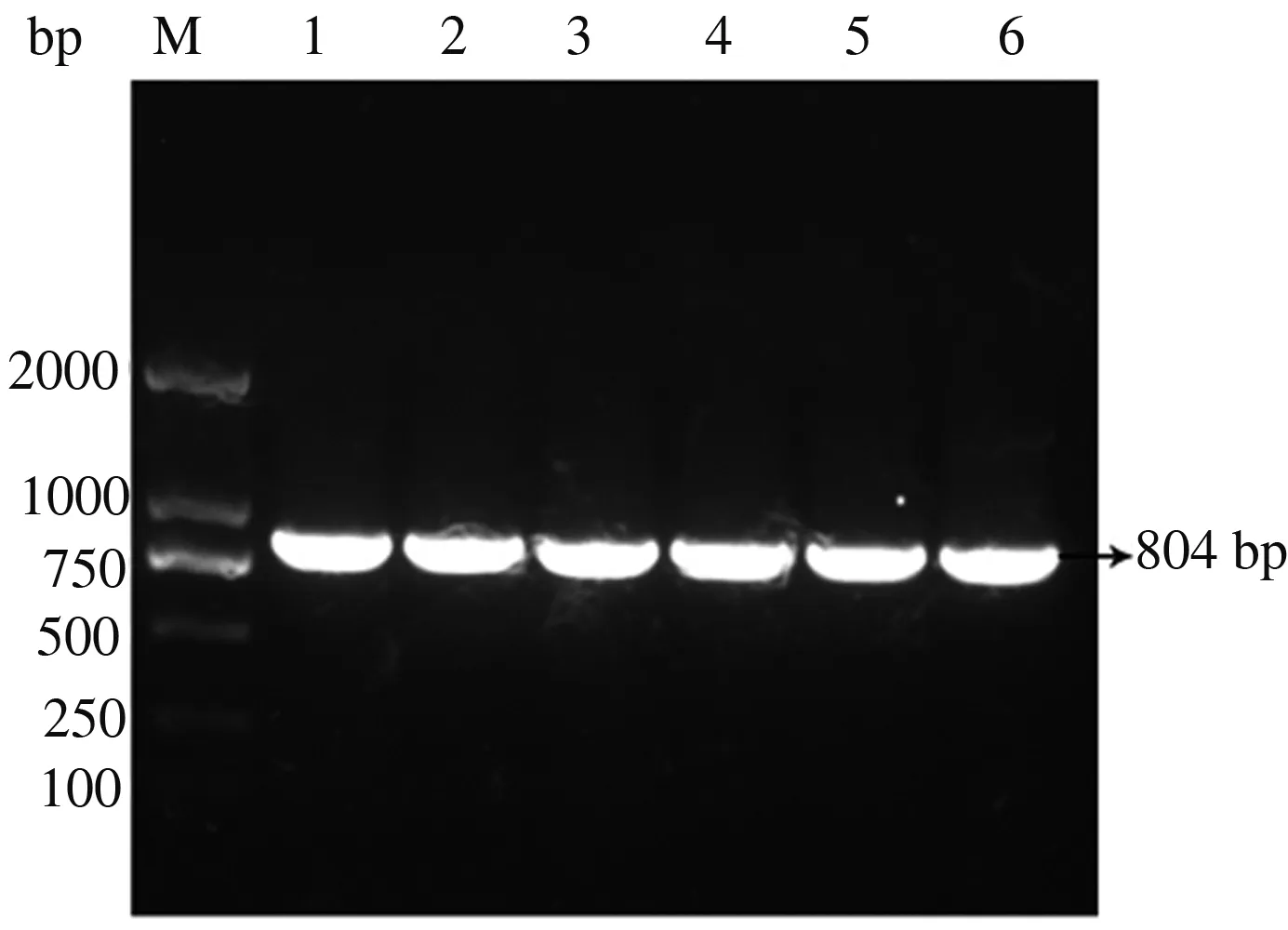
M:DNA分子质量标准;1—6:pGEX-4T-3-AsMYB4菌落PCR
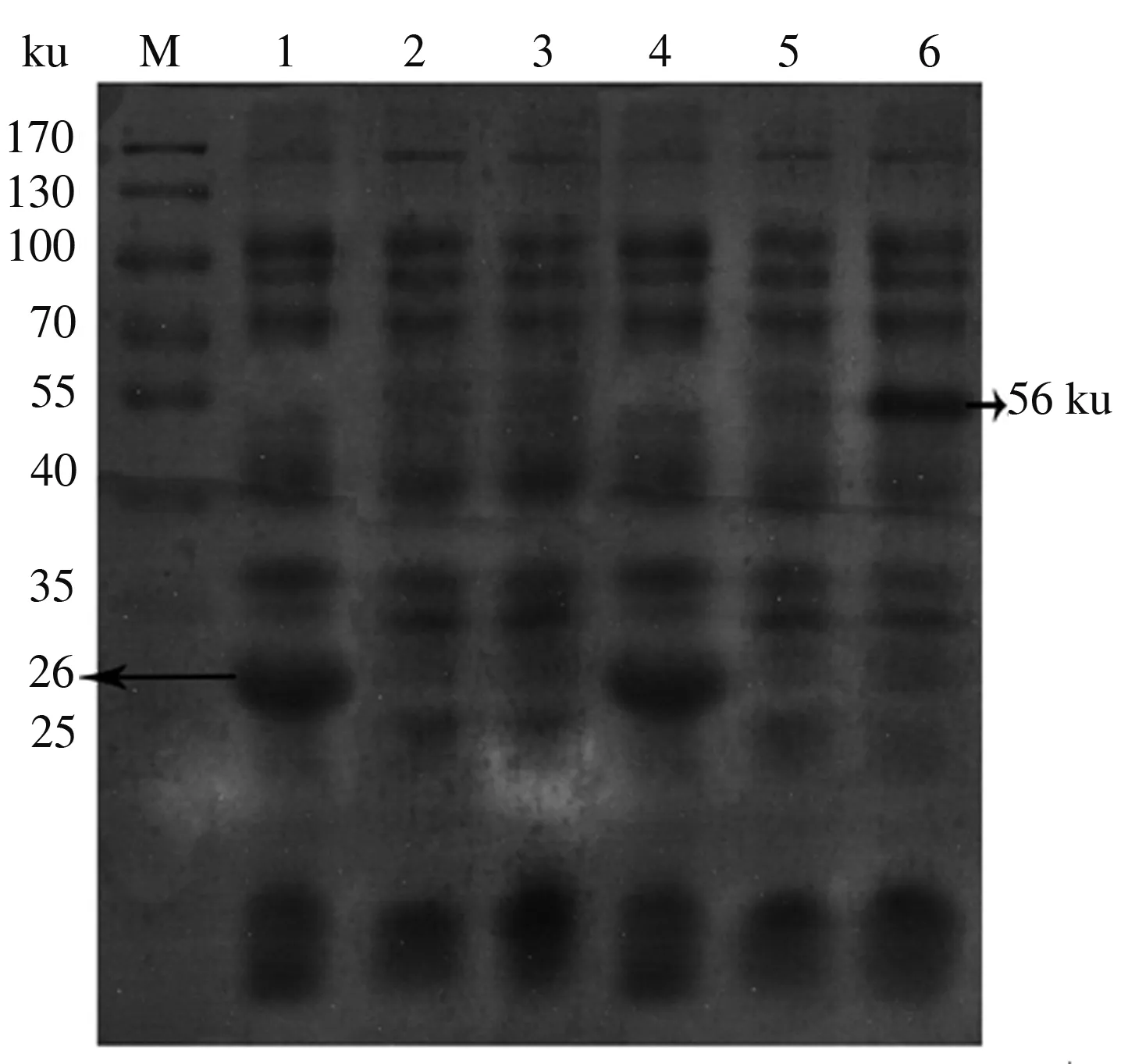
M:蛋白质分子质量标准;1、4:pGEX-4T-3空载菌未诱导和诱导6 h全细胞裂解液;2—3:pGEX-4T-3-AsMYB4重组菌未诱导上清和沉淀;5—6:pGEX-4T-3-AsMYB4重组菌诱导6 h的上清和沉淀
图12AsMYB4蛋白原核表达分析
3 结论与讨论
转录因子在转录水平上往往是多途径、多基因协同调控,在植物次生代谢研究方面具有重要作用。本研究利用同源克隆结合RACE的方法,从当归中克隆出1个AsMYB4基因,其cDNA序列全长1 189 bp,包含804 bp的ORF,编码267个氨基酸,3′、5′UTR分别为207、178 bp,为典型的R2R3-MYB类转录因子家族成员。氨基酸比对结果显示,AsMYB4与胡萝卜MYB308的同源性最高,达到93%。AsMYB4氨基酸序列的N端存在保守的R2、R3 DNA结合结构域和1个与bHLH转录因子相互作用的结构域。C端同源性低,存在2段与抑制型MYB蛋白相同的保守基序。系统进化分析表明,AsMYB4与伞形科植物胡萝卜MYB308的亲缘关系最近,同属于第4亚族抑制型转录因子。AsMYB4基因在根部的表达量最低,这一点与当归中的药效成分阿魏酸主要是在根部合成一致,进一步证明了AsMYB4是一个R2R3-MYB负调控转录因子,可能在阿魏酸生物合成中起转录抑制作用。
获得纯化的转录因子蛋白,最有效的方法就是通过原核表达系统在大肠杆菌中大量表达目的重组蛋白[21]。本研究成功构建当归MYB4基因的大肠杆菌表达菌株,经IPTG诱导目的蛋白大量表达,后续将通过优化表达条件获得有活性的AsMYB4蛋白,用于体外凝胶迁移以鉴定蛋白质与元件的作用情况,为深入研究AsMYB4基因在阿魏酸合成调控中的功能奠定基础。
