IL-33/ST2信号通路与脂肪代谢关系研究进展
2019-01-03成萍
, ,成萍, ,,,*
(1.聊城大学 生命科学学院,山东 聊城 252059; 2.聊城大学 药学院,山东 聊城 252059)
肌内脂肪(Intramuscular fat,IMF)是衡量肉品质的重要指标,能够影响肉的嫩度和风味,并且IMF所反映的大理石纹等级直接影响肉质量等级,决定了肉产品的经济性状。肌内脂肪是脂肪沉积的主要形式,脂肪组织通过代谢和细胞的内分泌功能在调节能量平衡中起着至关重要的作用。脂肪细胞分化是受多种细胞因子或信号通路调控的复杂网络体系。
IL-33/ST2(Interleukin-33/interleukin-1 receptor like 1)是近年来新发现的能够调控白色脂肪米色化、棕色或米色脂肪产热的重要信号通路[1-3]。因此,阐明脂肪细胞分化、IL-33/ST2信号通路及IL-33/ST2信号通路在脂肪代谢中的作用机制,旨在为肥胖症、代谢综合征、胰岛素糖尿病等代谢相关疾病的治疗提供理论指导。
1 脂肪细胞分化
脂肪细胞分化过程包括2个阶段,第1个阶段是胚胎干细胞或脂肪组织中的间充质干细胞(Mesenchymalstem cells,MSCs)分化为脂肪祖细胞并进一步形成前体脂肪细胞,第2个阶段是前体脂肪细胞终末分化为成熟脂肪细胞[4-5]。成熟脂肪细胞具有参与脂类合成、转运、能量消耗以及生产能量平衡调节相关脂肪因子的功能。研究表明,在脂肪分化期间有许多成脂分化调控因子发挥着关键作用,例如CCAAT/增强子结合蛋白家族(CCAAT/enhancer-binding protein family,C/EBPs)、骨形成蛋白(Bone morphogenetic proteins,BMPs)、过氧化物酶体增殖物激活受体(Peroxisome proliferators-activated receptors,PPARs)[6-8]。
脂肪组织是机体调节能量平衡的中心,哺乳动物中存在2种不同功能类型的脂肪组织,分别为白色脂肪组织(WAT)和棕色脂肪组织(BAT)。WAT能够作为储存库将过多的能量以甘油三酯的形式储存起来,BAT能够在寒冷和应激条件下为机体产生热量。有关脂肪细胞分化的信号转导机制已被广泛研究,其中C/EBP家族成员、PPARγ和cAMP效应元件结合蛋白(cAMP-response element binding protein,CREB)是白色脂肪细胞特异性转录级联中的关键因子,在脂肪细胞成熟期的早期阶段,上调C/EBPβ和C/EBPδ蛋白能够增强PPARγ和C/EBPα的表达,随后PPARγ分别与C/EBPα、C/EBPβ构成反馈回路,进一步促进白色脂肪细胞的终末分化。BMP7能够激活形成棕色脂肪细胞的完整程序,包括诱导早期调节因子PRDM16(PR domain-containing 16)表达,增强脂肪转录因子PPARγ和C/EBPs表达,并且促进p38促分裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)途径的活化[9]。因此,进一步阐明IL-33/ST2信号通路在脂肪细胞分化及脂肪代谢中的功能具有重要意义。
2 IL-33/ST2信号通路
2.1 ST2的变异体及其调控机制
白介素1受体样1(IL1RL1,习惯称之为ST2)是白介素1受体家族成员之一,在1989年最先被命名,多年来一直被认为是与免疫和炎症相关的孤儿受体[10]。人的ST2基因有4个转录变异体,其中2个变异体是最重要的,分别为跨膜ST2受体(ST2L,也被称为IL1RL1-b)和血清可溶性ST2受体(sST2,也被称为IL1RL1-a)。ST2的选择性启动子以及其mRNA的3′端选择性剪接,导致了sST2和ST2L变异体的产生[11]。ST2具有1个近端启动子和1个远端启动子,它们能够影响ST2基因的转录调控机制,但是对sST2和ST2L的转录调控还不完全清楚[12]。在Schmitz等[13]报道中提及白介素-33(IL-33)是ST2的配体,能够参与sST2和ST2L的转录调控,这为更好地理解sST2和ST2L的功能提出了思路。
sST2的产生受多种信号通路的调控。研究表明,在sST2存在的情况下,使用IL-33处理心肌细胞后,观察到血管紧张素Ⅱ和苯肾上腺素的促肥大效应被阻断[14]。若在肺泡上皮细胞和心肌细胞中,用特殊的抑制剂CAPE对核因子-κB(Nuclear factor-κB,NF-κB)信号通路进行阻断,可以阻止这些细胞产生sST2[15]。在人类乳腺癌细胞系MCF-7中,成纤维细胞生长因子2可通过MEK/ERK信号通路,促进sST2的产生[16]。在人类支气管上皮细胞中,溶血磷脂酸能够通过一种依赖于NF-κB或JNK的方式来增加sST2的表达量[17]。
IL-33/ST2信号通路能够激活Ⅱ型CD4+T细胞(Type 2 CD4+T-helper cells,Th2)效应细胞,并释放Th2相关细胞因子来参与炎症和免疫反应。在这个过程中,ST2L能够调节IL-33对Th2的炎症作用,而sST2则与Th2炎症反应的衰减相关。例如,在小鼠的模型试验中发现,IL-33能够通过与ST2L的相互作用,减少心肌纤维化和细胞凋亡、防止心肌细胞肥大,从而达到对心肌细胞的保护[14]。
2.2 IL-33与ST2的相互作用
IL-33作为新发现的细胞因子,是IL-1家族的新成员之一,能被大多数细胞分泌,机体多以其应对组织损伤[18]。IL-33通过与膜表面受体ST2L和IL-1R辅助蛋白(IL-1 receptor accessory protein,IL-1RAP)结合,组成受体复合物来发挥细胞功能。IL-33结合ST2L时,IL-1RAP能够增强IL-33对ST2L的亲和力,是后续信号传导顺利进行的必要条件[19]。IL-33和ST2L的相互作用能够激活MAPK和几种生化途径,主要是由于NF-κB激酶复合体抑制子的激活,触发了NF-κB的活性所致[20]。但也有人认为,IL-33可能具有不依赖于ST2L受体的胞内功能。另有研究发现,sST2与IL-33结合会中断IL-33和ST2L之间的相互作用,从而导致它们在细胞中的功能被阻断,因此,sST2也被认为是一种诱骗受体(Decoy receptor)(图1)。在这种情况下,ST2系统不但能够以ST2L跨膜异构体的形式作为IL-33行使功能的介导者,而且可以通过sST2异构体的形式抑制IL-33的功能。另外,IL-33也能够参与调控ST2L和sST2的mRNA转录,它能够增加ST2L的mRNA表达量,并降低sST2的mRNA表达量[22]。
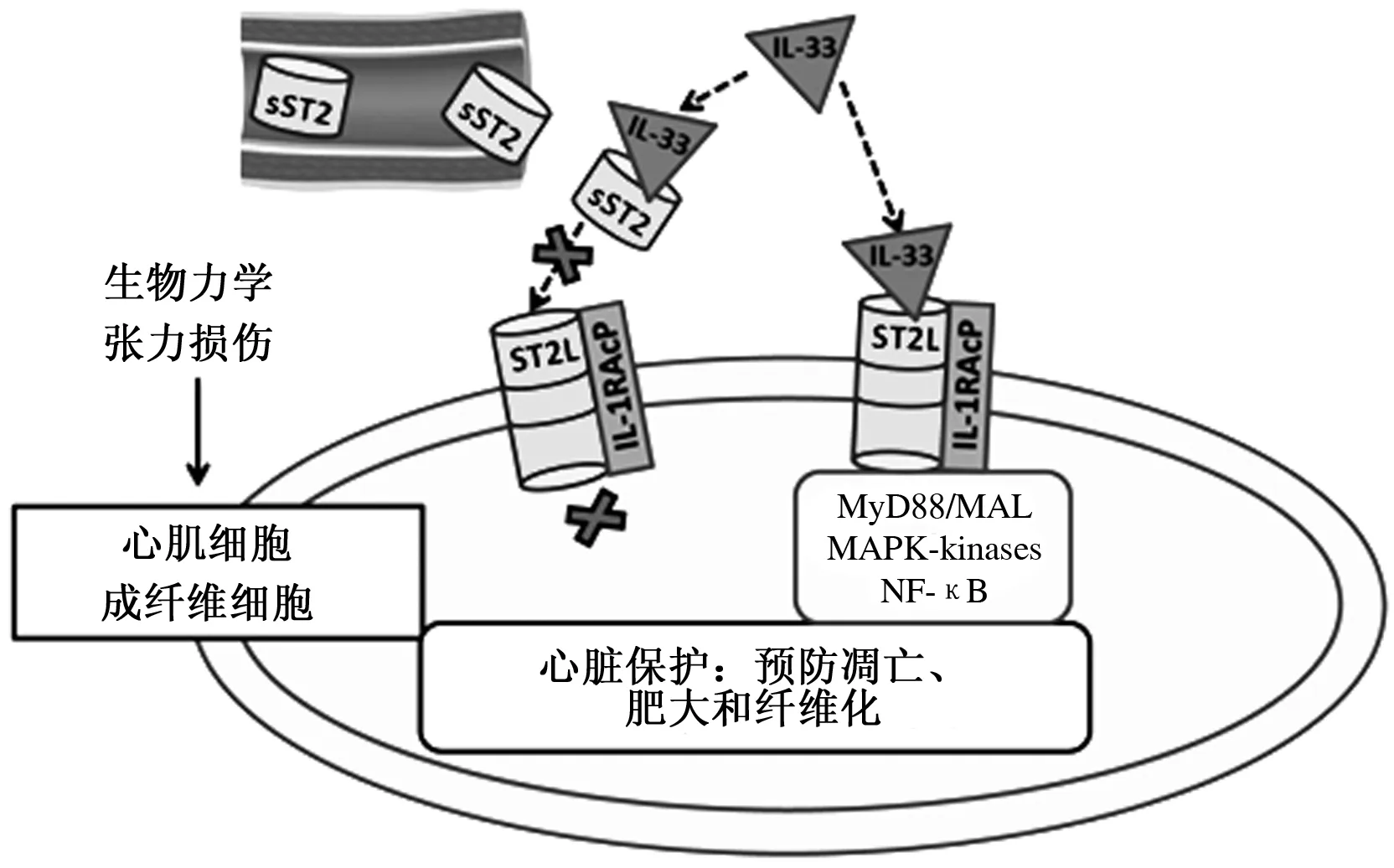
参考文献[21]
肥胖与代谢紊乱及许多健康问题密切相关,是导致糖尿病、心血管疾病及部分癌症表型的主要危险因素[23]。关于IL-33/ST2与肥胖的关系,已有报道表明,在脂肪组织和肝脏中表达的IL-33/ST2对肥胖有一种“自然”的保护作用,原因是IL-33/ST2途径的激活增加了抗炎性细胞因子并减少了脂肪细胞分化和脂肪储存[24]。为研究IL-33/ST2对肥胖影响的分子机制,分别对心脏、脂肪组织和肝脏中IL-33/ST2系统mRNA的表达情况进行检测,发现与对照组相比,肥胖Zucker大鼠IL-33的mRNA表达水平在脂肪组织中显著偏低,ST2L的mRNA表达水平在肝脏中显著偏低,sST2的mRNA表达水平在所有供试组织中均显著偏低,因此,肥胖Zucker大鼠组织可以通过减少sST2的表达来促进IL-33对膜受体ST2L的作用,以形成一种肥胖保护机制[25]。但是,目前尚不知IL-33/ST2信号通路具体是以何种方式或途径来调控脂肪细胞分化的。
3 IL-33/ST2与脂肪细胞代谢
3.1 IL-33及其相关基因与白色脂肪米色化
免疫细胞和WAT的米色化(Beiging)关系紧密,Ⅱ型先天淋巴细胞(ILC2)最初是在脂肪相关淋巴簇中发现的[26],对于招募和维护驻留在WAT中的嗜酸性粒细胞至关重要[27]。IL-33能够刺激ILC2产生大量的Ⅱ型细胞因子IL-5和IL-13,继而导致WAT的米色化。关于ILC2诱导米色脂肪细胞产生的机制,近期研究已经做了很好的解释。使用ILC2的兴奋剂IL-33处理后,会导致小鼠WAT中ILC2数量增加,同时米色脂肪细胞和耗氧量也随之增加,与之相反的是,IL-33的处理对BAT没有影响;进一步研究发现,IL-33-/-型小鼠的体质量比对照组明显增加,机体内WAT明显增多,但ILC2和米色脂肪细胞的数量均减少;重组无淋巴小鼠(Rag2-/-Il2rg-/-)在只有ILC2的情况下就足以导致WAT的米色化,从而显示了IL-33和ILC2在调控脂肪组织生长中的重要作用[2-3]。此外,IL-13诱骗受体(IL-13 decoy receptor,IL-13Rα2)能够通过调控内源IL-13的表达水平,限制IL-33在脂肪组织中的调控作用。相关研究发现,使用IL-33处理后,小鼠血清和组织中IL-13的含量增加,并伴随着嗜酸性粒细胞、巨噬细胞(Alternatively activated macrophages,AAMs)和Ⅱ型固有淋巴样细胞的含量升高,同时体质量、脂肪量和空腹血糖水平随之降低,上述症状在IL-13Rα2缺陷型小鼠中更为突出,但在IL-13缺陷型小鼠中却呈现减弱趋势;除此之外,还检测到在肥胖小鼠脂肪组织中IL-13Rα2表达量较高,在IL-13Rα2缺陷型小鼠中IL-13的表达量较高[28]。因此,可以说明IL-13Rα2能够限制IL-33/IL-13轴在肥胖中的保护作用,可作为脂肪组织中的关键检验点。
ILC2控制WAT米色化的不同机制如图2所示,当ILC2被IL-33刺激后,可以通过多种方式调控脂肪组织的生物学功能。首先,被刺激后的ILC2能够产生Ⅱ型细胞因子IL-5,以激活WAT中的嗜酸性粒细胞,从而选择性激活AAMs[30-31]。与此同时,被激活的嗜酸性粒细胞能够触发并产生IL-4,作为对IL-4的应答,AAMs能够产生去甲肾上腺素,从而导致脂肪组织的米色化[1]。此外,Lee等[3]从脂肪祖细胞角度阐明了米色脂肪细胞产生的机制,即当IL-4受体(IL-4Rα)的组织特异性缺失时,接收到该信号的IL-4可绕过AAM-去甲肾上腺素轴直接作用于脂肪祖细胞,这是由于在IL-4的刺激下,能够上调脂肪祖细胞中米色脂肪细胞分化相关基因的表达,但IL-4Rα信号在已分化的脂肪细胞中是无用的。并且有趣的是,IL-4Rα不但能为IL-4传递信号,而且还能结合IL-13,即使在缺乏嗜酸性粒细胞产生IL-4的情况下,也会有大量的脂肪祖细胞产生。因此,由ILC2产生的IL-13可以通过与IL-4Rα的结合,直接作用于脂肪祖细胞,并能与嗜酸性粒细胞生成的IL-4形成协同作用,从而促进米色脂肪细胞的产生与发育。但在米色脂肪细胞产生的过程中,关于IL-4和IL-13的协同作用机制以及两者之间的相对贡献仍有待进一步研究。
Brestoff等[2]对ILC2和ILC3所表达的部分肥胖相关基因的比较研究发现,前蛋白转化酶枯草溶菌素1(Proprotein convertase subtilisin/kexin type 1,PCSK1)以及它的靶基因PENK(Proenkephalin A)在ILC2中表达量较高。其中,蛋氨酸脑啡肽(Methionine enkephalin,MetEnk)是PENK加工后的一个产物,由ILC2产生。当ILC2受到IL-33的刺激时,MetEnk的产量随之增加。利用MetEnk处理供试动物,会导致WAT耗氧量升高以及米色脂肪细胞标记物增温素——UCP1的表达量增加。同时还发现,MetEnk的δ1阿片受体(δ1 opioid receptor,Oprd1)在供试动物腹股沟的WAT中表达量较高。这些数据表明,ILC2可以通过分泌MetEnk,直接促进WAT转化为米色脂肪,而在这个过程中,WAT中的Oprd1受体作为感应媒介,能够诱导并促进米色脂肪细胞生成相关基因的表达。但是在MetEnk结合Oprd1受体直接促进WAT米色化的过程中,IL-4和IL-13的表达量均无显著变化,因此,这种表型很可能与IL-4和IL-13无关,但具体的作用机制还不明确。除此之外,该途径中哪些细胞是MetEnk的靶细胞,仍需进一步探究。
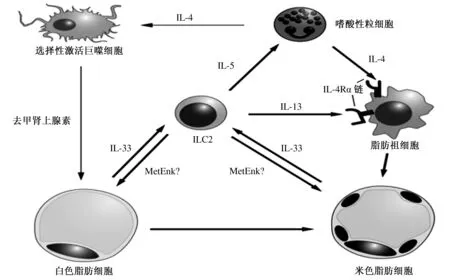
参考文献[29]
虽然已经探索得知部分关于ILC2对小鼠WAT米色化的作用机制,但相关的机制是否也存在于人类中还不太清楚。Brestoff等[2]的研究结果表明,在瘦人的脂肪组织中ILC2构成了谱系标记阴性细胞的大部分。而Zeyda等[24]研究发现,在肥胖人的脂肪组织中IL-33的表达量增加,而在肥胖人的脂肪组织以及高脂肪饮食的小鼠脂肪组织中ILC2含量却大大减少。对于这些相互矛盾的研究结果,推测可能是由于在肥胖的情况下,ILC2对IL-33的响应是失调的,但具体的作用机制还有待于进一步探究。Wood等[32]研究指出,人类WAT的细胞可以产生IL-33,也可以通过促炎刺激(如TNFα)来增加IL-33。然而,是否脂肪细胞本身是IL-33的主要来源,以及ILC2如何影响这种内源性反馈机制还有待证实。最后,发现如何利用这些途径来增加体内IL-33的水平将是非常令人兴奋的研究,并为肥胖症的新疗法铺平道路。
3.2 IL-33/ST2与棕色或米色脂肪产热
IL-33及冷刺激能够促进ILC2的招募和激活,在棕色或米色脂肪产热中也扮演着重要的角色。IL-33的表达量在高脂饮食和瘦素缺乏性肥胖条件下会显著降低,这是由于WAT中ILC2以及嗜酸性粒细胞的含量降低所致。相应的使用IL-33处理高脂肪饮食小鼠,ILC2和嗜酸性粒细胞的数量以及UCP1的表达量会显著增加。冷刺激也能够诱导WAT中IL-33和UCP1的表达,从而增加ILC2和嗜酸性粒细胞的数量。但如果中和了IL-33信号,便可逆转冷刺激的促进作用,例如通过局部注射6-羟基多巴胺(6-OHDA)切断交感神经可显著抑制冷刺激诱导的IL-33和ILC2/嗜酸性粒细胞途径。尽管Brestoff等[2]和Lee等[3]的研究在很大程度上具有相同的观点,但与Lee等不同的是,Brestoff等利用IL-33对IL-4Rα-/-动物进行处理后,UCP1+脂肪细胞的数量增加,从而表明IL-33可以直接作用于WAT的米色化过程,而与IL-4信号无关。除此之外,激活ILC2所产生的MetEnk可以直接与WAT中的Oprd1受体结合,也能促进米色脂肪细胞生成及产热。
Odegaard等[33]也从另一个角度证实了IL-33/ST2信号通路可作为小鼠围产期脂肪产热的“许可证”,研究表明,IL-33是一种能激活Ⅱ型免疫反应的细胞因子,在棕色和米色脂肪细胞的解偶联呼吸中具有“开关”作用。如图3所示,在IL-33或ST2缺失的情况下,棕色脂肪细胞能够正常发育,但不能表达出正常的UCP1 mRNA剪接转录本,导致UCP1蛋白缺失、解耦联呼吸和温度调节功能受损。
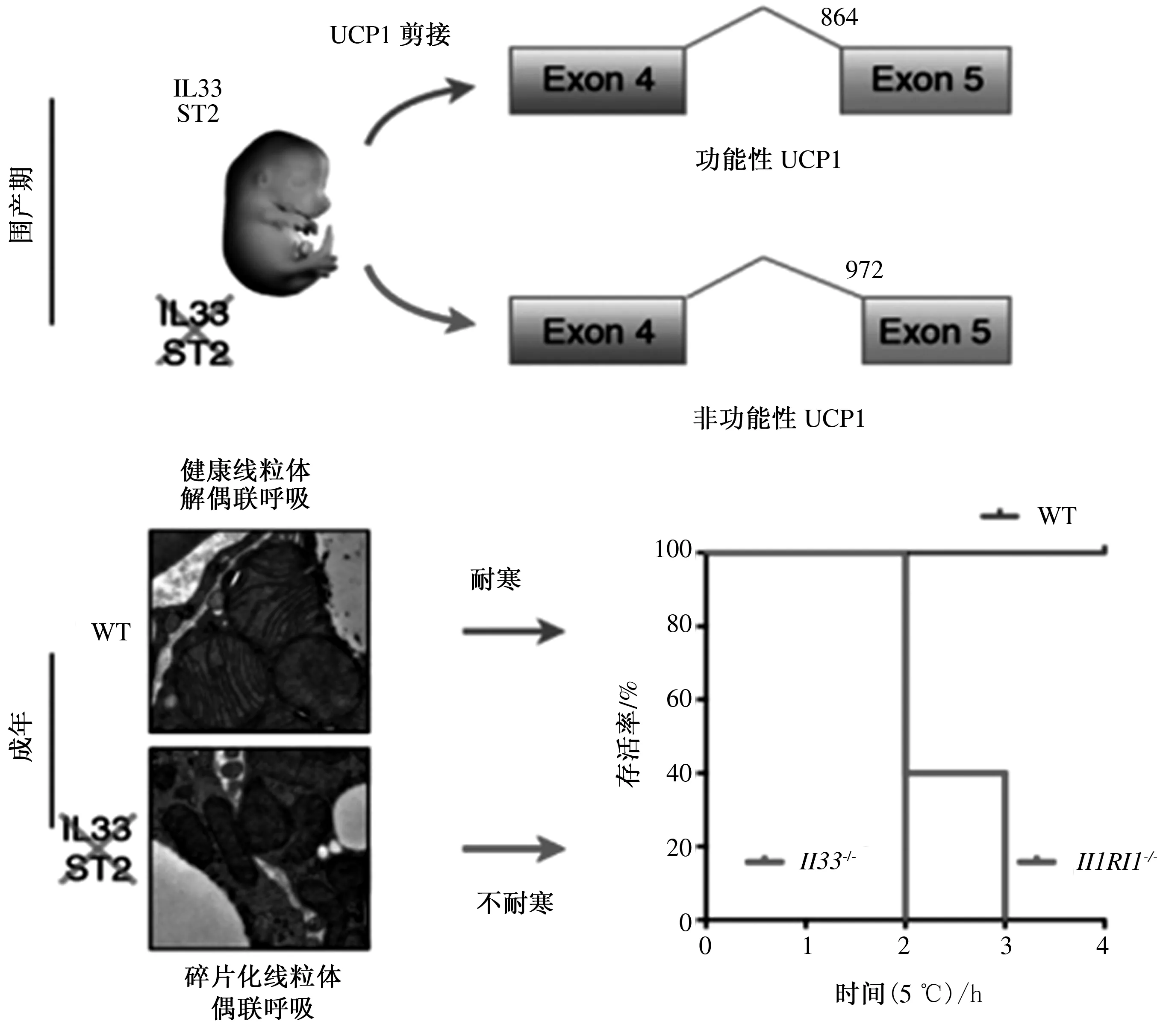
参考文献[33]
4 小结
目前对脂肪沉积分子机制的理解,尤其是对前体脂肪细胞到成熟脂肪细胞分化过程中调控机制的理解仍然是有限的。鉴于IL-33/ST2L/sST2蛋白在不同生物系统的不同细胞中具有不同的功能,涉及范围广泛,IL-33/ST2信号通路在脂肪代谢中的研究是目前一个新兴的研究热点,关于IL-33/ST2信号通路在前体脂肪细胞分化过程中的功能及调控机制也尚不清楚。因此,该通路在脂肪分化中还有一系列的科学问题有待进一步研究:(1)在IL-33和ST2不同剪接变异体中,哪些变异体具有调控前体脂肪细胞分化的功能;(2)IL-33/ST2信号通路引发哪些下游基因的表达来调控前体脂肪细胞分化;(3)IL-33/ST2信号通路调控前体脂肪细胞分化的作用机制是什么。对于IL-33/ST2信号通路在脂肪细胞分化过程中的功能及作用机制的研究,将对深入了解脂肪沉积的调控机制产生重要的指导意义。
