地中海贫血无创产前诊断策略新进展
2018-12-28王梓茗尹爱华
王梓茗 尹爱华
(广州医科大学附属广东省妇儿医院 医学遗传中心, 广东 广州 511442)
地中海贫血是中国南方地区最常见的单基因遗传病,是珠蛋白基因缺陷所致珠蛋白合成障碍引起的溶血性疾病,根据异常累计的珠蛋白基因分为α和β地中海贫血。α地中海贫血,患病率达到7.88%,其中患病率最高的是广西(14%),其次为广东;β地中海贫血患病率为2.21%[1]。重型α地中海贫血具有胎儿致死性,可在宫内发生胎儿水肿或死亡,发生于夫妇均为α0地中海贫血基因携带者的家庭,再次怀孕仍有1/4的概率怀有重型患儿,为家庭带来沉重心理负担。中重型的β地中海贫血患儿可在出生后3~6月出现逐渐加重的溶血性贫血症状,缺乏特异性治疗手段,患儿依赖长期输血和除铁治疗存活,预期生存时间显著缩短,为患儿家庭带来沉重的经济负担和社会负担。目前主要依赖绒毛活检、羊水穿刺及脐血穿刺等有创方法获得胎儿基因信息,检测时间窗较窄、具有胎儿损伤风险、实验室诊断周期较长、工作量大,因此需要早期、快速、精准、无创、安全的分析方法。尽管有报道显示超声方法可以发现重型地中海贫血[2, 3],但该指标缺乏特异性,不能有效预测地中海贫血的发生。分子诊断方法仍是预测地中海贫血的首选方法。随着无创产前筛查(non-invasive prenatal testing, NIPT)染色体异常的技术得以应用和成熟,孕妇血浆中胎儿DNA成分成为检测胎儿基因组的重要工具,相较于有创方法取样更简便,更容易被接受,针对单基因病的无创产前诊断(non-invasive prenatal diagnosis, NIPD)是必然趋势。精确定量技术,包括高通量测序平台和数字PCR,及其数字化定量策略,使得NIPD更加精确、更具有针对性,使得无创产前诊断更具有实用意义。这对于预防和控制地中海贫血具有重要意义。本文将主要综述地中海贫血无创产前诊断新技术的应用。
1 胎儿游离DNA
1997年,Lo[4]在怀有男性胎儿的孕妇血浆中检出Y染色体序列,证实了胎儿游离DNA(cell-free fetal DNA, cffDNA)的存在,为无创产前诊断技术的出现奠定了基础。cffDNA主要由进入母血循环中的胎盘滋养层细胞凋亡后释放[5],因此cffDNA长度具有143bp和166bp峰,这是基于分子大小富集胎儿成分的基础;同时cffDNA主要反映胎盘滋养层的基因状态而非胎儿本身。cffDNA中包含胎儿完整基因组信息是进行胎儿单基因病及染色体异常检测的分子基础;胎儿特异性基因片段是实施单基因遗传病无创产前诊断的技术基础。cffDNA仅为血浆游离DNA(cell-free DNA, cfDNA)的一部分,常使用胎儿浓度(fetal fraction, FF%)表示,其余成分为母亲来源的DNA成分,构成无创产前检测的背景杂音。FF%是制约无创产前检测精度和灵敏度的重要困境,也是导致假阴性结果的重要因素。在孕5周即可检出,胎儿成分仅占3%[6],并随孕周增加而增加;而在孕10周,胎儿成分约为10%,并以每周0.1%速度增加,到孕21周后,以每周1%速度增加,然而仍有部分孕妇血浆中胎儿浓度低于4%,统计显示,孕妇体重过高也与胎儿浓度过低有关[7]。在基于普通PCR或荧光定量PCR的方法中,过低的胎儿浓度将导致胎儿特异性位点无法有效扩增,或胎儿成分引起的目标序列增加过少,低于检测技术的检测阈值,而得出假阴性的结果。因此,需要选择合适的抽血时间窗和胎儿浓度质控方法,同时利用数字化定量平台将低浓度的胎儿成分如实地反映出来,是无创产前诊断技术的要求。
2 高通量测序技术
高通量平行测序(massive parallel sequencing, MPS)是最为常用的无创产前诊断技术平台,该平台可同时分析数百万条DNA分子,借助测序后的生物信息学分析还原出胎儿染色体及基因型、单体型状态,从而实现对胎儿染色体异常的筛查以及单基因病的产前诊断。MPS对cfDNA中大量分子平行测序,使其在测序的基础上可进行数字化定量,其检测的reads数十分庞大,使其具有对染色体数目异常、基因组改变的检测能力,揭示胎儿成分的相应分子reads数的增加或减少。目前,已形成较成熟的技术应用于21-三体、13-三体及18-三体等常见染色体数目变异的疾病的筛查[8]。且现有技术可在低至4%[7]的胎儿浓度仍能保证准确地判断单胎染色体核型。
MPS可以同时检测大量的SNP位点,利用胎儿特异性SNP位点绘制胎儿基因组图谱[5],构建出胎儿单体型,从而分析遗传自父母双方的等位基因。由于致病突变和野生型碱基分别与特定单体型紧密连锁,胎儿特异的单体型可以反映胎儿遗传自父母双方的等位基因。其中包括连锁分析方法和相对单体型剂量(relative haplotype dosage, RHDO)[5, 9]。由于cffDNA中胎儿成分非常少,致病突变常难以有效检出,结合单体型构建和连锁分析可以明确是否遗传自父亲的突变或野生型基因,检测灵敏度高;连锁分析方法也是父母双方携带相同突变类型时的无创产前诊断方法。RHDO原理是胎儿与母亲共有一半的单体型,尽管无法与母源背景中的单体型区分,母胎共有的单体型在cfDNA中相对过多,进而判断胎儿遗传自母亲的单体型及其关联的野生型或突变型基因[10];Wang W[11]则将该方法改良为借助隐马尔科夫算法估计胎儿遗传自父母的相应基因。相对突变剂量(relative mutation dosage, RMD)分析策略与RHDO方法类似,是利用突变型与野生型序列在孕妇血浆中相对含量,判断胎儿的基因型,也可以应用到SNP及单体型的分析中,不仅分析在母亲纯合而胎儿杂合的SNP位点,同样可适用于母亲杂合的SNP位点,借助SNP两种碱基含量是否平衡判断胎儿在该SNP位点状态。RHDO策略及RMD策略的出现改变了传统借助差异性分子标记或父源突变位点进行排除性诊断的局限性。
目标序列捕获测序是通过特异性捕获探针或捕获芯片对短片段的DNA,从而仅针对特定的基因序列的进行测序分析,测序成本较全基因组测序低,对目的基因覆盖度及测序深度更高,充分利用检测区域的SNP及单体型信息。扩增子测序不依赖定制芯片,针对已知突变的目标区域扩增,靶向更强,成本更低,时间更短,但在多重扩增反应中难以保证均一性。针对目标区域订制探针成本,不仅订制周期长,且面临捕获的均一性、捕获条件的优化、捕获cfDNA的效率和特异性等问题,需漫长摸索。而扩增子测序常扩增较短片段的扩增子,若需要覆盖距离较远的多个突变则需要多个扩增子覆盖,而地中海贫血遗传异质性大,突变分布范围广,需要根据不同的检测位点设计相应的引物,尤其是多重扩增体系优化较为繁琐。Xiong L[12]仅用一对引物扩增的扩增子,构建可覆盖4种位置相邻的β地中海贫血突变的panel,并结合RMD策略分析胎儿是否遗传母亲的突变;然而在其另一篇研究中则需要使用3对引物扩增3个重叠的扩增子,从而构建覆盖4种突变类型的panel,但该策略仅进行父源排除性诊断,难以进行上述RHDO、RMD检测策略。
3 数字PCR
3.1 数字PCR技术原理 数字PCR是一种高通量、自动化、精确定量技术,结合微流控技术和双荧光通道检测,可以对目标分子数进行绝对定量。目前包括Bio-Rad Laboratories公司的 QX100和QX200平台为代表的微滴数字PCR和Life Technologies 公司的QuantStudio? 3D数字PC系统微流控芯片数字PCR。数字PCR是一种单分子计数技术,其原理是将荧光定量反应体系分散到上万个小体积的分隔室中,每个分隔室中包含完整的PCR反应液及单拷贝DNA模板,在PCR的过程中每个分隔室独立进行反应,只有含目标分子的分隔室经扩增产生荧光。在完成PCR完成后对荧光信号进行分析,通过双荧光通道(FAM/HEX或FAM/VIC)对所有分隔室分析,可同时对两种目标分子进行定量。
数字PCR大致可分为分散体系生成、PCR反应及荧光信号分析步骤,其使用的反应体系与荧光定量PCR相似,具有简便、可操作性强的优点。而由于同时对上万个平行的扩增反应单元进行分析,尤其微滴式数字PCR可在单孔中同时进行20 000个平行反应;微滴式数字PCR在一块96孔板中同时进行96重反应,芯片式数字PCR仅能进行若干个阵列的反应,因此微滴式数字PCR具有通量优势;而相较于高通量平行测序而言,则具有周期短、成本低的特点。数字PCR常采用Taqman水解探针法,特异性高,针对性强,可直接检测微量突变并精确定量其拷贝数,结果分析可在分析仪自带的软件完成计算,生物学分析更为简便、快速,准确性高;而高通量平行测序依赖于后续的生物学分析,分析周期较长、过程复杂,对突变位点的检测受单碱基的检测深度及测序质量的影响。尽管如此,数字PCR和其他PCR检测方法一样,只能针对已知的突变进行检测。
数字PCR只能同时分析两种荧光信号,选择较实时定量PCR局限,不能在单管中同时对多个位点进行分型;而在定量方面相较实时定量PCR准确度更高、检测阈值更低,可检测单个拷贝或单个目标分子,且在复杂的背景中或存在高浓度、高度同源序列的背景中检测出稀有的、单个碱基突变具有显著的优势。这主要是由于数字PCR将单分子的模板分散到每个小的反应体系中,从而每个反应体系只扩增单一模板,减少了模板分子之间的竞争或抑制作用,减少了等位基因脱扣或母源非特异性扩增的发生。
3.2 地中海贫血 人类珠蛋白基因簇比较长,遗传异质性大,致病类型包括缺失型和非缺失型,其引物和探针设计策略不同,例如大片段的缺失常使用跨越断裂点扩增(Gap-PCR)方法。且突变可发生于基因簇上相距较远的多个热点位点,往往需要设计多对引物和探针才能覆盖。然而,某些突变在人群中的频率相较于其他突变高,其后代容易形成纯合子或复合杂合子而导致中至重型地贫。因此,针对常见突变设计特异性引物及探针,可实现对大多数重型地中海贫血的无创产前诊断。此处将针对β及α地中海贫血分别进行阐述。
3.2.1 β地中海贫血 β地中海贫血常由突变引起,常由于框移突变、无义突变、剪接位点突变等原因无法生成正常的β珠蛋白,进一步导致了α、β肽链比例失衡,造成溶血的发生。父母均为致病突变携带者时,胎儿有1/4概率同时遗传来自父母亲的致病突变,导致中重型地中海贫血,因此需要行产前诊断明确胎儿基因型(图1a)。这样可以免除1/2非必要的有创操作,减少胎儿在介入性检查的风险。大多数情况,父母携带两种不同的致病突变,则可通过排除法策略进行无创产前诊断。当父亲携带的致病突变在孕妇血浆游离DNA中检出,则表明胎儿遗传了来自父亲的致病突变,此时胎儿有1/2的概率同时遗传了来自母亲的突变基因形成重型地中海贫血,需要进行进一步的介入产前诊断。而该方法可通过荧光实时定量PCR检测,或结合肽核酸夹[13]、COLD-PCR[14]等技术富集突变基因,可降低检测的阈值,应用于早期妊娠的样本检测。但是肽核酸夹设计比探针复杂,COLD-PCR的反应条件优化困难,且富集效果有限,较低的变性温度也可能引入非特异性扩增。数字PCR灵敏度高、定量精确、检测阈值较低,可直接检测单分子水平的模板而无需额外富集。
然而,由于cfDNA缺乏分子水平的特异标记,胎儿遗传自母亲的等位基因常被孕妇血浆中DNA背景所覆盖,即母体来源游离DNA背景中本身已包含了野生型、突变型两种序列,而胎儿来源的野生型或突变型序列都无法和母体来源的DNA相区别,使得1/4并未遗传母亲的突变基因的胎儿仍需接受介入性产前诊断。Lun[15]提出了一种相对突变剂量( relative mutation dosage, RMD)方法,可根据野生型和突变型基因是否存在不平衡而对于父母双方携带不同突变的案例,母亲携带的突变位点上的基因型为杂合N/M,而父亲在该位点上的基因型为纯合野生型N/N,其后代只可能形成两种状态,即N/N或N/M。理论上,对于母亲携带的致病突变类型,母体细胞释放至血浆的序列野生型和突变型序列相等,但是混入一定比例的胎儿来源的DNA后,若胎儿基因型为N/N,即只释放野生型的序列,可导致cfDNA中野生型序列比例多于突变型;若胎儿基因型为N/M,该平衡不会打破(图1b)。该方法结合父源致病基因排除诊断,可确定胎儿的基因型,理论上只有同时遗传父母突变的病例需要进一步行介入性产前诊断。
由于胎儿成分浓度在孕妇血浆中含量极低,胎儿成分并不导致突变型序列剂量成倍增加或减少,变化幅度低于qPCR检测阈值,因此需要在更精准的数字化定量平台上检测,利用样品中两种分子绝对数量上的差异判断是否存在不平衡。Lun[15]通过性染色体特异序列构建的ZFX/ZFY算法结合胎儿浓度的检测,结合SPRT算法,将样品得出等位基因含量与特定胎儿浓度下预期等位基因相对含量对比进行分型,10例中仅5例准确分型,未能准确分型的样品胎儿浓度<10%。而Camunas-Soler[16]用同种方法对包括β地中海贫血在内的多种常染色体隐性及X连锁隐性遗传病进行检测,在预扩增的基础上进行47个SNP位点分析估算胎儿浓度,在低至3.7%的胎儿浓度下可准确判别胎儿是否遗传了母亲的致病突变。因此,该策略可应用于多种点突变相关的单基因遗传病,具有普适性。然而,减少检测过程中母源背景信号对于结果的判别仍然是该策略推广的重要难题。
3.2.2 α地中海贫血 --SEA缺失型是我国南方最常见的α0-缺失型基因,携带率高达2.54%[1]。父母双方为--SEA携带者,或者其中一方或双方为HbH病患者。因此,研究中多以排--SEA纯合所致Bart水肿胎为主要目的。但由于父母携带相同的致病基因,在孕妇血浆中多无法区分出胎儿来源的序列,排除法策略排除父亲来源的致病基因需要依赖个体特异的遗传标记,如单碱基多态性(single nucleotide polymorphism, SNP)[17]、短重复序列(short tandem repeat, STR)[18]。然而,某些多态性位点在人群中频率过低,缺乏临床意义;而在有限的目标区域内,多态性位点有限,且常因父母双方均携带相同的SNP位点而无法获得足够数量具有差异的多态性位点,这些都局限了遗传标记连锁策略的应用。数字PCR平台单孔检测通量有限,同时检测大量不仅工作量大,步骤繁琐,并不具有实用性。相对突变含量检测法是更为可行的选择。
与点突变的相对定量方法不同的是,包含野生型及突变型Gap-PCR引物设计方法跨越--SEA缺失序列两端设计引物,特异性扩增包含断裂点的序列;并在缺失片段内设计引物,从而扩增相应野生型的片段(图2a、b)。Pornprasert[19]利用野生型及缺失型序列的拷贝数比例准确地区分了正常样本、携带者样本及--SEA纯合样本。由于父母携带相同缺失类型(图1c),此时有3种情况,即胎儿为携带者时,cfDNA中野生型和突变型序列含量接近;胎儿为正常基因型或--SEA纯合时分别导致野生型和缺失型序列过多。这样增大了结果分析的困难性,易将Bart水肿胎误诊为携带者而造成漏诊,因此需要足够精确的定量方法和生物信息分析方法以排除假阴性结果。Sirichotiyakul[20]用qPCR方法可以检测出怀有Hb Bart水肿胎的孕妇血浆中ΔCT(CT缺失-CT野生)较正常胎儿及杂合型胎儿更高,是可行的检测策略,可以通过数字PCR将这种CT上的差异转化为分子绝对数量上的差异,提高检出率。
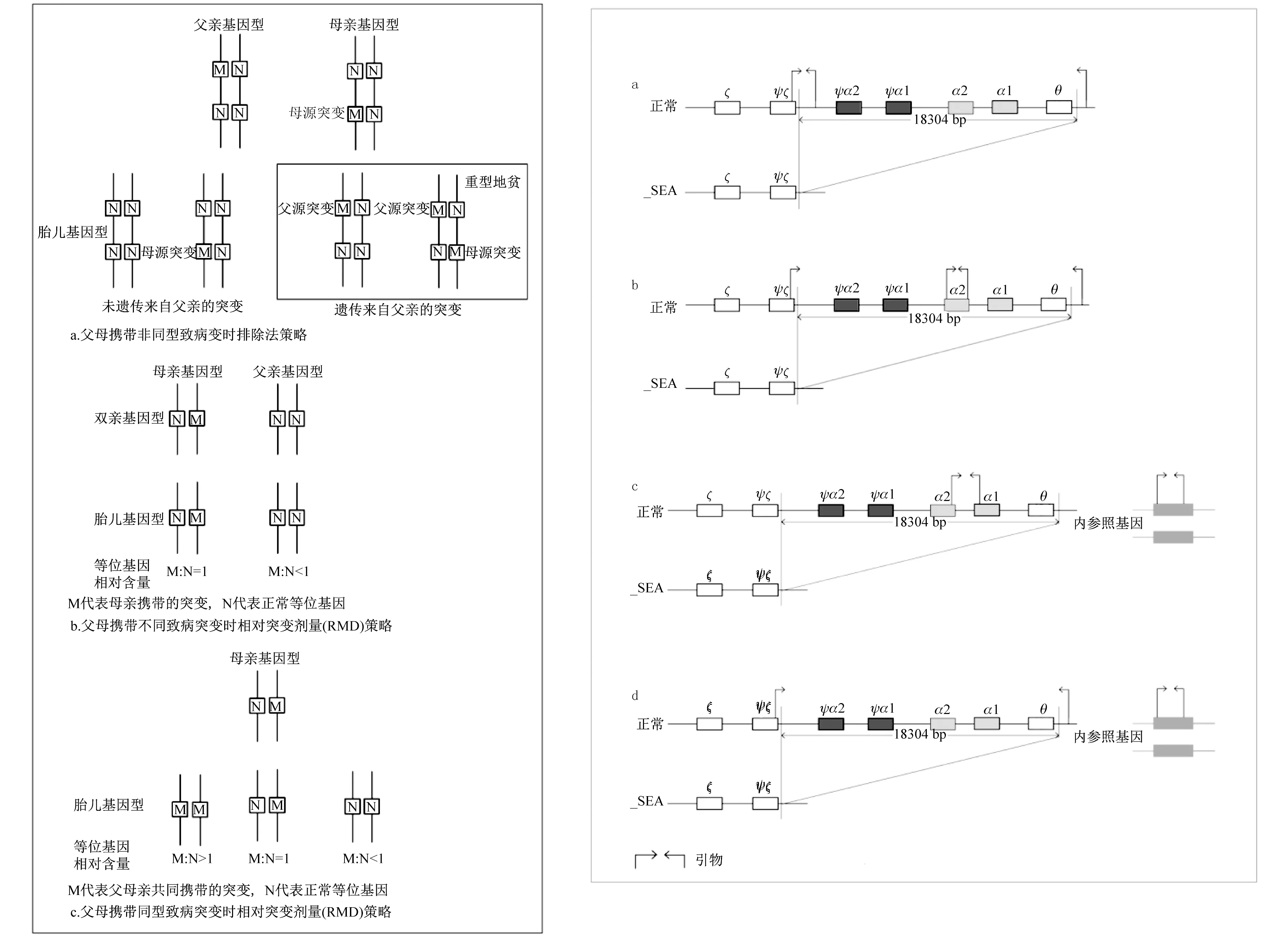
图1 数字PCR无创产前诊断策略 图2 α地中海贫血扩增策略
拷贝数检测方法可用于基因拷贝数改变引起的疾病,而缺失型α地中海贫血引起的α珠蛋白拷贝数减少或缺用该方法检测。参照序列常选用正常基因组中双拷贝的基因序列。目标序列选取可分为两种:①断裂区域内无同源性的区域(图2c),Long[21]选取缺失区内非同源区域与参照基因的产物峰面积进行对比,即采用了该策略。对于α0-携带者而言,基因组仅有一半的α野生型序列,因此目标序列应为参照基因的一半,而当胎儿的缺失型基因参入后,野生型序列被进一步稀释而比例降低,借助数字化定量的方法,直接反映初始模板中目标分子拷贝数,将这种改变呈现为目标序列拷贝数减低。②gap-PCR扩增的缺失型片段(图2d)根据其在血浆中的拷贝数来判断胎儿是否为--SEA纯合的方法,理论上Bart水肿胎儿产生的cfDNA含有缺失型片段是携带者胎儿的两倍,可以借此将两者区分,而怀有正常胎儿的孕妇只含有母源背景中的缺失型片段,含量最少。Pornprasert[22]利用半巢式qPCR绝对定量法对正常、携带者及Bart水肿胎儿3种胎儿进行区分,但差异不具有显著性。该方法局限性在于缺乏对照基因,容易受加样时初始模板量的影响,不能真实反映其在胎儿基因组及cfDNA中的真实含量;二是qPCR的检测精度有限,微量cfDNA的并不导致模板量成倍改变,qPCR难以有效检测。而数字PCR在极低的浓度下直接检测样本中目标序列的拷贝数,而无需进行巢式、半巢式扩增,减少预扩增引起模板数量偏差,也避免两次扩增中引入污染可能,能更真实反映cfDNA中模板含量。借助目标基因/参照基因算法,根据不同基因型胎儿对应的比值划分成三组,若满足组间具有显著性差异,则可以划定区分Bart水肿胎的临界值,作为临床孕妇血浆样品中胎儿基因分型的依据。
3.3 数字PCR平台应用的局限性 不同平台之间性能存在较大差异,以及不同技术原理、所需操作技术要求不同。例如,微滴数字PCR和芯片式数字PCR在通量、分散程度存在差别,微滴数字PCR分散体系生成更为简便,对技术人员操作要求较低。此外不同的检测仪器的准确度、精确度存在差别,对不同的预扩增液、微滴发生油,兼容性存在差别。尤其是,微滴式数字PCR平台之间由于微滴发生油的种类、微滴发生技术的差异,微滴数量为20 000~2 000 000不等,这样可导致检测精度存在差异,理论上,微滴数量越多,定量越精确。由于采用的技术不同,实验室间难以形成统一的标准。
此外,无创产前诊断需要明确cffDNA成分的比例,排除胎儿成分过低的样品,避免假阴性结果而漏诊。数字PCR在胎儿成分检测方面具有稳定、重复性高、精准、快速等优点,且定量的胎儿浓度较qPCR方法更高。但由于数字PCR检测荧光通道有限,难以同时检测多个分子标记,仍然是局限数字PCR无创产前检测的因素。常用分子标记包括男性胎儿的Y染色体序列及差异SNP位点。Y染色体序列具有性别特异性及胎儿特异性,Y染色体序列定量方法具有极高的敏感性,缺点是对于女性胎儿无法使用。差异SNP法仅局限于母亲纯合而胎儿杂合的SNP位点,通过胎儿区别于母亲的碱基识别胎儿DNA,与母胎共有碱基含量比较可计算胎儿成分所占比例,但由于差异SNP不具有普适性,需要在人群中选取足够区别意义的位点作为备选SNP,且需要在分析前同时获得父母双方大量SNP分型信息,筛选具有鉴别意义的位点,步骤烦琐、工作量大,在有限的反应中获取足够的胎儿差异分子标记信息是十分困难的。
4 展望
地中海贫血是一种热带地区常见的单基因遗传病,携带率及发病率高,已出生的重型地中海贫血患儿需要长期接受输血和祛铁治疗,给家庭和社会带来沉重的经济负担。Bart水肿胎作为α地中海贫血的最严重类型,具有胎儿致死性,发生率高。因此,迫切需要一种快速、准确、早期的无创产前手段,能辅助现有介入性产前诊断技术,更早发现并确诊胎儿基因型,以更早进行临床干预。MPS凭借信息量大、通量高及其强大的生物信息学分析支持,目前仍是主流的无创检测技术。其发展可分为两个方向:一是利用更大深度的全基因组测序或构建相应的Panel,以及新的算法,在单次检测中发掘更多的信息,能同时完成诸如染色体数目异常筛查(NIPT)、单基因病的无创产前诊断(NIPD)等多种检测。另一种是提高检测针对性以及目标区域胎儿成分的富集,如靶向捕获测序或扩增子测序,提高富集效率和特异性,可发掘含量极低的胎儿成分信息,降低检测阈值。然而在该策略上,数字PCR不仅成本较低、特异性高、检测周期短、简便、绝对定量,不易受建库、测序深度、均一性影响,受检测前处理技术影响因素小,检测后分析更加简便,更具有优势。随着RMD策略在MPS和数字PCR平台上证明其实用性,数字化定量平台无创产前诊断的基本策略逐步确立,如何减低技术因素及母源背景所致干扰,提高检测技术灵敏度仍是重要课题。同时,数字化定量的无创产前诊断技术与超声筛查技术,以及血红蛋白筛查、孕前咨询、分子诊断相结合,实现早期发现重型地中海贫血患儿,降低重型地中海贫血发生率,减少非必要的有创产前检查的使用,仍是地中海贫血无创产前诊断推向临床必经之路。
