钠及其化合物知识归纳及典例解析
2018-12-28安徽省砀山四中尉言勋
■安徽省砀山四中 尉言勋
元素及其化合物知识是高考化学命题的重要载体。灵活掌握元素化合物知识,有利于高考取得理想的成绩。钠是一种重要的金属元素,钠及其化合物知识点多,涉及面广,需要记忆的东西较多,同学们难以系统掌握。在学习中,以思维为导向,明确知识脉络,顺藤摸瓜,就能够系统地掌握知识,在高考中灵活运用。
一、知识脉络

二、重难点剖析
1.钠的性质、保存方式、用途。
(1)物理性质。
银白色金属,质软(小刀可以切割),钠的密度大于煤油小于水,熔点较低(用酒精灯加热,很快熔化),具有良好的导电性和导热性。
(2)化学性质。
①与非金属单质的反应。
a.与氧气反应:4Na+O2==2Na2O(变暗)(淡黄色固体)。
②与水的反应(水中先滴入酚酞):2Na+2H2O==2NaOH+H2↑。现象如表1。

表1
③与盐溶液的反应:6Na+6H2O+
④与某些有机物反应:2CH3CH2OH+
(3)钠的保存。
实验室中通常把少量钠保存在煤油中,原因是:①钠极易与空气中的O2、水蒸气反应;②钠不与煤油反应;③钠的密度比煤油大,沉于底部。
【注意】①钠保存在煤油中,而不能保存在汽油、CCl4中,因汽油易挥发,CCl4的密度比钠的密度大,起不到隔离O2和H2O的作用。
②钠露置于空气中的变化过程:Na(银白色)→Na2O(变暗)→NaOH(白色固体)→NaOH(溶液)→Na2CO3·10H2O(白色块状)→Na2CO3(白色粉末)
(4)钠的用途。
①钠用于钛、锆、铌、钽等金属氯化物中置换出金属单质。
②钠钾合金,作原子反应堆的导热剂。
③在电光源上,用钠制高压钠灯。
2.氧化钠和过氧化钠(性质见表2)。

表2
【知识拓展】①Na2O2具有强氧化性,能氧 化 SO2、FeCl2、H2S、Na2SO3等。 ②Na2O2不是碱性氧化物,有强氧化性、漂白性,遇到湿润的石蕊试纸时,先使试纸变蓝,后使其褪色。遇到品红溶液因强氧化性而使其褪色。
3.氢氧化钠(俗称:烧碱、火碱、苛性钠)。
(1)物理性质:白色固体,易吸收空气中的水蒸气而潮解,易溶解于水,并且放出大量的热量,有强腐蚀性。
(2)化学性质:为一元强碱,具有碱的通性。例如:二氧化碳和氢氧化钠反应。
①CO2+2NaOH==Na2CO3+H2O②CO2+NaOH==NaHCO3
区间反应见表3。

表3
可以看出二氧化碳与氢氧化钠恰好完全反应比例不仅仅是一个比值,而是一个区间,这个区间是:1∶2≤a≤1∶1。
用数轴表示如下:
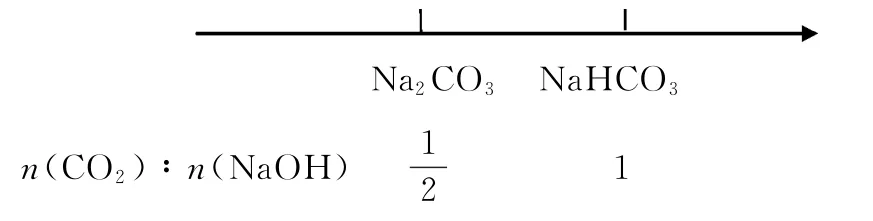
【特别提醒】SO2、H2S等通入NaOH或KOH溶液原理与该反应相同。
4.碳酸钠和碳酸氢钠(性质见表4)。

表4

续表
【拓展】①碳酸钠与盐酸的反应。
现象:开始无气体生成,滴加到一定量后出现气体。
现象:立即出现气泡。(常用来相互鉴别)
②将NaHCO3溶液与NaAlO2溶液混合得到Al(OH)3沉淀,发生反应NaHCO3+NaAlO2+H2O==Al(OH)3↓+Na2CO3,此反应并非水解反应。
③二氧化碳气体通入NaClO溶液中,无论二氧化碳少量还是过量,都发生反应CO2+NaClO+H2O==HClO+NaHCO3,而不会生成碳酸钠,因酸性:H2CO3>HClO>HCO-3。
④侯氏制碱法的原理:NaCl+CO2+H2O+NH3==NaHCO3↓+NH4Cl,
三、典型例题解析
1.考查钠的性质。
例1向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入绿豆大小的金属钠,可能观察到的现象是( )。

解析:钠的密度大于煤油而小于水,所以钠位于煤油和水的界面上,并且2Na+2H2O==2NaOH+H2↑,有气泡冒出,故A项正确。
答案:A
2.考查钠的氧化物。
例2取ag某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了ag。下列物质中不能满足上述结果的是( )。
A.H2B.CO
C.CH3OH D.C2H5OH
解析:2Na2O2+2CO2==2Na2CO3+O2,2Na2O2+2H2O==4NaOH+O2↑,对生成物变式,Na2CO3~Na2O2·CO,2NaOH~Na2O2·H2,已知反应的关系式:H2~H2O~2NaOH~Na2O2·H2,CO~CO2~Na2CO3~Na2O2·CO,有机物在足量氧气中燃烧生成CO2和H2O,应可拆写成(CO)m·Hn的形式,则H2、CO以及可拆写成(CO)m·Hn的形式的有机物能满足上述结果,甲醇可拆写成CO·H4,乙醇不能满足。
答案:D
3.考查氢氧化钠。
例3用1L1.0mol·L-1NaOH溶液吸收0.8 molCO2,所得溶液中CO2-3和HCO-3的物质的量之比约为( )。
A.1∶3 B.2∶1
C.2∶3 D.3∶2
解析:n(CO2)∶n(NaOH)=0.8∶1=4∶5,处在1∶2到1∶1之间,属于恰好完全反应的区间,生成的产物既有Na2CO3,也有NaHCO3,我们就可以依据钠守恒和碳守恒建立两个方程:
2n(Na2CO3)+n(NaHCO3)=1L×1.0mol·L-1(钠守恒)
n(Na2CO3)+n(NaHCO3)=0.8 mol(碳守恒)
解之得n(Na2CO3)=0.2 mol,n(NaHCO3)=0.6mol。
答案:A
4.考查碳酸盐、碳酸氢盐的鉴别。
例4不能用来鉴别K2CO3和KHCO3两种白色固体的实验操作是( )。
A.分别在这两种物质的溶液中,加入BaCl2溶液
B.分别在这两种物质的溶液中,加入少量澄清的石灰水
C.分别在这两种固体中,加入同浓度的稀盐酸
D.分别加热这两种固体物质,并将生成的气体通人澄清的石灰水中
解析:BaCl2溶液与K2CO3反应生成碳酸钡沉淀,而BaCl2溶液与KHCO3不反应,A项错误;氢氧化钙与K2CO3和KHCO3都能反应生成碳酸钡沉淀,不能够用澄清的石灰水来进行鉴别,B项正确;KHCO3与盐酸反应速率快,同浓度的稀盐酸能用氢氧化钙来鉴别K2CO3和KHCO3,C项错误;KHCO3加热生成二氧化碳,分别加热这两种固体物质,能鉴别K2CO3和KHCO3,D项错误。
答案:B
5.结合实验装置的考查。
例5根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离 NaHCO3、干燥 NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )。

解析:制取NH3需要NH4Cl与Ca(OH)2反应,若只加热NH4Cl生成NH3和HCl,在试管口遇冷又生成固体NH4Cl,可能堵塞导管,A项错误;制取NaHCO3时,向NH3和食盐的饱和溶液中通入CO2的导气管应长进短出,B项错误;NaHCO3在水中的溶解度小,CO2通入氨化的饱和食盐水生成NaHCO3晶体析出(NH3+NaCl+CO2+H2O==NaHCO3↓+NH4Cl),可用过滤法分离,C项正确;加热NaHCO3会分解,无法得到干燥的NaHCO3,并且加热时装置中烧杯应垫上石棉网,D项错误。
答案:C
6.考查物质的推断和性质。
例6某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解。
②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为( )。
A.NaHCO3、Al(OH)3
B.AgCl、NaHCO3
C.Na2SO3、BaCO3
D.Na2CO3、CuSO4
解析:NaHCO3溶于水,而Al(OH)3难溶于水,NaHCO3能与足量稀盐酸反应放出CO2气体,Al(OH)3能溶于足量稀硫酸,符合实验①但不符合实验②,A项错误;AgCl难溶于水,也难溶于稀盐酸,因此不符合实验①,B项错误;亚硫酸钠和碳酸钡加入水,碳酸钡不溶于水,使部分固体不溶解,加入稀盐酸,碳酸钡与盐酸反应生成氯化钡、二氧化碳和水,固体全部溶解,再将样品加入足量稀硫酸,稀硫酸和碳酸钡反应生成硫酸钡沉淀、二氧化碳和水,C项正确;Na2CO3、CuSO4均可溶于水,且能反应生成难溶于水的碳酸铜、氢氧化铜或碱式碳酸铜,碳酸铜、氢氧化铜或碱式碳酸铜均能溶于足量稀盐酸,且放出CO2气体,加入足量稀硫酸,振荡后无固体存在,符合实验①而不符合实验②,D项错误。
答案:C
7.侯氏制碱法的判断考查。
例7图1是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )。

图1
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C.b通入NH3,然后a通入CO2,c中放碱石灰
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
解析:氨气极易溶于水需要防止倒吸,因此a通入NH3,b通入CO2。由于CO2在水中的溶解度较小,而NH3的溶解度较大,所以要在食盐水中先通入NH3,然后通入CO2,否则CO2通入后会从水中逸出,等再通入NH3时溶液中CO2的量较少,不利于充分反应。尾气主要是CO2和NH3,其中NH3对环境影响较大,要进行尾气处理,而NH3是碱性气体,所以在c装置中要装入酸性物质,吸收多余的氨气,答案选B。
答案:B
8.综合考查。
例8某研究性学习小组在网上收集到信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
【实验】将燃烧的钠迅速伸入盛满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上黏附着白色物质。
【提出假设】
假设1:白色物质是Na2O
假设2:白色物质是Na2CO3
假设3:白色物质是Na2O和Na2CO3的混合物
【设计实验方案·验证假设】该小组对燃烧后的白色产物进行如下探究(见表5)。

表5
【思考与交流】
(1)甲同学认为方案1得到的结论不正确,其理由是____。
(2)乙同学认为方案2得到的结论正确,白色物质为____。
(3)通过方案1和方案2的实验,你认为上述三个假设中,___成立。你的理由是____。
(4)钠在二氧化碳中燃烧的化学方程式为____。
(5)丙同学认为白色物质有可能是氢氧化钠,你是否同意丙同学的观点?并简述理由:___。
解析:(1)Na2O、Na2CO3溶于水所得溶液均呈碱性,因此不能通过加入无色酚酞试液后溶液变红判断白色物质为Na2O。(2)~(3)方案2的①中产生白色沉淀,说明白色物质中有Na2CO3,②中滴加无色酚酞试液溶液不变红色,说明白色物质中无Na2O,因此白色物质为 Na2CO3。(4)根据 Na转化为Na2CO3可知,Na作还原剂,则CO2作氧化剂转化为C,化学方程式为2Na2CO3+C。(5)丙同学的观点不正确,因为反应物为Na、CO2,不含氢元素,故不可能生成NaOH。
答案:(1)Na2CO3溶液显碱性,也会使酚酞试液变红 (2)Na2CO3(3)假设2 方案2的①中出现了白色沉淀,说明有CO2-3,②中加酚酞无明显现象,说明无Na2O(4)(5)不同意,因为反应体系中无氢元素(或其他合理答案)
总之,高考中钠及其化合物考查难度并不大,通过对钠及其化合物的总结归纳,我们可以全方位认识“钠”,系统地掌握钠及其化合物的知识结构,另外还要注重钠与其他元素之间的综合应用,学会对知识进行迁移,举一反三、提纲挈领,对相关知识适当拓展,这样就可以对元素及其化合物的知识融会贯通,取得理想的效果。
