不同燕麦品种耐盐性差异及其生理机制
2018-12-27苗玉红韩燕来
姜 瑛,周 萌,吴 越,苗玉红,汪 强,韩燕来
(1.河南农业大学资源与环境学院,河南 郑州 450000; 2.河南省农业科学院农业经济与信息研究所,河南 郑州 450008; 3.山东省土壤肥料总站,山东 济南 250100)
目前全世界盐碱土壤面积大约有10亿hm2[1],主要集中在欧亚大陆、非洲和北美西部,约占全球陆地总面积的25%,占可耕地面积的10%。我国盐碱土面积约占世界盐碱地的1/28,面积相当于我国现有耕地的1/4。我国人口众多,人均耕地面积不足0.1 hm2,如何改良和利用好盐渍地区的土地资源是当前面临的重大课题。近年来,种植耐盐植物成为盐碱地利用和改良的重要举措[2,3],随着生物技术的广泛应用,筛选及培育耐盐能力高的作物品种成为盐碱地改良利用的重要方向,因而研究植物耐盐性及其生理机制成为热点问题之一。
燕麦(Avenasativa)是一种特殊的粮、经、饲、药多用作物,在生态条件脆弱地区是不可替代的特色粮饲作物,主要分布在俄罗斯、美国、加拿大、德国、澳大利亚、中国和芬兰等国[4]。我国燕麦品种资源丰富,加之从国外引进的29个物种2 099份种质资源,燕麦资源遗传多样性丰富,是燕麦育种的优良基础材料[5]。燕麦具有一定耐盐性,不同来源的燕麦抗盐性差异显著[6],其在盐碱地上的种植已成为盐碱地改良利用的有效方式之一[7-8]。以往对于燕麦耐盐性的研究多集中在耐盐种质资源选育[9-10]、营养离子吸收调控[11-12]、外源物质耐盐缓解效应机制[13-14]等方面。植物的耐盐性是一个复杂的数量性状,涉及诸多基因和多种耐盐机制的协调作用,而对于燕麦耐盐机理的研究还相对较少。
本研究对比分析了4种不同基因型燕麦在不同盐胁迫浓度和胁迫时间下表观指标、生理指标及Na+、K+吸收积累变化规律,对不同品种燕麦的耐盐性进行综合评价,并探讨燕麦响应盐胁迫的生理机制,以期为燕麦耐盐育种和筛选提供科学依据。
1 材料与方法
1.1 试验材料
供试燕麦品种为加1(Tybor naked oat)、加8(Marion oat 2002)、加9(Nova oat 2003)和白燕6号(Baiyan 6),其中加1、加8、加9为加拿大燕麦品种,白燕6号来自吉林白城农业科学院,以上引进品种由河南农业大学植物营养研究室在当地气候条件下经一年的繁殖后作为供试材料。
1.2 试验方法
本试验在河南农业大学资源与环境学院恒温光照培养室内进行。挑选大小均匀一致、籽粒饱满且无病虫害的燕麦籽粒以10%的次氯酸钠消毒10 min,用蒸馏水冲洗干净,25 ℃黑暗条件下浸种催芽,待种子露白后,挑选露白一致的沙盘育苗。待幼苗长至两叶一心时,进行试验处理。试验采用水培法,在1/2剂量的Hoagland营养液的基础上,设0(无盐胁迫)、50(低盐胁迫)、150(中盐胁迫)和250 mmol·L-1(高盐胁迫)4个NaCl盐浓度水平。培养期为8 d,每2 d更换1次培养液,处理前取第1次样,以后每2 d取1次样,取相同部位叶片进行相关指标测定。育苗和处理时均以1/2的Hoagland营养液(约含Na+浓度3 mmol·L-1)为基础,故在试验开始时各供试燕麦品种有一定的Na+积累量。
1.3 指标测定方法
K+、Na+含量的提取和测定参照王宝山等[15]的方法;脯氨酸(Pro)含量测定采用茚三酮比色法;丙二醛(MDA)含量测定采用硫代巴比妥酸反应法;叶绿素含量测定用95%乙醇黑暗条件提取24 h,并分别在波长665、649、470 nm测定吸光度。
盐害指数:每2 d记录一次盐害症状,盐害分级标准参照冯毓琴等[16]的方法并略有修改。0级:无盐害症状;1级:轻微盐害,植株叶片尖端萎蔫或卷曲;2级:轻度盐害,叶片尖端萎蔫且发黄;3级:中度盐害,植株生长发育受抑制,约1/3的叶片焦枯发黄;4级:重度盐害,植株生长发育严重受抑制,叶色整体变浅绿色,近1/2的叶片焦枯变黄;5级:极重度盐害,植株叶片焦枯,萎蔫死亡。
盐害指数=[∑(盐害级值×相应盐害级值株数)/(总株数×盐害最高级值)] ×100%。
1.4 抗盐性评价方法
采用模糊数学中的隶属函数值法[16-17]对各燕麦品种抗盐性差异进行综合评价。
1.5 数据处理
本试验采用SPSS 18.0进行相关分析统计,用Duncan法以及LSD法进行数据的方差分析(P<0.05);运用Origin 8.5和Office 2016进行相关图表的制作。
2 结果与分析
2.1 不同燕麦品种盐害指数
各燕麦品种在空白和低盐浓度下生长发育正常,没有盐害表现。而随着盐浓度的增加,盐害指数不断提高,盐害程度逐渐增大,且随着盐胁迫时间的延长,盐害程度也随之增大,但不同品种盐害指数对盐胁迫反应有所差异(表1)。
在中盐浓度下,加1和加9在胁迫2 d时开始表现轻度盐害症状,且随着胁迫时间的延长,两品种盐害的症状加剧,第6天和第8天时,多数植株盐害严重;加8和白燕6号在胁迫4 d时开始出现盐害症状,白燕6号在胁迫第6天时出现较明显的中度盐害,加8在胁迫第8天时半数植株表现为中度盐害。在高盐浓度下,加1和加9在胁迫第2天有明显的盐害症状,在胁迫第4天,盐害加剧,在第6天时盐害严重,多数植株生长发育严重受抑制,胁迫第8天植株全部死亡。而加8和白燕6号在胁迫4 d开始表现明显的盐害,随着胁迫时间的延长,两品种出现盐害症状的植株逐渐增多,以白燕6号的盐害症状较明显。比较4个燕麦品种的盐害情况,加8对盐分胁迫较不敏感,白燕6号居中,加1和加9对盐害较为敏感。
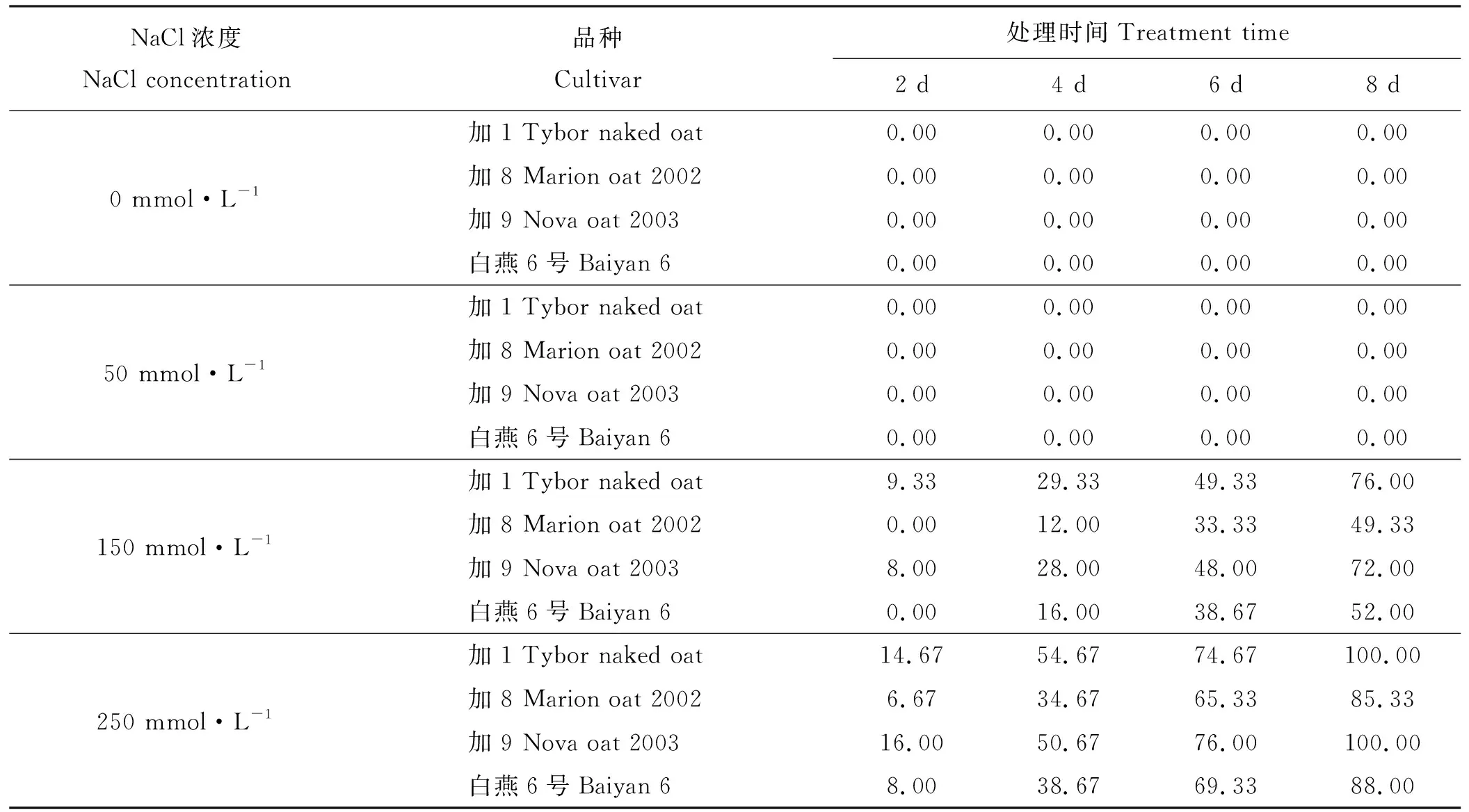
表1 盐胁迫浓度和时间对不同品种燕麦盐害指数的影响Table 1 Effect of salt stress time and concentration on oats salt injury index
2.2 盐胁迫对不同品种燕麦幼苗叶片叶绿素含量的影响
随着盐浓度的增加和胁迫时间的延长,叶绿素含量整体呈下降趋势(图1)。与对照相比,各燕麦品种叶绿素含量在低盐浓度下叶绿素含量总体上呈上升趋势,品种间变化趋势略有不同,其中加8叶绿素含量总体上增加9%,为4个品种增幅最大的,其他3个品种叶绿素含量增加幅度不大,范围为1%~4%。在中盐浓度下,加1和加9随着胁迫时间的延长,叶绿素含量下降趋势明显,胁迫8 d两品种叶绿素含量分别降低了29.12%、26.45%。而加8和白燕6号随胁迫时间延长,叶绿素含量呈现先降低后上升最后降低的波动变化趋势,在胁迫2 d时叶绿素含量均有所降低,而后随着胁迫时间延长,胁迫4 d时,叶绿素含量略有升高,白燕6号在胁迫6和8 d时含量逐渐降低,较对照分别降低4.09%和7.60%,加8则在胁迫8 d时含量降低,降低了6.52%。在高盐浓度下,随着胁迫时间的延长,各燕麦品种叶绿素含量均呈下降趋势,大致上以加1降低幅度最大,而加8降低幅度最小。
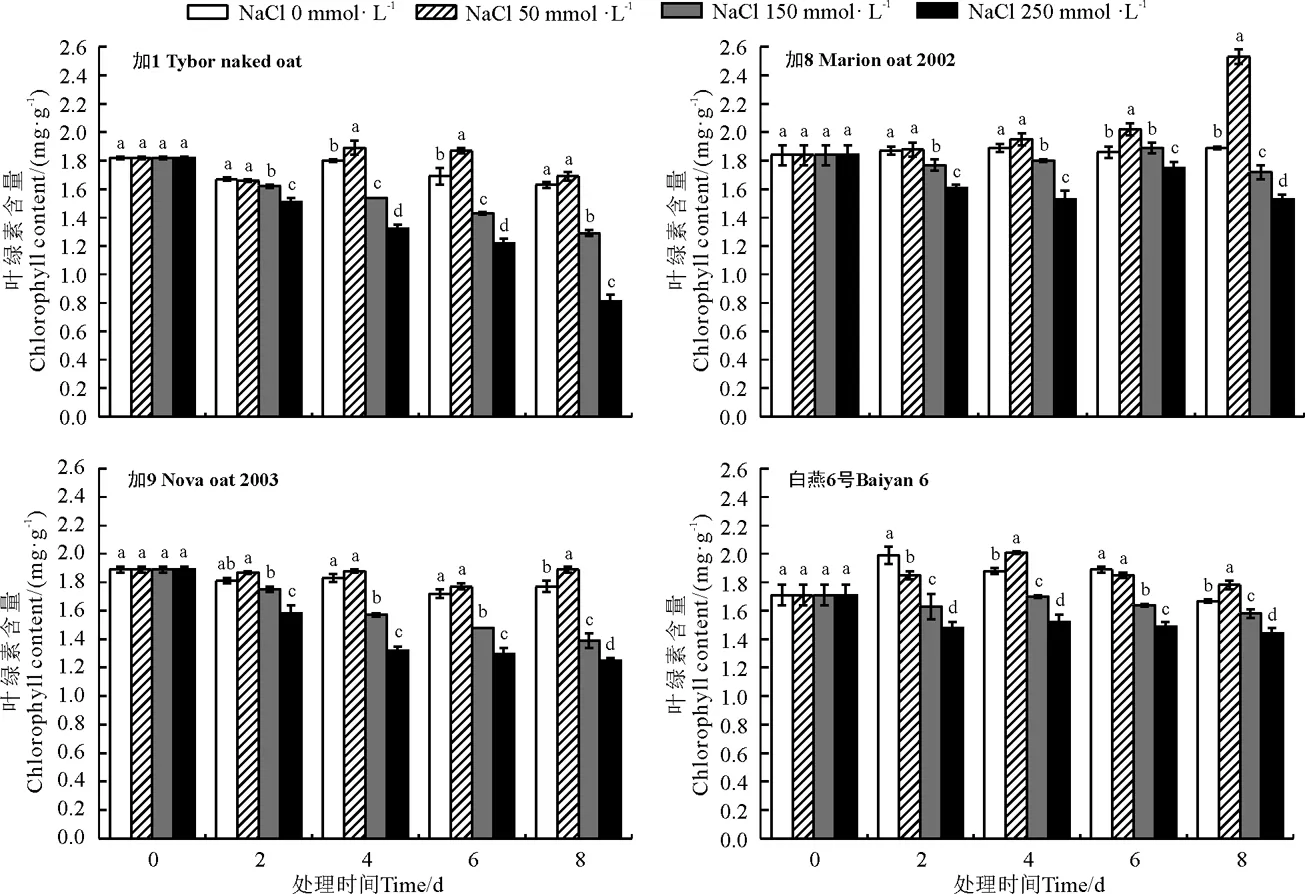
图1 各品种燕麦在不同盐浓度和胁迫时间处理下叶绿素含量Fig. 1 Effect of salt stress time and concentration on chlorophyll content in different oats
同一处理时间不同小写字母表示差异显著(P<0.05)。下同。
Different lowercase letters within the same time indicate significant difference at 0.05 level; similarly for the following figures.
2.3 盐胁迫对不同品种燕麦丙二醛含量的影响
随着盐浓度的升高及胁迫时间的延长,所有燕麦品种幼苗叶片丙二醛含量大体呈逐渐升高的趋势(图2),不同品种间丙二醛积累趋势有所差异。与对照相比,随着胁迫时间的延长,加1、加9丙二醛含量呈先增高后降低的趋势,而加8、白燕6号丙二醛含量低于前两个品种,且随胁迫时间延长逐渐趋于稳定,其中白燕6号在胁迫初期各盐浓度胁迫处理间差异不大。在中盐和高盐胁迫下,随着胁迫时间的延长,各燕麦品种丙二醛含量基本呈上升趋势,在盐胁迫2 d时丙二醛含量有较快的上升趋势,胁迫4和6 d时丙二醛含量上升趋势渐缓,中盐胁迫8 d时丙二醛含量较第6天大量增加,可见植株自身的适应调控机制难以抵抗持续的盐胁迫伤害,正常的生理机能受到影响,正常生长受抑制,高盐胁迫8 d时,大量植株已不能抵抗高盐浓度伤害,植株生长严重受影响甚至死亡。在各盐浓度条件下,加1和加9丙二醛含量均高于加8和白燕6号。由此可见,在不同浓度盐处理下,相比加8和白燕6号,加1和加9对盐胁迫更敏感。
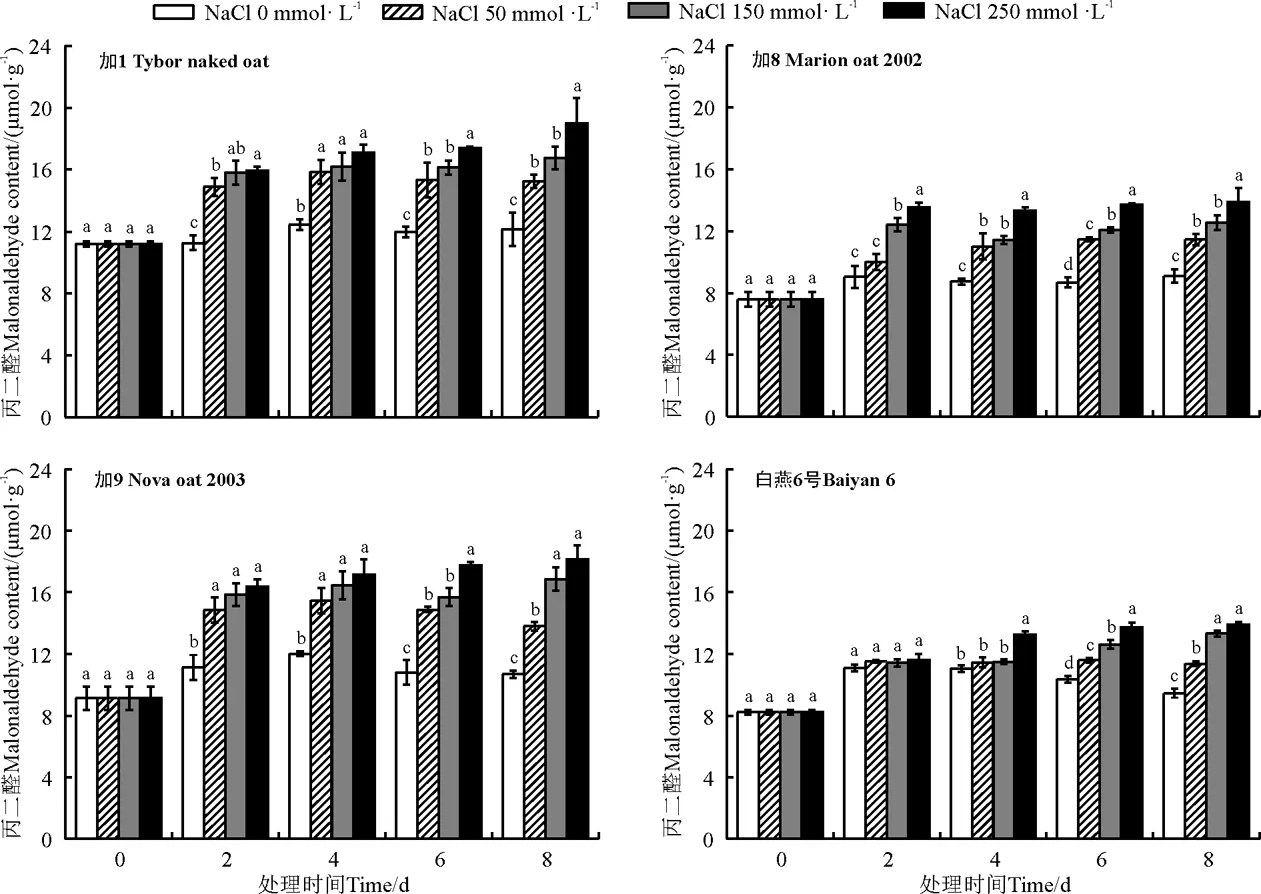
图2 各品种燕麦在不同盐浓度和胁迫时间处理下丙二醛含量Fig. 2 Effect of different salt concentrations and stress time on malonaldehyde content of different oats
2.4 盐胁迫对不同品种燕麦脯氨酸含量的影响
脯氨酸是在细胞中起着渗透调节作用的细胞相溶性物质,它被广泛的积累在各器官中[18]。盐分胁迫下,植物通过脯氨酸的合成和离子吸收降低细胞的水势,同时在高渗溶液中加强水分吸收[19]。盐胁迫下各燕麦品种脯氨酸积累情况如图3所示,各燕麦品种不同盐浓度处理间脯氨酸积累变化有所差异,随胁迫时间的延长,低盐浓度处理下各品种脯氨酸含量变化不大,中盐处理下,加1、加8和加9脯氨酸含量不断累积,而白燕6号脯氨酸含量在第2天与其他品种相比即有较快的积累增长趋势,随着时间的延长,处于相对稳定并逐步累积的状态,在胁迫第8天又快速积累,所有品种在胁迫处理第8天时达到最高值,脯氨酸含量以加8最高,白燕6号次之,加9,加1最低。高盐处理下,各品种间脯氨酸积累变化趋势不一致,加1和加9随着胁迫时间的延长,脯氨酸含量呈现先增加后降低的趋势,而加8和白燕6号脯氨酸含量则是不断积累,但增速降低,在胁迫第8天,与中盐胁迫处理间相差不大,脯氨酸含量趋于稳定。
2.5 不同盐浓度对燕麦品种Na+、K+吸收的影响
随着盐胁迫浓度的提高和盐胁迫时间的延长,所有供试燕麦品种地上部叶片中Na+含量总体呈逐渐增加的趋势(图4),K+含量呈逐渐降低的趋势(图5),不同品种间Na+、K+含量及K+/Na+值变化趋势(图6)稍有不同。在低、中盐胁迫下,各个胁迫时间段内加8体内的Na+含量均低于其他3个燕麦品种,K+含量明显高于其他3个燕麦品种,由于加8较低的Na+吸收和较高的K+吸收,导致其K+/Na+均明显高于其他3个燕麦品种。与其他品种相比较,白燕6号在低、中盐胁迫条件下Na+含量相对较高,并且具有较低的K+吸收能力,表现出较低的K+/Na+值。在高盐胁迫下,随着胁迫时间的延长,加8和白燕6号对Na+吸收仍保持继续增加的趋势,其中加8的持K+能力在前期具有明显的优势,到后期优势减弱,但仍高于其他品种,总体上加8的K+/Na+在胁迫各时期均为最高值。
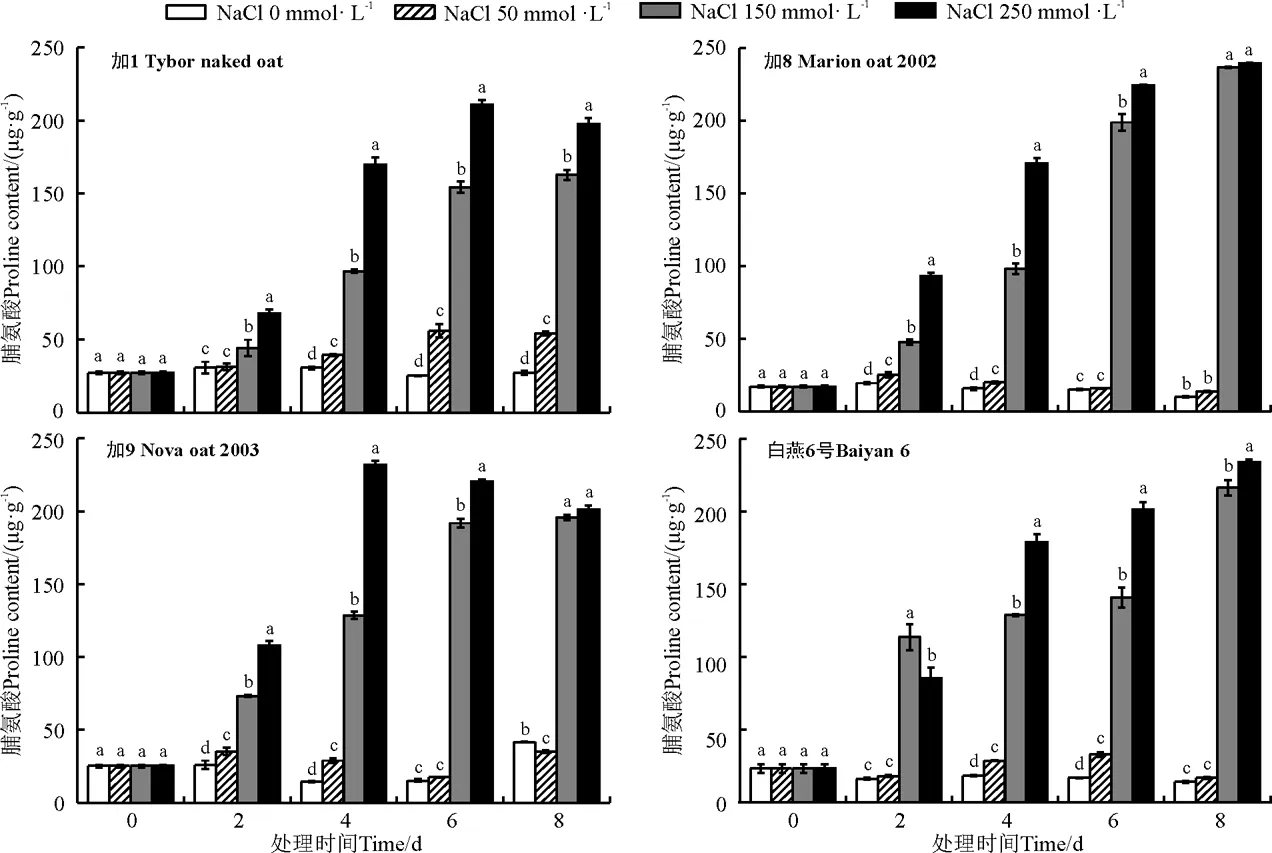
图3 不同盐浓度和胁迫时间处理对各品种燕麦脯氨酸含量的影响Fig. 3 Effect of different salt concentrations and stress time on proline content of different oats
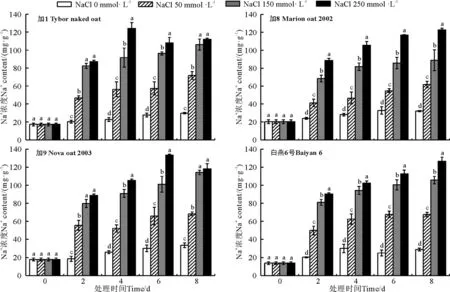
图4 燕麦地上部叶片中Na+含量Fig. 4 Content of Na+ in the leaves aboveground
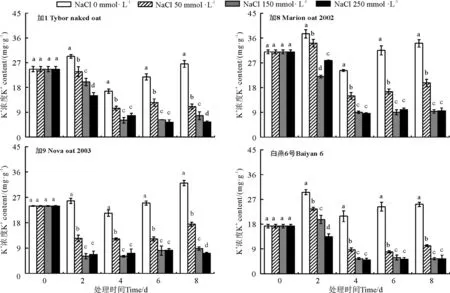
图5 燕麦地上部叶片中K+含量Fig. 5 Content of K+ in the leaves aboveground
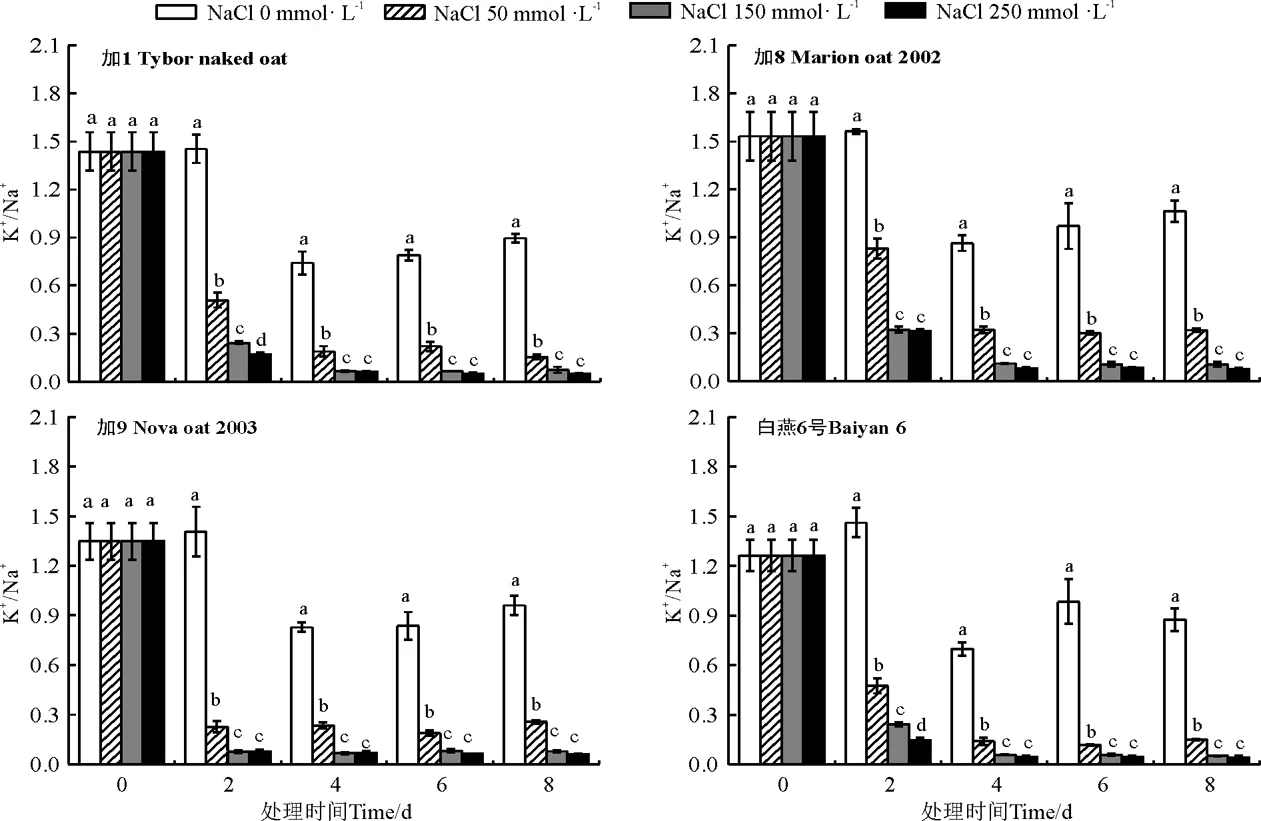
图6 燕麦地上部叶片中K+/Na+比例Fig. 6 Ratios of K+/Na+ in the leaves aboveground
2.6 不同品种燕麦耐盐性综合评价
通过对以上指标结果进行分析,计算得出各指标的耐盐隶属函数值(表2)。脯氨酸在低盐胁迫下和中、高盐胁迫下的含量积累结果不能说明其与作物的耐盐性存在一致的正相关或负相关关系,此外,盐胁迫下耐盐表现较好的品种Na+含量偏高或许与该品种耐盐类型和耐盐阈值有关,在此不作综合评价分析。
对照表2数据,在对照和低盐胁迫下,各品种隶属函数平均值差异不大,随着盐浓度的升高,品种之间的差异逐渐增大,在中盐和高盐胁迫下差异达到最大值。在各个盐浓度下,品种加8和白燕6号隶属函数平均值较高,加1和加9隶属函数平均值较低,总体上以加8耐盐性最好,加1耐盐性最弱。
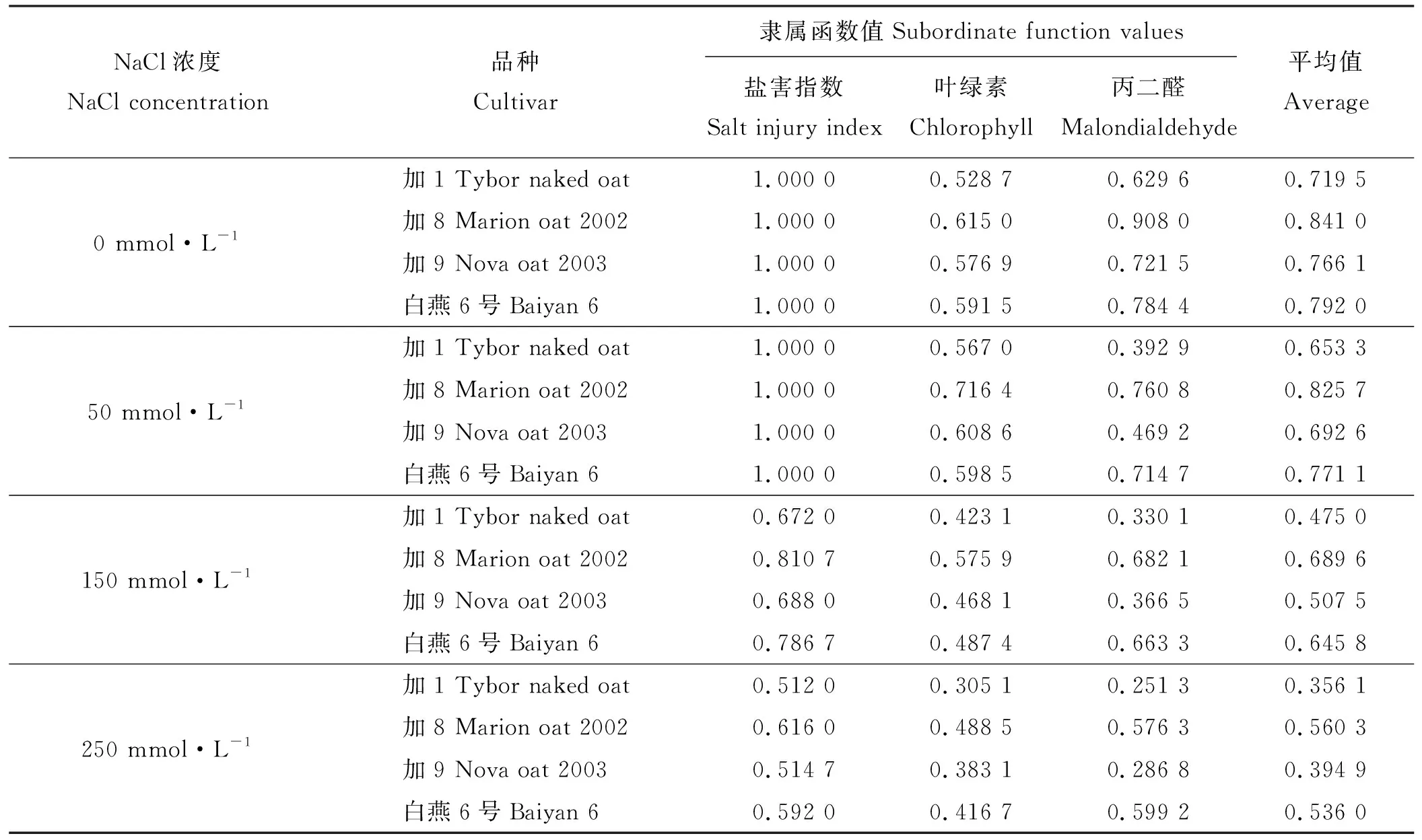
表2 不同品种燕麦指标隶属函数值及耐盐综合评价Table 2 Subordinate function values of the indexes and comprehensive evaluation of salt stress on different oats
3 讨论与结论
本研究作物表观盐害表现结果显示,加8和白燕6号盐害症状相对较轻,而加1和加9在高盐胁迫初期开始就表现明显的盐害症状。不同燕麦品种对盐胁迫的适应性差异在叶绿素含量上也有具体的表现,在中盐浓度条件下,随胁迫时间的延长,加8和白燕6号叶绿素呈先降低后上升最后降低的波动变化趋势,而加1和加9叶绿素含量则不断降低,在高盐浓度下,随着盐胁迫的加剧,各燕麦品种叶绿素含量均呈下降趋势,前两个品种比后两个品种叶绿素含量降低幅度要小。各品种叶绿素含量降低,说明盐胁迫对燕麦植株的光合抑制,盐胁迫一方面可通过减少水势抑制光合作用,另一方面,在高盐浓度下,高浓度的Na+诱导叶绿素酶活性提高,从而加速叶绿素被降解,促使其含量降低[20]。同时高盐浓度下,细胞内离子含量稳定性发生变化,叶绿素和叶绿体之间的连接都是松散的,叶绿素易被破坏[21]。加8和白燕6号叶绿素含量在降低后又出现上升的现象说明,在植株遭受盐胁迫初期,叶片叶绿素和叶绿体膜蛋白含量受到影响出现短暂的降低,植株通过耐盐机制调节自身耐盐适应性,缓和盐胁迫伤害,保持正常生长和光合作用,则叶绿素含量会有短暂的上升现象。一些植物通过增加水利用效率实现耐盐途径,如冰叶日中花(Mesembryanthemumcrystallinum,它们把光合作用模式从C3转换到CAM模式,在长期盐分存在的条件下,植物会在晚上张开气孔,进而减少蒸腾水损失[22]。滨藜(Atriplexlentiformis)在盐胁迫情况下可将光合作用模式从C3路径转换到C4路径[23]。
在盐渍化土壤中,Na+是造成植物伤害的重要因素。盐胁迫下,大量Na+流入细胞可以导致细胞膜去极化,从而诱导K+外流,活性氧代谢系统的动态平衡遭到破坏,膜脂过氧化或膜蛋白过氧化作用造成膜质或膜蛋白损失,导致植物细胞的正常生理功能发生紊乱,甚至伤害死亡[24]。对许多植物来说,如果Na+的毒性是由于Na+利用K+吸收途径并通过竞争K+的结合位点进入植物体内造成的,则维持高的K+/Na+比简单地维持低的Na+浓度更有意义[25]。如大麦(Hordeumvulgare)通过调节H+泵的传输驱动力和K+和Na+的表达和活性,使细胞溶质中维持了K+高盐和Na+低盐[26]。本研究中,随着盐胁迫程度的加剧,加8对Na+的吸收及K+/Na+较稳定,尤其是在盐胁迫下有着较强的持K+能力,能够保持较高的K+/Na+,加8的耐盐性表现也验证了以上观点;加1和加9对Na+的吸收及K+/Na+易受到盐浓度及胁迫时间的影响,耐盐性相对较弱。
游离脯氨酸在细胞内的积累对于降低细胞内溶质的渗透势、均衡原生质体内外的渗透强度、维持细胞内酶正常的结构和构象、减少细胞内可溶性蛋白的沉淀等具有重要的作用。在盐渍条件下植物细胞中吸收和积累大量的盐分,其中大部分盐离子被区隔化在液泡中,因此液泡本身的水势很低,造成细胞质脱水。在此情况下细胞质合成一定数量的脯氨酸和其他可溶性有机物质,增大细胞质浓度,平衡液泡和细胞质的水势,防止液泡从细胞质中吸水,避免细胞质受到影响。Cuin和Shabala[27]研究表明盐胁迫下脯氨酸的积累不仅仅是植物受到盐胁迫的一个症状,它可以通过提高蛋白和膜的稳定性来缓解细胞的伤害,减缓NaCl诱导K+外流,这对保持细胞质高的K+/Na+,从而提高植物的耐盐性非常关键。小麦(Triticumaestivum)受NaCl胁迫时,植株内大部分氨基酸浓度会随着盐胁迫的诱导而增加,脯氨酸增幅尤为显著[28]。本研究中,在高盐胁迫下,加8和白燕6号的脯氨酸含量不断累积,而加1和加9脯氨酸含量达到最高值后分别在胁迫第8天和第6天开始降低,说明加1和加9在高盐处理下,随着盐胁迫时间的延长,细胞主动调节渗透势和维持膜稳定性的适应能力下降,细胞受到盐胁迫的伤害,这一推测在本研究中两个品种在高盐浓度下丙二醛含量明显升高的结论中得到验证。
丙二醛是植物细胞膜脂过氧化自由基链式反应中产生的膜脂内过氧化物进一步降解的产物[29],逆境条件下植物往往会发生膜脂过氧化伤害。丙二醛的含量高低是反映细胞膜脂过氧化作用强弱和质膜破坏程度大小的重要指标,丙二醛含量越高,质膜受到的伤害也越大[30]。Al-Quraan[31]和Chaves等[32]研究表明,随着外界胁迫时间的延长,植物MDA含量有所下降,这可能是因为低盐浓度下,植物盐胁迫程度低,在胁迫一段时间后植物开启自身的渗透调节保护机制减轻盐胁迫的影响,植株能够继续正常生长,生物量有所增长,从而使MDA含量有所降低。加8和白燕6号相对加1和加9有着较低的MDA含量值,可见前两个品种有着较强的盐胁迫适应能力,受到盐胁迫的伤害相对较小,这点在二者表观盐害表现和较高的叶绿素含量得到了印证,与Mansour[33]和Ashraf和Ali[34]认为质膜透性增加及增加幅度与品种耐盐性呈负相关的研究结果相一致。
由此可见,脯氨酸、丙二醛的积累规律与品种的耐盐能力具有相关性,盐胁迫下脯氨酸、丙二醛的积累可作为品种是否耐盐的判定指标,这与前人研究结果相一致[35-37]。
耐盐植物通过诸多生物化学和分子机制应对外界盐胁迫,如选择性积聚或释放离子、控制离子从根部到叶片的运输、合成相溶性物质、改变光合作用途径、改变膜结构、诱导抗氧化酶、植物激素等的产生。不同作物、不同品种之间机理不同、作用强度不同,导致作物耐盐性差异[38]。本研究不同盐浓度处理下耐盐隶属函数值结果可知,品种加8和白燕6号隶属函数平均值较高,加1和加9隶属函数平均值较低,随着盐浓度的升高,品种之间的差异逐渐增大,在中、高盐胁迫下差异达到最大值反映出前两者具有较高的耐盐性,而后两者属于耐盐相对敏感品种,品种间耐盐性由强到弱排列为加8>白燕6号>加9>加1。
植物复杂耐盐机制涉及植物在受到盐胁迫时的主要生理变化过程,主要目的是保护光合作用、呼吸作用、水利用效率和维持一些重要的植物特征(如细胞架、细胞壁、质膜—细胞壁间的交互作用)、染色体和染色质结构的改变(DNA甲基化、染色体增倍,特定次序的改变或DNA消除)等。本研究中加8和白燕6号虽然较其他两个品种较耐盐,但两个品种间还是存在不同的耐盐表现。加8对Na+的吸收及K+/Na+较稳定,尤其是在盐胁迫下有着较强的持K+能力,能够保持较高的K+/Na+,这或许是加8耐盐性高于其他品种的主要原因。在脯氨酸积累方面,白燕6号对于中盐胁迫能快速启动调节机制,大量增加脯氨酸含量,维持细胞质膜稳定性,减少膜脂过氧化伤害,在盐胁迫初期不同盐浓度处理下白燕6号丙二醛含量较低并维持稳定的结果也证明了这一观点。白燕6号在Na+、K+吸收方面,白燕6号相比于加8 Na+含量较高,而K+含量明显不及加8,可能与其在Na+区隔化或脯氨酸渗透调节能力具有一定的优势有关。
随着植物耐盐途径及耐盐机理的不断研究,目前通过植物分子学已鉴定出了一些由盐胁迫诱导的基因[39-40]。拟南芥(Arabidopsisthaliana)在盐胁迫和脱落酸作用下,耐盐性基因AtNHX1基因的转录本为上调,说明NaCl、KCl或脱落酸能促进AtNHX1启动因子[41]。同样在盐胁迫转录下,诸多研究从分子角度验证了耐盐机理[42-43]。耐盐性具有多基因支配特征,不同功能组的基因共同参与编码盐胁迫蛋白质,包括光合作用酶基因、相溶性物质合成基因、液泡酶基因和清除活性离子酶基因等,大部分基因在功能组上被划分为盐胁迫下的盐诱导基因。但是当前对盐诱导基因认识仍然不足,需要进一步加强研究。
