继发性骨质疏松发病机制
2018-12-19雷嫚嫚李卓郭蔚莹
雷嫚嫚 李卓 郭蔚莹
吉林大学第一医院内分泌代谢科,吉林 长春 130021
骨质疏松症(osteoporosis)是一种以低骨量和骨组织微结构破坏为特征,骨质脆性增加和骨折风险增高的全身性骨代谢性疾病。骨质疏松可分为原发性和继发性两类。继发性骨质疏松常见于男性和绝经前女性,通常是由于某些疾病、药物或其他原因引起的骨量减少,易发生脆性骨折。国外研究表明,在罹患骨质疏松的人群中,高达50%~80%的男性和30%绝经后女性为继发性骨质疏松[1]。目前诊断继发性骨质疏松需有赖于详细的病史、完整的体格检查和辅助检查,特别是相关疾病史、特殊药物使用史。不同于原发性骨质疏松,继发性骨质疏松首先要针对其病因进行治疗,如果仅采用常规的抗骨质疏松治疗方案,其临床疗效可能并不理想。因此早期识别和合理治疗继发性骨质疏松,对于广大医疗工作者而言有重要的临床意义。特此,本文将对几种常见的继发性骨质疏松进行一一综述。
1 糖皮质激素引起的骨质疏松
糖皮质激素(glucocorticoid,GC)在临床工作中运用广泛。Yu等[2]研究结果显示,在18岁以上成年人群中使用GC的患者大约为4.25%,而55岁及以上的妇女人群中使用GC的患者达到9.1%。众所周知,糖皮质激素的内源性分泌过量或全身用药是骨质流失的重要原因,并且是在临床实践中观察到的引起继发性骨质疏松最常见的医源性原因。据统计,长期接受糖皮质激素治疗的患者有多达30%~50%的罹患骨质疏松症[3]。糖皮质激素引起的骨质疏松(glucocorticoid-induced osteoporosis,GIOP)是在使用GC时出现的常见不良反应。其特点是在使用糖皮质激素过程中骨量减少、骨微结构破坏、骨强度下降、进而骨脆性增强、骨折风险增高。GIOP患者的骨折风险与GC的日剂量和使用时间密切相关。

表1 常见的引起继发性骨质疏松的原因Table 1 Most common causes of secondary osteoporosis
GIOP主要影响松质骨上成骨细胞的数量,因此腰椎、肋骨、长骨末端是GIOP导致骨量丢失最快、发生骨折风险最高的地方[4]。使用糖皮质激素患者的骨活检显示骨基质沉积率减慢、松质骨容积缩小、骨吸收增加、骨形成降低。其作用机制可能如下:①糖皮质激素影响骨形成和骨吸收:糖皮质激素抑制骨细胞的增殖、与基质结合及I型胶原和非胶原蛋白的合成。同时糖皮质激素可引起成骨细胞前体生成减少和成熟成骨细胞凋亡增加,组织形态计量学研究已证实GIOP患者中松质骨骨壁变薄与松质骨上成骨细胞数量减少密切相关[4]。尽管糖皮质激素阻碍破骨细胞产生,但是可以通过延长破骨细胞的生存期限来维持破骨细胞的生理功能。研究表明,糖皮质激素促进核因子-κB受体激活剂配体(receptor activator of nuclear factor-kappaB,RANKL)的生成,其与破骨细胞前身细胞对应受体核因子-κB受体活化因子(ligand of receptor-activator of nuclear factor-kappaB,RANK)结合,激活转录因子核因子-κB,提高破骨细胞活性,延长破骨细胞生存期,并降低骨保护素(osteoprotegerin,OPG)水平。OPG是RANKL的天然诱捕性受体,通过与RANKL结合,阻断后者的信号传导,从而降低破骨细胞数量和抑制破骨细胞功能[4]。OPG、RANK、RANKL分子及相关的信号传导通路组成的OPG/RANKL/RANK系统,是破骨细胞分化过程中的调节机制,是成骨细胞与破骨细胞相互作用的重要途径。②糖皮质激素影响小肠对钙、磷的吸收,降低肾脏对钙的重吸收;增加尿钙的排泄,抑制1,25(OH)2D3的活性,继而引发继发性甲状旁腺功能亢进,而持续增高的甲状旁腺素可以促进骨钙动员,加快骨吸收,引起骨量丢失。③糖皮质激素还可以抑制胰岛素样生长因子从而引起肌肉萎缩,以及通过刺激肌肉产生肌肉生长抑制素(促进肌肉中肌原纤维蛋白水解)引发肌肉萎缩,从而导致肌力下降,增加跌倒风险,最终导致骨折风险升高[5]。④体内过高的糖皮质激素影响垂体-性腺轴,抑制黄体生成素和雄激素的合成,引起骨质疏松[6]。因此GIOP患者治疗过程中需保证充足的维生素D和钙剂的摄入,双膦酸盐可升高患者的骨密度和降低骨折的发生率。
2 甲状旁腺功能亢进症
甲状旁腺素(parathyroid hormone,PTH)由甲状旁腺主细胞合成分泌,是调节钙磷代谢及骨转换的重要肽类激素,其直接作用于肾脏和骨骼,促进骨钙动员和肾脏对钙的重吸收,还可通过促进肾1α-羟化酶使25(OH)D3转化为1,25(OH)2D3,间接促进肠钙的吸收。小剂量或间歇性升高的甲状旁腺素可促进骨形成[7],而持续高浓度的甲状旁腺素可促进骨吸收[8]。原发性甲状旁腺功能亢进症是由于甲状旁腺本身病变(肿瘤或增生)引起的甲状旁腺素(PTH)分泌过多,通过对骨和肾的作用,导致高钙血症和低磷血症。
骨骼是甲状旁腺功能亢进症受累的主要靶器官之一,更多甲状旁腺功能亢进的患者临床表现仅为骨质疏松。相对于松质骨,原发性甲状旁腺功能亢进症首先影响骨质丰富的皮质骨。因此,腰椎部位的骨密度可能不能真实反映全身骨水平,遂建议测评患者的前臂远端和股骨颈的骨密度[9]。原发性甲状旁腺功能亢进症造成骨吸收的机制还未完全明确。组织形态计量学显示持续升高的PTH可以诱导高骨转换,并与低骨密度、矿化密度分布和胶原交联的异常改变密切相关,这都影响骨的强度和质量[10]。与健康对照者相比,原发性甲状旁腺功能亢进症患者具有低OPG/RANKL比,处于高骨吸收状态[11]。在原发性甲状旁腺功能亢进症患者中还发现无翅型小鼠乳房肿瘤病毒整合位点家族/β-连环蛋白(wingless-type mice mammary tumour virus integ-ration site family,Wnt/β-catenin)信号通路被抑制,这可能与患者体内高水平的分泌型糖蛋白Dickkopf-1(Dkk-1)有关[12]。Wnt/β-catenin信号通路是骨形成的主要启动途径,可促进成骨细胞增殖、成熟和祖细胞分化。经典Wnt信号通路的抑制剂包含Dkk家族,其可通过结合Wnt信号分子和竞争性结合共同受体低密度脂蛋白受体相关蛋白5/6抑制Wnt信号转导入细胞内,从而发挥抑制经典Wnt信号通路的作用。故高水平的Dkk-1与骨吸收和骨量减少密切相关。所有有症状的原发性甲状旁腺功能亢进症患者都应该手术治疗,且在甲状旁腺切除术后,其骨折风险大大改善[13]。该手术可以缓解高钙血症,同时还能改善骨骼和肾脏功能[14]。在未接受手术治疗的原发性甲状旁腺功能亢进症患者中,前臂远端和股骨颈的骨密度在起始的8年是稳定的,但随后这两个部位的骨密度分别会下降10%和35%[14]。这提示没有接受甲状旁腺切除术的患者需要长期监测骨密度的变化。
3 慢性肾脏疾病
肾脏对维持骨矿盐的稳定和骨的正常功能具有重要作用:①肾脏是PTH作用的靶器官,也是PTH降解和清除的器官;②肾脏中的1α-羟化酶可使25(OH)D3转化为1,25(OH)2D3;③肾脏参与调节钙、磷、镁在体内的代谢平衡;④肾脏是铝和β2微球蛋白等清除的重要途径,这些物质在血中浓度升高会影响骨细胞代谢和骨矿盐的稳定性[15]。终末期慢性肾病患者处于脆性骨折的高风险中。这类患者的骨折风险较普通人群高2~14倍,并且其骨折风险随肾脏功能恶化而升高[16]。美国肾脏病数据库报告显示,与普通人群相比,男性透析患者髋部骨折风险高达7.5倍,女性高达13.6倍[17]。来自于韩国队列研究显示,终末期慢性肾病患者中的血清成纤维细胞生长因子23(fibroblast growth factor 23,FGF-23)和全段甲状旁腺素的增加先于血清钙和磷酸盐的变化,这个结果和西方人群相似[18]。终末期慢性肾脏疾病引起骨质疏松的机制可能是:①在终末期慢性肾病早期,由于肾功能下降,磷酸盐潴留,血磷升高,钙排泄增多,从而代偿性促进FGF-23分泌,升高的FGF-23通过下调1α-羟化酶表达,阻碍25(OH)D3向1,25(OH)2D3转化,从而降低1,25(OH)2D3的水平[19]。Wahl等[20]研究表明,FGF-23被认为是慢性肾脏疾病初始阶段中磷代谢紊乱的早期生物标志物,其比磷酸盐或PTH能更早的反映肾功能变化。FGF-23调节磷和维生素D代谢。在健康个体中,FGF-23由骨细胞分泌,通过刺激磷酸尿排出,降低1,25(OH)2D3和PTH水平,来调节膳食磷负荷或体内1,25(OH)2D3水平。②随着肾脏功能的进一步衰竭,机体为了纠正低钙血症、低1,25(OH)2D3、高磷血症和其他的因素对机体的影响,引发PTH大量分泌,引起继发性甲状旁腺功能亢进。而高水平的PTH如前所述,通过增加成骨细胞和间质细胞RANKL合成, 使破骨细胞前体细胞分化为破骨细胞,增加骨吸收。③此外,慢性肾病中长期代谢性酸中毒也可引起骨矿物质的变化,如钠、钾、碳酸盐和磷酸盐的大量流出以缓冲氢离子。④同时在机体酸环境刺激下,成骨细胞会生成前列腺素,以旁分泌的方式,增加RANKL合成。RANKL提高破骨细胞活性,募集新的破骨细胞进一步促进骨吸收和缓冲氢离子负荷,进一步加重骨破坏[21]。
4 风湿类疾病
风湿类疾病是引起继发性骨质疏松的重要原因,其引起的全身和局部炎症反应导致骨量丢失已得到证实。炎性因子、生长因子能引起破骨细胞分化,激活 RANK/RANKL通路,引起破骨细胞介导的骨量丢失;在病程中使用糖皮质激素治疗也是造成骨质疏松的原因。系统性红斑狼疮是一种有多种自身抗体出现以免疫性炎症为突出表现的自身免疫性疾病。在系统性红斑狼疮患者中,骨量减少者约占25%~74%,骨质疏松者约占1.4%~68%,都易发生椎体骨折[22]。其骨纵向显微结构恶化的特点是皮质骨萎缩和皮质骨孔隙度增加。系统性红斑狼疮引起继发性骨质疏松的主要机制如下:①炎性因子、生长因子能引起破骨细胞分化,激活 RANK/RANKL通路,引起破骨细胞介导的骨量丢失,同时抑制成骨细胞促使的骨形成。系统性红斑狼疮患者血清中白细胞介素(interleukin,IL)-1和IL-6等细胞因子结合成骨细胞表面的受体后能诱导并且增加RANKL的表达,RANK与受体RANKL结合后,进而促进破骨细胞前体细胞分化为成熟的破骨细胞,刺激破骨细胞活性,促进骨吸收,导致骨质疏松。同时体内高水平的肿瘤坏死因子-α(tumor necrosis factor,TNF-α)也可通过结合其成骨细胞表面的受体来促进骨吸收,引起骨质疏松[23]。②系统性红斑狼疮为自身免疫性疾病,其细胞免疫和体液免疫的紊乱及血清中异常水平的抗体都可能参与骨质疏松的发生。系统性红斑狼疮患者中血OPG/RANKL比例较健康对照组降低,并且与抗Sm抗体、补体C3/C4的水平具有相关性,这表明系统性红斑狼疮本身参与了骨质疏松的发生[24]。③此外系统性红斑狼疮患者维生素D含量降低的现象非常普遍。系统性红斑狼疮患者的炎症本身可能会提高维生素D的分解代谢从而导致患者维生素D缺乏,同时这些患者体内抗维生素抗体也可导致维生素D减少。这也可能是系统性红斑狼疮导致骨质疏松的机制之一。而在类风湿性关节炎中,除了在早期活动性未治疗的类风湿性关节炎患者中OPG/RANKL比例降低外,还发现Dkk-1和硬化蛋白(骨形成抑制剂)的水平增加[25]。这可能也是类风湿性关节炎继发骨质疏松的原因。
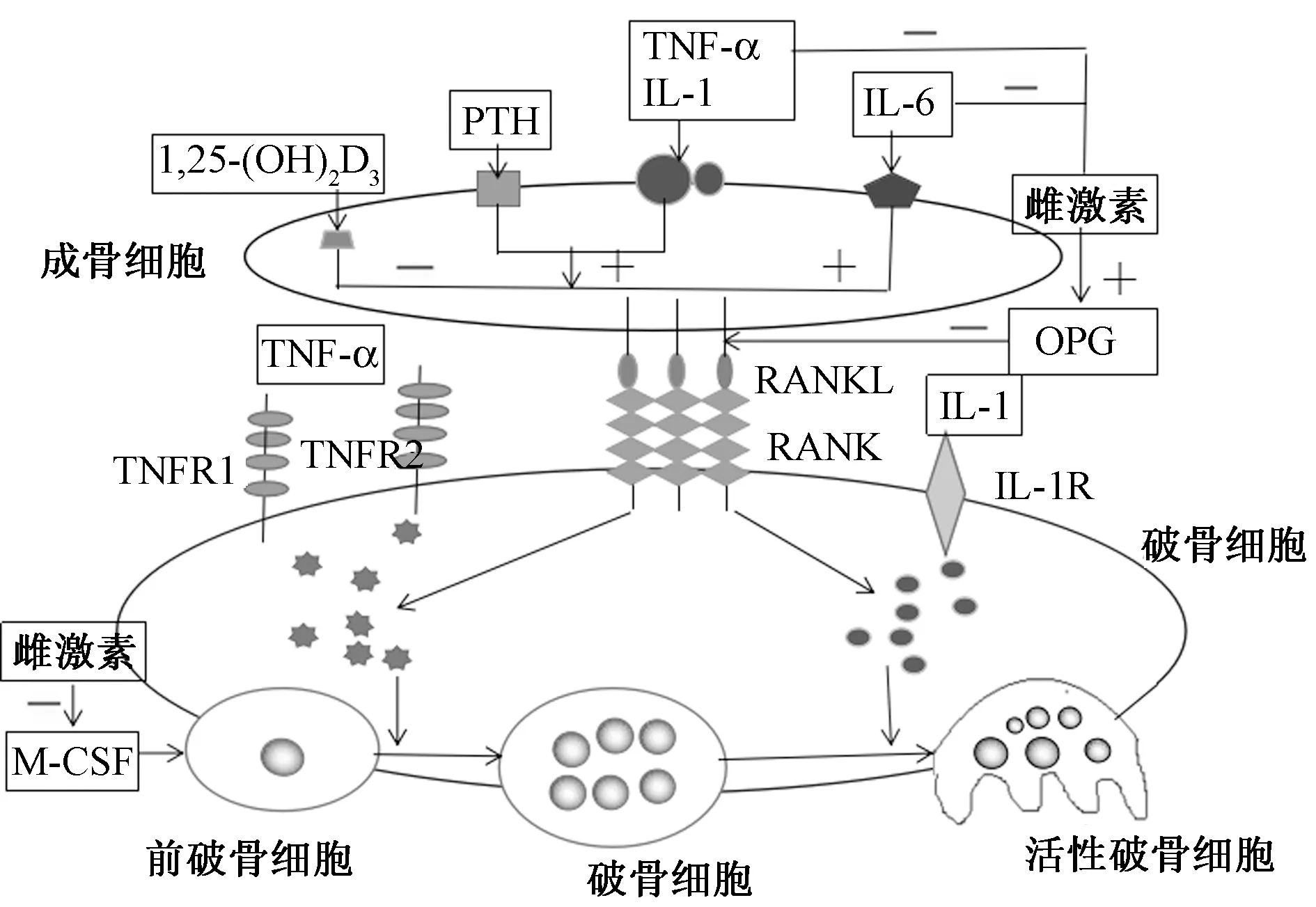
图1 相关因子对成骨细胞和破骨细胞作用的机制Fig.1 The mechanism of the effect of the related factors on the osteoblast and osteoclast注:甲状旁腺素(parathyroid hormone,PTH;肿瘤坏死因子-α(tumor necrosis factor,TNF-α);肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR);骨保护素(osteoprotegerin,OPG);白细胞介素-1(interleukin,IL-1);白细胞介素-1受体(interleukin-1 Receport,IL-1R);白细胞介素-6(interleukin,IL-6);核因子-κB受体激活剂配体(receptor activator of nuclear factor-kappaB,RANKL);核因子-κB受体活化因子(ligand of receptor-activator of nuclear factor-kappaB,RANK);一:抑制;+:促进。
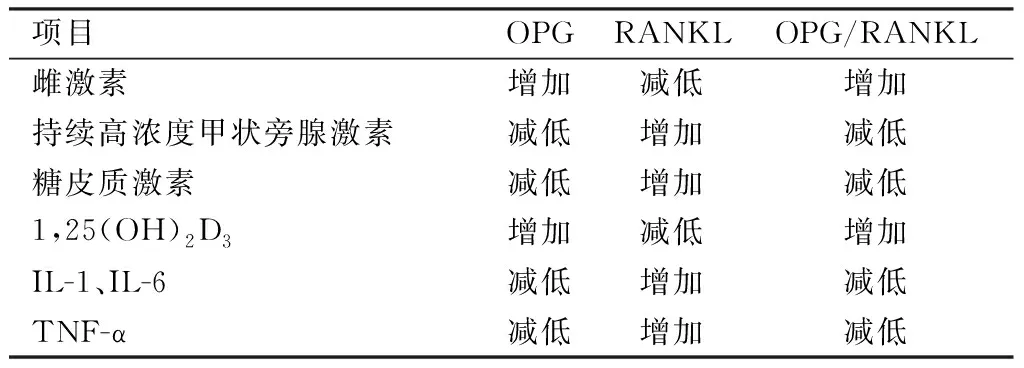
项目OPGRANKLOPG/RANKL雌激素增加减低增加持续高浓度甲状旁腺激素减低增加减低糖皮质激素减低增加减低1,25(OH)2D3增加减低增加IL-1、IL-6减低增加减低TNF-α减低增加减低
5 性腺功能减退症
男性和女性的性腺功能减退都能引起骨密度降低和骨量丢失。两性原发性性腺功能减退症(特纳综合征和克氏综合征)都可引起低骨密度和低骨质量,最终导致骨折风险增加。性腺功能减退症是导致男性继发性骨质疏松最重要的原因之一。睾酮在骨质成熟过程中至关重要,骨量在青春期结束时达到峰值,并在成年期间保持稳定。青春期睾酮缺乏是青年男性骨质疏松症的重要危险因素。在50岁以后,男性血清雌激素、睾酮水平会随着机体老化而下降,但雌激素下降时才会发生皮质骨丢失[26]。众所周知雌激素对骨健康作用关键,大部分睾酮对骨代谢的作用是其对雌激素的芳香化所介导的[27]。雌激素是生长和成熟期间骨质量的重要增强剂,它们增加骨质量,维持骨密度,延缓骨质流失,并且在青春期的骨膜骨生长中作用突出。雌激素可以促进成骨细胞产生骨保护素;可以降低骨髓单个核细胞分泌IL-1和TNF,抑制破骨细胞生成、活化;可以降低巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)基因表达,减少其分泌。M-CSF是一种促破骨细胞生成因子,可以增加破骨细胞生成的基本转录因子,促使破骨细胞分化、发育,延长其生存时间。体外研究表明,雄激素还可通过结合成骨细胞上雄激素受体上调转化生长因子β和胰岛素样生长因子-2(参与骨形成),下调前列腺素E2和白细胞介素6(参与骨吸收)从而刺激成骨细胞增殖[28]。此外,睾酮与维生素D途径之间联系密切,睾酮间接作用于甲状旁腺激素-维生素D轴,其缺乏或可降低肾脏1α-羟化酶活性,因此体内1,25(OH)2D3浓度也会降低[29]。高促性腺功能减退症(特纳综合征和早产儿卵巢功能不全)引起的骨质疏松的发生率高于低促性腺功能减退症[30]。与低促性腺功能减退症相比,除了低水平的性激素(特别是雌激素)外,高促性腺机能减退症中高FSH水平也会增加骨矿物质丢失[31]。
6 甲状腺功能亢进症
甲状腺功能亢进症(hyperthyroidism)是由多种原因引起的甲状腺功能亢进和(或)血循环中甲状腺素水平增高所致的一组常见的内分泌病。甲亢患者的骨形成指标如碱性磷酸酶和骨钙素以及骨吸收指标如吡叮啉都升高,因此甲亢是高转换型骨质疏松症。许多研究表明,未经治疗的甲亢患者的骨密度会下降、骨折风险会升高[32]。甲亢患者的骨密度一般会下降12%~20%,当促甲状腺素(thyroid stimulating hormone,TSH)小于0.1mU/L,髋骨和椎骨骨折风险分别增加3倍和4倍[33]。甲状腺毒症对骨骼的影响可能是通过三碘甲状腺原氨酸(T3)与核受体甲状腺激素受体α(thyroid hormone receptor,TR-α)和甲状腺素受体β(thyroid hormone receptor,TR-β)相互作用来介导的。T3过度刺激TR-α,即位于骨骼中的主要甲状腺素受体,加速骨重塑,导致骨质疏松症[34]。除了过量的甲状腺素对骨骼的直接分解代谢作用外,最近的证据表明,TSH可能是骨转换的负调节因子。即使在正常范围内,较低的TSH水平也会对髋关节的骨密度以及近端髋部几何形状产生负面影响,增加患者的骨折风险[35]。尽管T3和T4水平正常,TSH受体的表达降低也会导致骨高转换状态和低骨密度,这表明甲亢相关骨量丢失也与TSH信号传导降低有关[36]。因此在甲状腺功能减退症中,使用高度敏感的TSH测量可以更准确地表示甲状腺素替代治疗患者的临床疗效,遂建议将TSH保持在正常范围的中值以避免骨损伤[37]。
7 糖尿病
据流行病学调查显示,我国成年人2型糖尿病患病率为9.7%~11.6%,已成为全球糖尿病患者最多的国家[38]。糖尿病患者骨质疏松的发病率大约为40%~66%,而且其发生骨折的危险程度明显增加,这引起了国内外广泛的重视。糖尿病相关性骨质疏松发病机制较多且较复杂,而主要的有高血糖毒性、胰岛素和胰岛素样生长因子缺乏、钙、磷代谢紊乱、肠钙吸收及维生素D合成障碍、肾脏病变、继发甲状旁腺功能亢进、微血管病变、遗传因素及生活方式等。下面从两方面具体叙述。
钙、维生素D代谢、胰岛素异常:①由于高血糖、渗透性利尿和糖尿病引起的肾小管对钙、磷重吸收障碍,糖尿病患者尿钙排泄明显增加,且小肠对钙的主动转运功能也受到一定影响,导致低血钙、低血磷,从而引起形成骨的基础物质丢失;②糖尿病患者体内低水平的胰岛素和胰岛素样生长因子-1削弱了对肾1-α羟化酶的刺激作用,减少活性维生素D的合成[39]。
成骨细胞功能不足、破骨细胞活动增强和胶原合成障碍;①高血糖可诱导体内活性氧的产生,阻碍成骨细胞的增殖和分化,且葡萄糖的高渗透性促进骨髓脂肪细胞的分化,影响骨细胞分化的微环境。此外高血糖对胶原的非酶促糖基化作用可以降低胶原的力度,增加骨脆性;②高血糖产生的过多糖基化终末产物与其受体结合后可能刺激过多的细胞因子如IL-1、IL-6等形成,降低OPG/RANKL比,进而促进破骨细胞形成、活性增加,同时抑制成骨细胞的分化与矿化作用[40];③糖尿病患者成骨细胞功能和数量不足与缺乏胰岛素、胰岛素样生长因子1有关。胰岛素通过结合骨细胞表面的胰岛素受体发挥成骨作用,并有促进骨胶原组织合成作用。杨爱格等[41]对国内糖尿病合并骨质疏松常见危险因素进行了一次全面的系统评价,发现低的空腹胰岛素水平是骨质疏松的危险因素。胰岛素样生长因子1具有调节骨形成作用。胰岛素还和胰岛素样生长因子1、甲状旁腺激素之间对促进骨形成具有协同作用。故糖尿病患者体内绝对或相对不足的胰岛素和胰岛素样生长因子-1使成骨细胞功能降低,骨转换下降,骨基质分解;④糖尿病患者体内低血钙和低血磷反应性刺激PTH分泌,间接促进破骨细胞活动加强,从而导致骨质疏松。⑤糖尿病的微血管病变可能会干扰血液流向骨骼骨髓,从而影响微环境和局部骨重塑。
在2型糖尿病中,引起骨量减少的原因还具有其独特地方。有文献报道,口服降糖药物罗格列酮在进入其靶细胞与核受体结合后,可活化过氧化物酶体增生物,激活受体转录因子,抑制成骨细胞,同时促使脂肪细胞和破骨细胞生成。此外,2型糖尿病患者体内瘦素水平较高,瘦素具有中枢性的骨调控作用,它虽不直接作用于成骨细胞,但却抑制骨形成,瘦素不足时骨密度升高[42]。
8 其他
除以上列举的疾病可引起继发性骨质疏松外,我们在临床上还观察到神经性厌食症、艾滋病、地中海贫血、乳糜泻、减肥手术、慢性阻塞性肺疾病、帕金森病、充血性心力衰竭等都可能引发继发性骨质疏松。临床医生需要了解对骨骼产生不利影响的常见病症和药物,筛选和治疗继发性骨质疏松的高危人群,这样才能从最大程度上减缓患者骨质疏松的进展和减少骨折的风险。
