基于平衡图像认知模型解决平衡图像多元变化问题
2018-12-17郭樱滨
郭樱滨
摘要:化学平衡图像千变万化,以最基拙的v-t图像入手,初步构建出图像认知模型,再衍生到常见的c(n)-t图、φ(α)-T(P)-t图、φ(α)-P-T图等。通过这些图像的衍生变形,充分把握图像的“五点”(起点、拐点、终点、交点、突变点)和曲线斜率的化学含义,结合化学平衡移动的理论,找出解题的突破口,成功完成解题。
关键词:化学平衡图像;数形结合;认知模型
文章编号:1008-0546(2018)10-0048-04 中图分类号:G633.8 文献标识码:B
《化学反应原理》作为高考必考内容,在高中化学教学中占据极其重要的地位。近几年,高考题中所设计的化学平衡图像题目千变万化,其中巧妙灵活的设计和新颖奇特的图像题常常让考生感到无从下手,从而产生挫败感,最后导致失分。因此,如何把数学的图像和化学的平衡理论结合在一起,突破数形结合下的化学平衡移动原理图像解析,是一个值得高中化学老师深入思考和探索的问题。
为了解决这个问题,我们以基础的v-t化学平衡图像为基点,对化学平衡图像进行深入的剖析,通过多角度的衍生并且变化出更多的新图像,推理总结出解题思路与结论,最后构建出平衡图像的认知模型。认知模型的构建,能够帮助学生在千变万化的平衡图像面前,提取重要的有效信息,无论图像如何衍生变化,都能让学生顺利找出突破口,轻松解题,应对自如。
认知心理学中的原型范畴理论认为人在认识事物的过程中首先是通过原型认识实物,然后在掌握原型特征的基础上将与原型具有差异性的新事物进行归类认识,进而达到认识新事物的目的川。根据原型范畴理论进行认知模型的构建则是一种遵循人类思维方法的科学性的教学操作。所谓构建平衡图像的认知模型,就是从无数衍生变化的平衡图像中提取与基本图像相同的本质特征,并进行归纳整合,构建相应的认知模型。归纳分类得越细致,该认知模型的应用性就越大。化学平衡图像认知模型的构建,在于让学生理解基础的原型特征,从而举一反三,帮助学生在学习各种不同变化的平衡图像题时,做到以不变应万变,最终在考试中处变不惊,顺利解题。
一、捕捉化学平衡图像题中出现的最基础的有效信息(如图1)
1.横坐标与纵坐标的含义
横坐标通常是:t、T、P等(即时间,温度,压强等)。
纵坐标通常是:v、c、n、α、φ等(即速率,物质的量浓度,物质的量,转化率,体积分数等)。
2.线的走向与斜率
线的走向,即随着横坐标自变量的增大,纵坐标因变量是变大,变小,还是不变。当纵坐标所表示的物理量,如:速率,物质的量浓度,物质的量,转化率,体积分数等不随横坐标的变化而变化时,图像中出现一条直线,那么该反应就到达了化学平衡状态。斜率,是化学平衡图像曲线中,一个重要的参数。斜率的应用,通常是对两条不同曲线的斜率进行比较,或者通过比较同一条曲线不同时刻的斜率变化来判断反应是改变了哪些外界条件[2]。
3.观察化学平衡图像中的“重点”
所谓的“重点”,指的就是化学平衡图像中的起点、拐点、终点、交点、突变点等,这些点往往隐藏着许多重要的信息,借助这些“重点”中的有效信息,能够快速地找到解题的思路,突破图像题的难点。
4.跟踪化学平衡图像中量的变化
量的变化,指的是纵坐标表示的物理量所发生的变化是由什么外界条件改变而引起的。要解决这个问题,我们经常要借助化学平衡移动理论。
二、由v-t图(速率-时间图)初步构建出平衡图像认知模型
速率-时间图,是教科书中出现的最基础的图像,通过最简单速率-时间图像的衍生,可以变形出当外界条件改变时的多种速率-时间图。对这一类型的速率-时间图进行观察,我们可以总结出相对应的规律。
当其他条件不变,改变单一变量(如浓度、压强、温度或催化剂等),速率-时间图像变化会存在以下规律:
1.若正反应速率曲线或逆反应速率曲线之一是连续渐变的,则必为改变浓度。
2.若正反应速率曲线和逆反应速率曲线都在某一个瞬间突然增大或者是减小,则必为改变温度或者压强。
3.若正反应速率曲线和逆反应速率曲线仍为一条水平线,则可能是使用了催化剂或改变压强。注意,这里的改变压强,只适用于反应前后气体分子数目不变的反应。
4.上方速率曲线决定化学平衡移动方向。即正(逆)反应速率曲线在上,平衡向正(逆)反应方向移动。
掌握了这些规律,我们就可以利用它进行快速解题。
例1.对于反应:2SO2+O22SO3△H<0:其反应速率随时间的变化如图2,请分析t1、t2、t3時刻改变的外界条件分别是什么?并说明理由。
解题时,先观察图像的横纵坐标所表示的含义,然后再观察纵坐标表示的物理量速率随时间的变化。t1时刻,正逆反应速率曲线均突增且不相等,说明改变的外界条件只能是升高温度或者增大压强,再结合正反应速率曲线在上,说明平衡向正反应方向移动。综合分析,我们不难得出t1时刻改变的外界条件为增大压强。t2时刻,正逆反应速率曲线之一逆反应速率曲线是连续渐变的,则必为改变浓度。由于正反应速率在t2时刻突减,且逆反应速率曲线在上,说明平衡向逆反应方向移动,综合分析,t2时刻改变的外界条件为减小反应物浓度。t3时刻正逆反应速率曲线同时突增,且正逆反应速率曲线不随时间变化而变化,仍为一条水平线,则可能使用了催化剂或改变压强。由于该反应前后气体分子数目改变,则t3时刻改变的条件为加入催化剂。在没有特殊说明的情况下,催化剂通常都代表正催化剂,使正逆反应速率均增大。
通过对速率-时间图像变化的分析,我们可以构建一个这样的平衡图像认知模型:从图像上纵坐标的变化(点的突变或曲线的走向)分析出速率变化可能改变的外界条件是什么,再结合平衡是否移动以及平衡移动的方向得出正确的结论(如图3)。
三、用平衡图像认知模型来解决多角度衍生变化的平衡图像
如果将速率-时间图像的纵坐标改成物质的量浓度或物质的量,那么就会出现新的图像。这一类型的图像常常通过纵坐标物理量的变化关系,考查如何书写出正确的化学反应方程式或考查某个时刻曲线的变化是由什么外界条件的改变引起的。我们仍然可以用平衡图像认知结构模型来进行解题。从图像上纵坐标(点的突变或曲线的走向)的变化分析出物质的量浓度或物质的量的变化可能改变的外界条件是什么?再结合平衡是否移动以及平衡移动的方向进行综合分析得出正确的结论。
例2.在一密闭容器中进行某反应(A、B、C均为气体),该反应的物质的量随时间的变化如图4所示,请回答下列问题。
问题1:写出该反应的化学方程式:
在书写化学反应方程式前,我们必须先根据纵坐标所表示的物理量物质的量的曲线走向判断出A、B是反应物,C是生成物。并根据纵坐标A、B、C的物质的量的变化量之比,计算出化学方程式的计量系数之比。特别注意的是,对于反应物的物质的量最后不为零的这类反应,曲线末端显示为一条水平线,即我们所说的平台,在方程式书写时,必须打上可逆号。因此,此图像的化学反应方程式为:3A+B2C。
问题2:若该反应为放热反应,反应曲线变化如图4所示,20分钟时,可能改变了什么外界条件?40分钟时,外界条件改变,平衡如何移动?可能是改变什么外界条件引起的?
c(n)-t图中,判断改变何种因素,我们依然从纵坐标所表示的物理量物质的量的变化入手,从下面几个方面来解题。1.曲线的连续性。图中20分钟时,物质的量瞬间不变,则不可能改变物质的量。2.斜率。斜率的大小代表了速率的大小,图中20分钟后单位时间内物质的量的变化量增大,即曲线斜率均增大,则可能增大压强或升高温度。3.判断平衡移动方向。由于A、B的物质的量在减小而C的物质的量却在增大,说明平衡正反应方向移动。综合以上三点,我们不难得出20分钟改变的条件为增大压强。
同样的思路,我们可以对40分钟改变的外界条件进行判断。40分钟时,B的物质的量不连续,发生突变,A、C的物质的量瞬间保持不变,且从曲线的走向可以判断出平衡向逆反应方向移动,说明改变的外界条件为移出1.5mol的B。
平衡图像的曲线变化和外界条件的改变息息相关,我们也可以反过来解题。
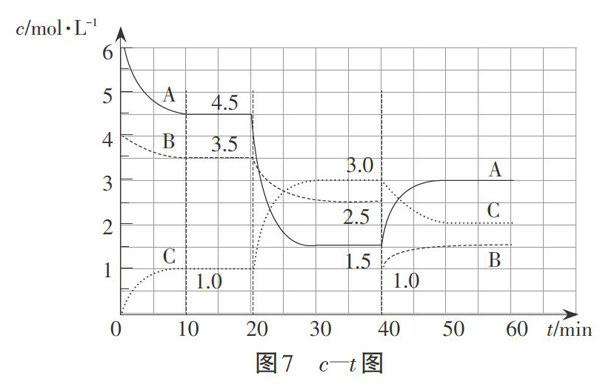
问题3:若在60min时压强减小为原来的一半,请在图4中用曲线表示出各物质的物质的量浓度随时间的变化趋势。
这题我们也可以借助平衡图像认知模型进行分析,外界条件(压强)改变,平衡是否移动,如何移动,平衡图像中纵坐标(物质的量)应该随横坐标(时间)发生怎样的变化(如图5)。
画图时,我们要注意以下几个因素。首先,压强减小一半,物质的量瞬间不变,因此,图像是连续的。再根据压强减小,平衡向逆反应方向移动,A、B的物质的量要增大,C的物质的量要减小。其次,压强减小则正逆反应速率都减小,体现在图像中则表现为斜率变小,曲线的走势变平缓。曲线的画法,如下图6所示:
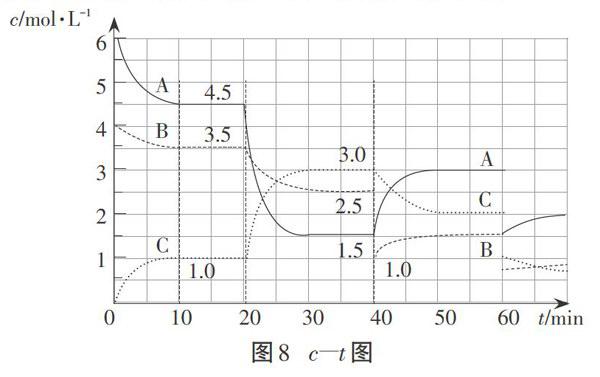
问题4:若把纵坐标改为物质的量浓度(如图7),画出60min时压强减小为原来的一半(默认为通过扩大容器体积来改变压强),各物质的物质的量浓度随时间的变化曲线。
画图时,首先,我们要分析压强减小一半,容器的体积会扩大为原来的两倍,则A、B、C物质的浓度要均减半,因此,图像是不连续的,A、B、C三个点要出现突变。再根据压强减小,平衡向逆反应方向移动,A、B的物质的量浓度要变大,C的物质的量浓度要减小。其次,压强减小则反应速率减慢,体现在图像中则表现为斜率变小,曲线的走势变平缓。曲线的画法,如下图8所示:
四、“先拐先平数值大”、“定一议二”和“引入辅助线”的辅助方法
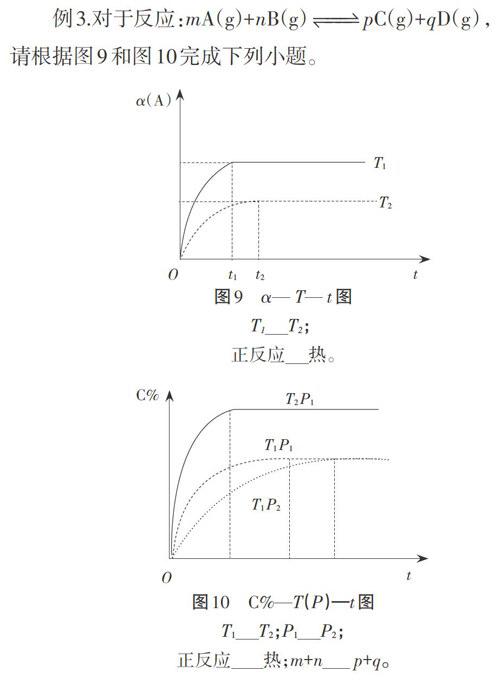
纵坐标除了速率、浓度或物质的量,也可以是转化率、体积分数或百分含量等,而且可能还会出现更多的其他变量,这就需要我们对具体图像进行符合题意的分析。如图9和图10,是常见的φ(α)-T(P)-t图。
例3.对于反应:mA(g)+nB(g)pC(g)+qD(g),请根据图9和图10完成下列小题。
分析这种图形,我们要掌握“先拐先平数值大”和“定一议二”这两种铺助方法。“先拐先平数值大”指的是,其他条件不变时,温度越高或压强越大的反应,化学反应速率快,则到达平衡所需的时间比较短,更快到达平衡状态,图像上表现出先出现拐点和平台。“定一议二”指的是,当图像中出现三个变量时,我们可以先确定一个量不变,再来讨论另外两个量的关系。
在图9中,T1曲线先出现拐点和平台,先达到平衡,那么,T1温度高,数值大。升高温度,A的转化率增大,平衡向正反应方向移动,说明正反应吸热。所以:T1>T2;正反应吸热。
图10中,比较T2P1和T1P1的曲线,利用“先拐先平数值大”判断出T2>T1。再利用“定一议二”在压强相同的情况下,由图像可知升高温度,C的百分含量增大,可知平衡向正反应方向移动,正反应为吸热反应。同理,P1>P2。增大压强,C的百分含量不变,平衡不移动,说明化学反应前后气体分子数目保持不变。所以:
T12;P1>P2;正反应吸热;m+n=p+q
例4.对于反应:mA(g)+nB(g)pC(g)+qD(g);请根据图11完成下列小题。
图11是三条恒压线,是在不同压强下,A的转化率随温度的变化曲线,为了有效地分析出量与量之间的变化关系,我们除了要利用“定一议二”的解题方法之外,还需要借助画等温线的辅助方法。
先选取任意一条恒压线,随着温度升高,A的轉化率增大,说明平衡向正反应方向移动,正反应是吸热反应。再做一条等温线(如图12),可以判断,温度一定时,增大压强,A的转化率增大,平衡向正反应方向移动,正反应为气体分子数目减小的方向[3]。所以:
正反应吸热;m+n>p+q。
化学平衡图像中,常见的图像类型有以下四种。
1.v-t图;
2.c(n)-t图;
3.φ(α)-T(p)-t图;
4.φ(α)-P-T图。
通过这四种图像可以继续衍生变形出更多的未知图形。但是,无论图像如何变化,万变不离其宗。新图像的解题思路,我们可以用构建的平衡图像认知模型,即从纵坐标所表示的物理量的变化,变化主要从“五点”(起点、拐点、终点、交点、突变点)入手,分析曲线的走向和斜率,理解各条线段的化学含义,再结合化学平衡移动的理论知识和外界条件的改变联系起来,经常还要借助“先拐先平数值大”、“定一议二”和“引入辅助线”的辅助方法,找出解题的突破口,从而成功解题。
参考文献
[1]刘霞.原型范畴理论在九年级化学化学符号教学中的应用研究[D].长沙:湖南师范大学,2012(1):41-43
[2]胡永才.对“化学平衡移动”的认识[J].北学教学,2015(7):86-89
[3]胡永才.如何准确判断化学平衡移动的方向[J].北学教学,2014(11):86-89
