高原花斑裸鲤Cu/Zn-SOD的克隆鉴定表达及其对Cu2+胁迫的应答※
2018-12-17卫福磊朱世海栗瑞红王玉晴金文杰韩步鹰千康康申志新关宏弢李长忠
张 霞,卫福磊,张 娅,朱世海,栗瑞红,王玉晴,吴 君,马 睿,金文杰,韩步鹰,千康康,申志新,关宏弢,李长忠*
(1.青海大学生态环境工程学院,青海西宁,810016;2.青海省渔业环境监测站,青海 西宁,810012)
实现水体污染提前预警是当前生物学研究的热点,其研究难点在于生物标记物的筛选。本研究以高原花斑裸鲤为研究对象,拟通过对高原花斑裸鲤Cu/Zn-SOD基因的克隆鉴定表达及对其Cu2+胁迫的应答分析,筛选重金属胁迫下的生物标记物。
铜(Cu)既是鱼类生命活动所必需的微量元素,又是水生环境中最普遍的污染物之一。然而,Cu作为一种生物体所必需的微量元素与作为一种致毒金属之间的浓度范围极其狭窄[1-3],即使在低浓度下,Cu可以引起鱼、蟹和虾等的免疫毒性,导致食用者严重的健康风险[4]。SOD作为一类抗氧化物酶类,将超氧阴离子自由基转化为过氧化氢(Hydrogen peroxide,H2O2),清除机体内的氧自由基。在抗氧化系统中,SOD被认为是抗氧化应激的第一道防线[5]。近年来研究发现[6],SOD 可以作为一种生物标志物(biomarker)或生理生化指标应用于分子生态毒理研究中。
1 材料与方法
1.1 实验动物处理
花斑裸鲤:3龄期成体花斑裸鲤(n=20)获取于青海省渔业环境监测站隆务河口养殖场,体重为105±10 g,体长为19±3 cm。暂养于青海大学生态环境工程学院细胞遗传学实验室冷流水养殖箱(温度17℃±2℃;光照周期14h/10h)。适应实验室饲养环境一周后,进行Cu2+胁迫。实验用水为曝气2 d的自来水,实验期间,用增氧泵自动充氧,全程溶氧量不低于6 mg/L。另外,为避免实验动物饥饿对实验造成影响,实验期间正常喂食,每天换三分之一的水以保持水体清洁,并增加相应量的Cu2+以维持Cu2+浓度平衡。
1.2 实验试剂选择
用1000 mL ddH2O溶解15.6 mg的分析纯级五水硫酸铜(CuSO4·5H2O),配成浓度为4 mg/L的Cu2+母液,每次使用时稀释成浓度为0.01 mg/L的Cu2+。
1.3 Cu2+胁迫
随机选取大小一致、健康的花斑裸鲤20尾,分别投入到空白对照组(5尾)和1个处理组(3个水族箱内各5尾),在3个时间段分别取样3尾。处理组胁迫浓度以《中国渔业水质标准》(GB 11607-1989)中Cu2+的标准值(0.01mg/L)为试验浓度。
1.4 引物设计
根据虹鳟鱼(Oncorhynchus mykiss)、鲤鱼(C.carpio)、斑马鱼(Danio rerio)、鲫鱼(C.auratus)等已知Cu/Zn-SOD cDNA保守序列,利用Primer Premier 5.0(Premier,Canada)设计用于 PCR 扩增的引物(表1)。
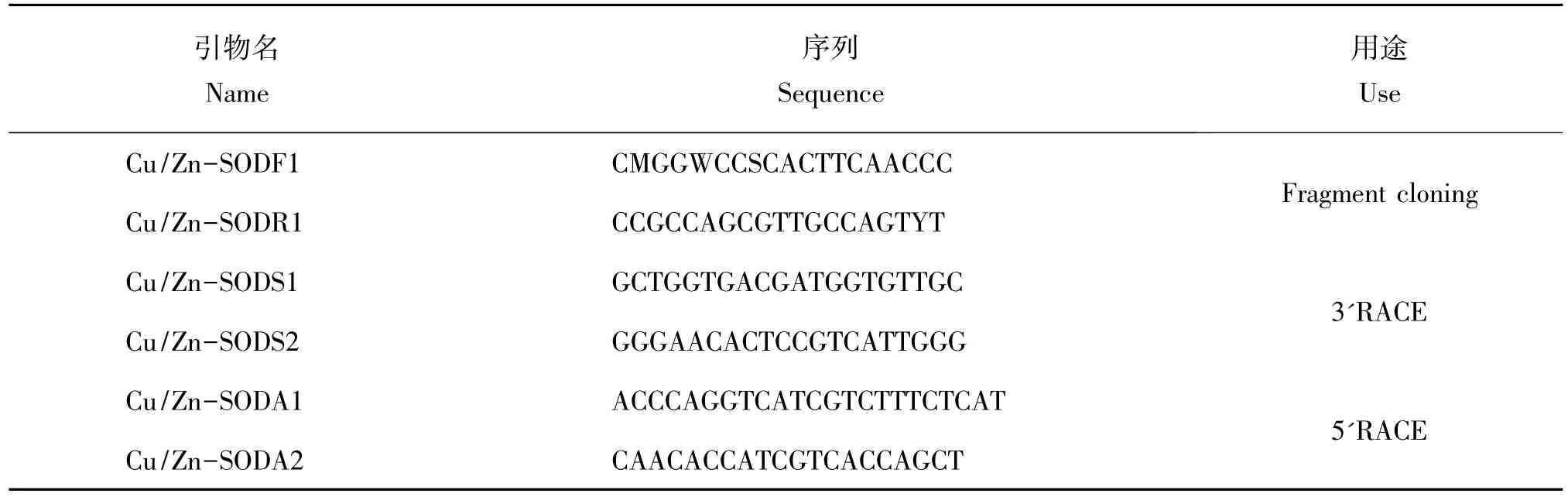
表1 PCR引物相关参数Table 1 Reference of the Oligo nucleotide primers used for PCR
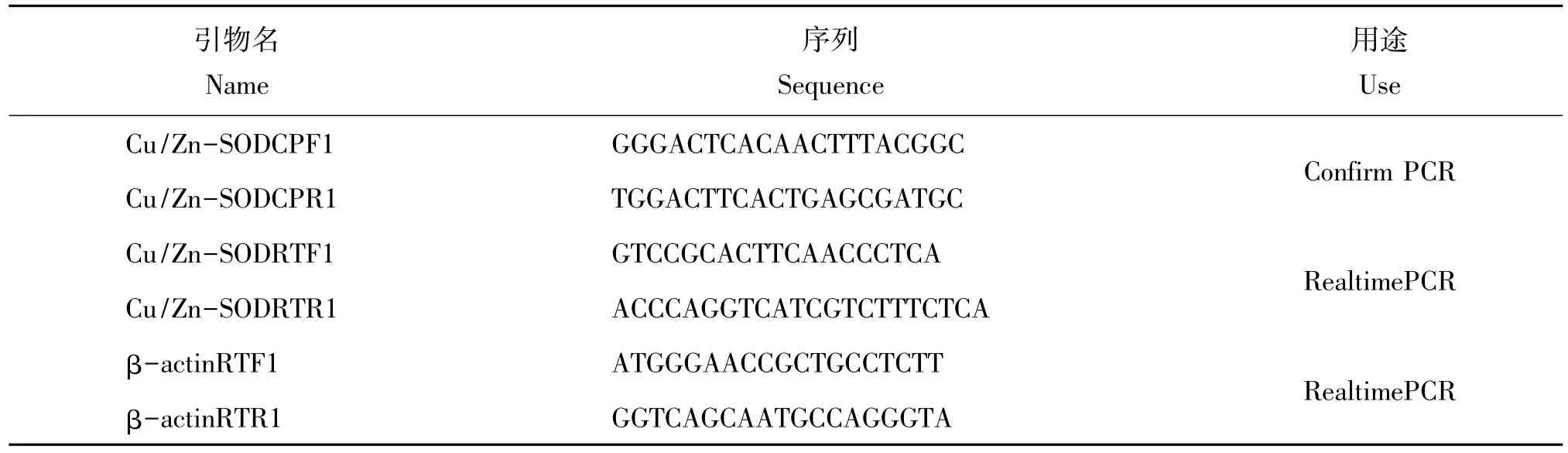
续表:
1.5 RNA提取与cDNA合成
对照组和胁迫后12、24、48 h的处理组分别随机取样3尾鱼,用干毛巾擦干鱼体,采集肝、肾、脑、鳃组织,立即用液氮速冻,然后放入-80℃冰箱中保存。
利用TIANGEN RNAsimple Total RNA Kit试剂盒(DP419,天根,中国)提取花斑裸鲤肝、肾、脑、鳃组织总RNA,-80℃保存。采用PrimeScriptTM 1st strand cDNA Synthesis Kit逆转录试剂盒(AK3902,TaKaRa,日本)反转录合成cDNA。
1.6 Cu/Zn-SOD 全长 cDNA 克隆
以1.5反转的鳃组织的cDNA为模板,用引物Cu/Zn-SODF1/Cu/Zn-SODR1(表 1)进行 PCR 扩增,获得花斑裸鲤Cu/Zn-SOD特异性片段。采用RACE技术扩增 Cu/Zn-SOD 5'端非编码区(5'-UTR)和 3'端非编码区(3'-UTR)。3'RACE和 5'RACE分别使用引物Cu/Zn-SODS1/Cu/Zn-SODS2和Cu/Zn-SODA1/Cu/Zn-SODA2(表 1)进行扩增。最后利用引物 Cu/Zn-SODCPF1/Cu/Zn-SODCPR1(表1)进行Confirm PCR扩增。
1.7 Cu/Zn-SOD序列分析及系统进化树构建
使用DNAman软件进行DNA全长拼接并翻译成氨基酸序列。用ProtParam软件对推导出的蛋白序列进行蛋白理化特性预测分析(http://web.expasy.org/protparam)。运用生物信息学软件 Vector NTI(Infor-Max,Frederick,USA)进行同源性比较,采用软件 MEGA 7构建邻接(Neighbor-joining,NJ)系统进化树。
1.8 Cu2+胁迫下Cu/Zn-SOD的表达量检测
使用引物 Cu/Zn-SODRTF1/Cu/Zn-SODRTR1(表1),以β-actin为内参进行实时荧光定量PCR分析。
2 结果与分析
2.1 Cu/Zn-SOD 克隆
通过RT-PCR和RACE技术获得Cu/Zn-SOD全长cDNA序列(共785bp),包含210 bp的片段序列(图1A)、277 bp的 3'-UTR(图 1B)和 43 bp的5'-UTR(图 1C),最后进行 Confirm PCR 鉴定(图1D)。GenBank登录号:KX826080。
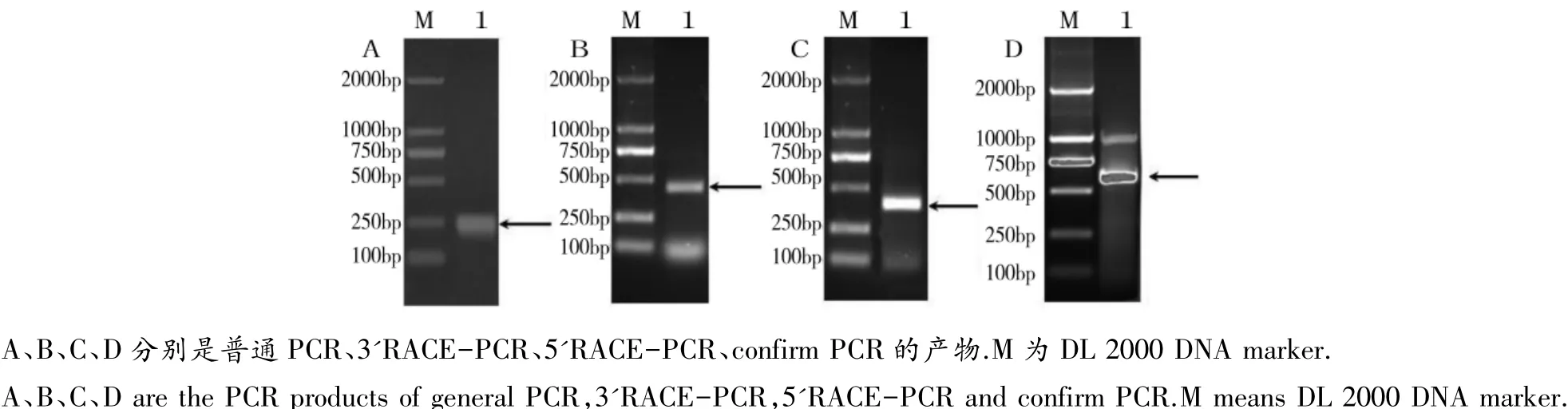
图1 花斑裸鲤Cu/Zn-SOD PCR产物电泳图Figure 1 PCR products of GeCu/Zn-SOD
2.2 Cu/Zn-SOD 序列特征分析
花斑裸鲤 Cu/Zn-SOD的全长 cDNA序列共785 bp,被命名为GeCu/Zn-SOD(GenBank序列号:KX826080),由465 bp的编码区、43 bp的 5'-UTR和277 bp的3'-UTR构成。Cu/Zn-SOD共编码了154个氨基酸,分子量为15.62 KDa,等电点(Isoelec-tric point,PI)为 6.02。Cu/Zn-SOD 的氨基酸序列中含有3个O-糖基化位点、4个N-糖基化位点、5个磷酸化作用位点(4个丝氨酸和1个苏氨酸)、7个重金属结合位点(3个Zn2+结合位点,3个Cu2+结合位点,1个Cu2+和Zn2+共同的结合位点)、2个半胱氨酸位点C58和C147及2个Cu/Zn-SOD家族标签序列(45-GFHVHAFGDNT-55,139-GNAGGRLACGVI-150)。3'-UTR 含有 10个多聚腺苷酸尾巴和1个3'端的加尾信号,无信号肽和跨膜区。Cu/Zn-SOD二级结构无α-螺旋和β-折叠,其中延伸链占 44.8%,环占 55.2%(图 2)。

图2 花斑裸鲤Cu/Zn-SOD cDNA序列和氨基酸序列图Figure 2 The full length cDNA sequences and amino acid sequences of Cu/Zn-SOD
2.3 Cu/Zn-SOD 邻接树构建
根据20个物种的Cu/Zn-SOD的氨基酸序列构建的系统进化树(图3)和同源性分析(表2)结果表明,该进化树分为5簇:硬骨鱼类、哺乳类、两栖类、细菌类和软体类,而花斑裸鲤属硬骨鱼类一簇,这与传统分类结果一致。GeCu/Zn-SOD氨基酸序列与其他物种中该序列的同源性为硬骨鱼类81%~94%、哺乳类78%~74%、软体类75%、两栖类74%~75%和细菌类23%~24%。
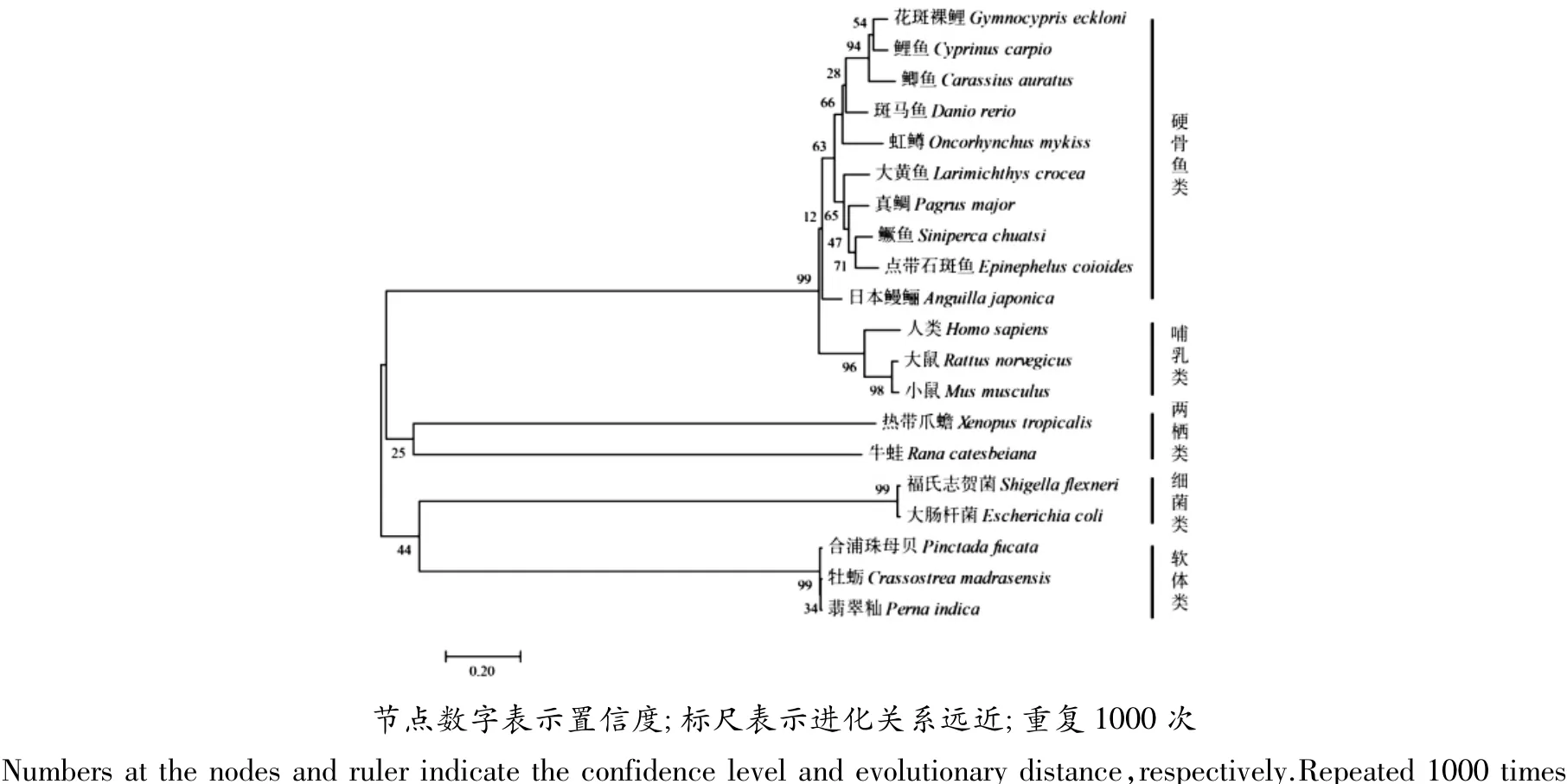
图3 Cu/Zn-SOD进化树Figure 3 Phylogenetic tree of the Cu/Zn-SOD
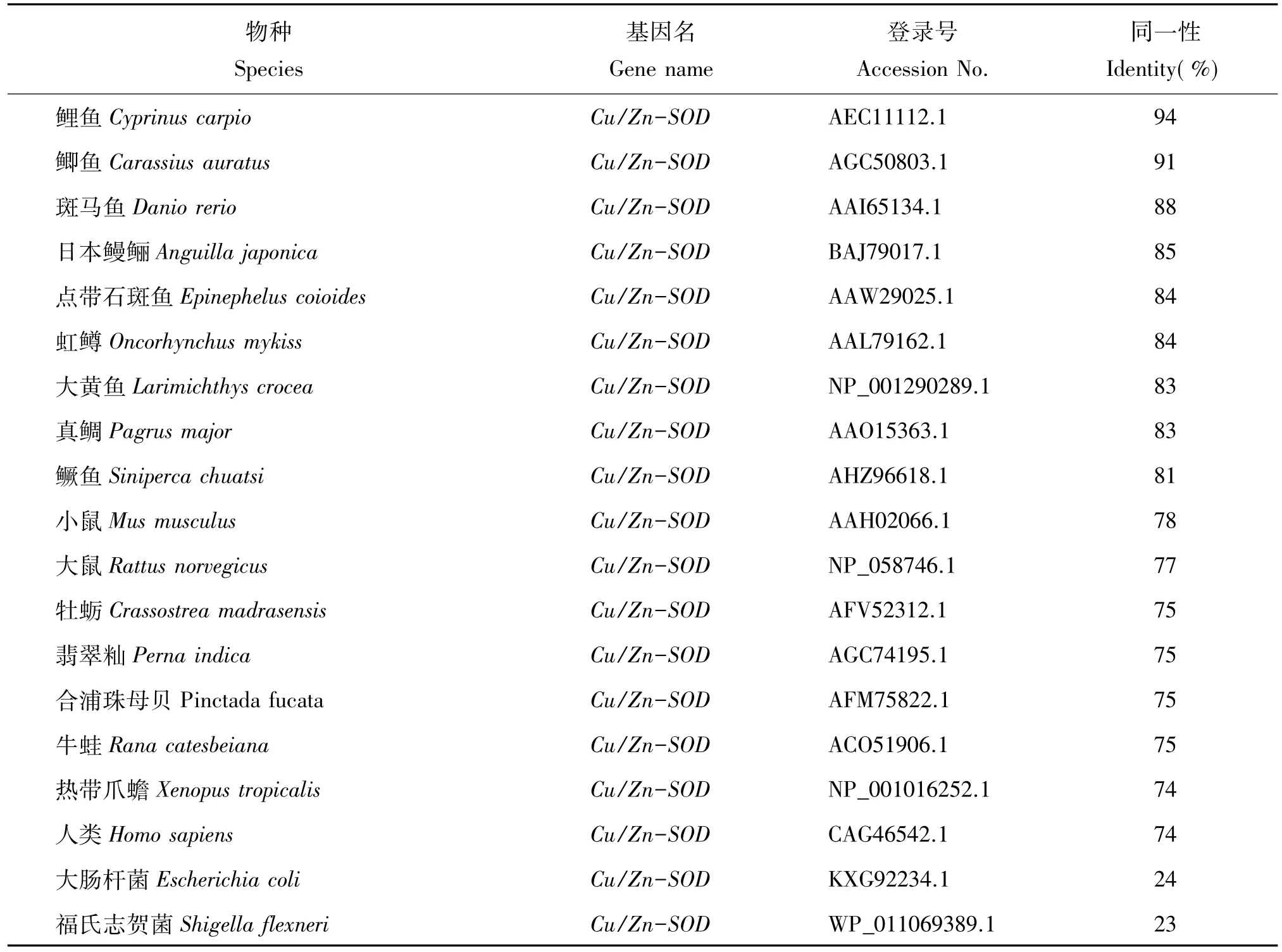
表2 花斑裸鲤与其他物种Cu/Zn-SOD氨基酸序列同源性分析结果Table 2 Homology analysis of the Cu/Zn-SOD amino acid sequences between G.eckloni and other species
2.4 GeCu/Zn-SOD在各组织中的表达检测
用Real-time PCR法检测GeCu/Zn-SOD在肝、肾、脑、鳃组织中的表达,肝中的表达量最高,是鳃表达量的 11.4 倍(n=3,P<0.05);其次为肾和脑,分别是鳃相对表达量的 2.9 倍和 1.6 倍(n=3,P<0.05)图4)。
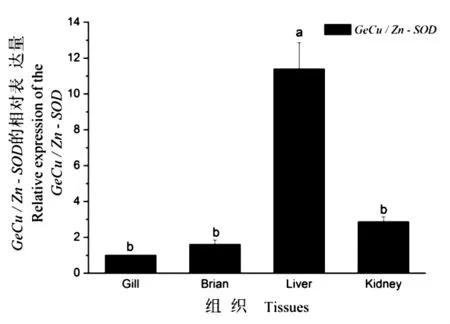
图4 GeCu/Zn-SOD基因在花斑裸鲤各组织中的表达分析图Figure 4 Expression analysis of GeCu/Zn-SOD in tissues of G.eckloni
2.5 Cu2+胁迫下 GeCu/Zn-SOD 应答检测
用Real-time PCR技术检测Cu2+胁迫下花斑裸鲤GeCu/Zn-SOD在肝、肾、脑、鳃组织的应答(图5)。在Cu2+胁迫下,GeCu/Zn-SOD在肝中胁迫后12 h下降,到24 h时表达量升高到最大值,而后下降(P<0.05);在肾中胁迫后12 h下降后,一直升高到48 h达到最高(P<0.05);在脑中胁迫后48 h内的表达量基本不变(P>0.05);在鳃中胁迫后到24 h时表达量升高到最大值,而后下降(P<0.05)。
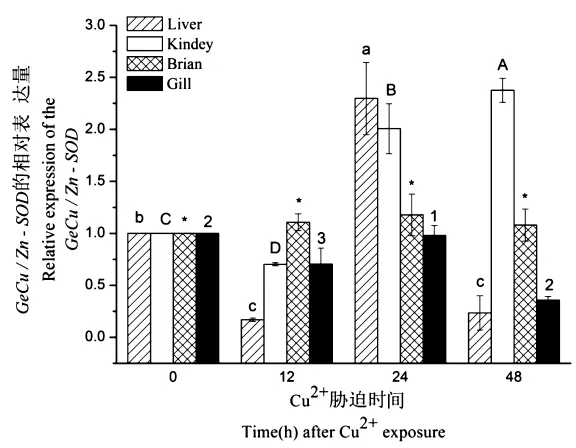
图5 GeCu/Zn-SOD基因在花斑裸鲤肝、肾、脑和鳃组织中的表达分析图Figure 5 Expression analysis of GeCu/Zn-SOD in liver,kidney,brain and gill tissues of G.eckloni
3 讨论
序列特征分析表明,GeCu/Zn-SOD氨基酸序列同鲤鱼、鲫鱼和斑马鱼的Cu/Zn-SOD氨基酸序列高度相似。GeCu/Zn-SOD与其他物种Cu/Zn-SOD氨基酸序列同源性比对结果显示:花斑裸鲤同硬骨鱼的同源性都较高,其中花斑裸鲤与鲤鱼的同源性高达94%,表明了Cu/Zn-SOD在进化上的高度保守性。
在Cu2+胁迫下,花斑裸鲤的肝、肾、脑、鳃组织中GeCu/Zn-SOD在mRNA水平相对表达量呈现出一定的规律性。GeCu/Zn-SOD在不同的组织中有着不同的表达模式,基本上是在胁迫后24 h或48 h达到最高值(P<0.05)。这与以往研究结果基本一致[7,8,9-10]。主要原因可能是,Cu2+的胁迫产生了大量的活性氧簇(Reactive Oxygen Species,ROS),ROS作为一种信号分子激活了Kelch样环氧氯丙烷相关蛋白 1(Kelch-like ECH associatedprotein 1,Keap1)-核因子E2相关因子2(NF-E2 p45-related factor 2,Nrf2)-抗氧化反应元件(Antioxidant Response Element,ARE)信号通路,Keap1-Nrf2-ARE 信号通路的激活又促使 Nrf2激活,促进下游靶基因Cu/Zn-SOD等的表达,提高机体抗氧化能力[11]。因此,在Cu2+胁迫下,花斑裸鲤Cu/Zn-SOD在mRNA水平上会产生氧化应激应答。
综上所述,氧化应激是一个涉及多条信号通路及相关基因和蛋白的复杂的毒理过程,是多条通路共同作用的结果[12]。花斑裸鲤在Cu2+胁迫下SOD在不同组织应答模式的调控机理还需要进一步研究。本研究成功实现高原花斑裸鲤Cu/Zn-SOD的克隆鉴定表达,初步得到了花斑裸鲤Cu/Zn-SOD对Cu2+胁迫的应答模式,有助于揭示Cu/Zn-SOD的抗氧化生理机制以及污染水体生物标记物的筛选,为天然水域环境质量评价提供敏感、快速、易于掌握的评价手段。
