CD4+CD25+CD127lowTreg细胞中Foxp3的表达及CD4+CD25+CD127low/Foxp3 Treg细胞在感染泡球蚴小鼠中的作用机制※
2018-12-14廖梦姣侯立朝王志鑫王东旭庞明泉王海久樊海宁
廖梦姣,侯立朝,王志鑫,汤 锋,王东旭,任 利,庞明泉,王海久,樊海宁*
(1.青海大学附属医院肝胆外科,青海 西宁 810001;2.青海大学高原医学研究中心,青海 西宁 810001;3.青海省包虫病重点实验室,青海 西宁 810001)
Treg细胞参与维持机体的免疫平衡,具有免疫负向调控作用[1-3],Foxp3是Treg细胞的标记物,但Foxp3是细胞核蛋白,限定了Treg细胞的分离,也阻碍了对Treg细胞功能的进一步研究[4],在胃肠道疾病中发现CD127也是Treg细胞的表面标记物,其CD127在CD4+的细胞中呈高表达(CD4+CD127high)。但在CD4+CD25high的细胞中CD127呈低表达(即CD4+CD25+CD127low),在CD4+CD25highCD127lowTreg细胞中检测到大于90%的细胞表达Foxp3,并且CD4+CD25+CD127lowTreg细胞能抑制T细胞的增值和功能[5],相关文献报道过Treg细胞在泡型包虫病中发挥作用[6]。但在泡型包虫病中CD4+CD25+CD127lowTreg细胞是否表达Foxp3,及其在泡型包虫病的发展过程中存在何种意义,是否和CD4+CD25+Foxp3 Treg细胞一样在泡球蚴感染中发挥免疫抑制作用,现有文献未做阐述。本研究拟探讨CD4+CD25+CD127lowTreg细胞中Foxp3的表达及CD4+CD25+CD127low/Foxp3 Treg在泡球蚴感染中的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
SPF级BALB/c雄性小鼠18只,体重(20±2)g,购于南京市江宁区青龙山动物繁殖场[许可证号:SCXK(苏)2017-0001,NO.201722769],随机分成泡型包虫病组、健康对照组。
1.1.2 实验试剂、仪器
小鼠IFN-γ、IL-10、TGF-β1 ELISA试剂盒(Abcam公司)。抗体FITC Rat Anti-mouseCD4、PE Rat Anti-mouseCD25、APC Rat Anti-mouse CD127、BV421 Rat Anti-mouse Foxp3,同型对照FITCRat IgG2a、PE Rat IgG1、APC Rat IgG2b、BV421 Rat IgG2b,破膜液FIX/PERM(BD Biosciences公司)。小鼠淋巴细胞分离液(CEDARLANE公司)。青霉素-链霉素混合液(Gibco公司)。
5810R型离心机(Eppendorf公司)。
1.2 方法
1.2.1 泡型包虫病小鼠动物模型的建立
从感染泡球蚴的沙鼠腹腔中,在无菌条件下采集含泡球蚴的囊块,在生理盐水(含0.8×103U/mL青霉素和1mg/mL链霉素)中剪碎后,用300 μm的滤网过滤,收集下方的滤液,再用40 μm的滤网过滤,收集滤网上的泡球蚴,用生理盐水(含0.8×103U/mL青霉素和1mg/mL链霉素)清洗数次,泡球蚴的成活率占95%以上(镜下观察)。
泡型包虫病组(9只):小鼠腹腔注射泡球蚴(生理盐水将原头蚴配成20%的浓度)200 μL。
健康对照组(9只):小鼠腹腔注射生理盐水200 μL。
1.2.2 CD4+CD25+CD127lowTreg、CD4+CD25+Foxp3 Treg细胞的检测
动物模型建立3个月后,分别取泡型包虫病组与健康对照组脾脏研磨,提取淋巴细胞,制成细胞悬液,将100 μL细胞悬液加入流式管,再加入FITC Rat Anti-mouse CD4 4 μL、PE Rat Anti-mouse CD25 10 μL、APC Rat Anti-mouse CD127 5 μL避光孵育20 min,同型对照加FITC Rat IgG2a 5 μL、PE Rat IgG1 5 μL、APCRat IgG2b 5 μL避光孵育20 min,加入破膜液FIX/PERM 500 μL 避光孵育30 min,离心(400g)5 min,弃上清液,加入1×Wash buffer 1 mL清洗,再次离心(400g)5 min,弃上清液,加入胞内抗体BV421 Rat Anti-mouse Foxp3 5 μL,同型对照加BV421 Rat IgG2b 5 μL避光孵育30 min,离心(400g)5 min,弃上清液,加入1×Wash buffer 500 μL上流式细胞仪检测CD4+CD25+CD127lowTreg、CD4+CD25+Foxp3 Treg及CD4+CD25+CD127lowTreg细胞中Foxp3的含量。
1.2.3 细胞因子的检测
眼球采血收集小鼠血液,静置4 h,离心(2500g)20 min,收集血清,用ELISA法测定泡型包虫病组、健康对照组血清IFN-γ、IL-10、TGF-β1水平。
1.2.4 统计学分析
采用SPSS19.0软件进行统计学分析,结果以均数±标准差表示,组间均数比较采用独立样本t检验,检验水准α=0.05。
2 结果
2.1 泡型包虫病组病灶大小
将泡型包虫病组小鼠处死,取出病灶测量大小,为(1.05±0.58)g。
2.2 健康对照组与泡型包虫病组CD4+CD25+CD127low Treg、CD4+CD25+Foxp3 Treg细胞的含量
将小鼠脾脏研磨提取淋巴细胞后加入抗体上流式细胞仪检测,健康对照组CD4+CD25+CD127lowTreg细胞为9.04±2.78,泡型包虫病组为14.91±4.21(P<0.004 V.S.健康对照组),健康对照组CD4+CD25+Foxp3Treg细胞为0.76±0.73,泡型包虫病组为4.21±2.08(P<0.000V.S.健康对照组)(表1,图1)。
表1健康对照组与泡型包虫病组中CD4+CD25+CD127lowTreg、CD4+CD25+Foxp3Treg细胞的含量

Table 1 The content of CD4+CD25+CD127low Treg and CD4+CD25+Foxp3 Treg in the control group andalveolar echinocococosis group
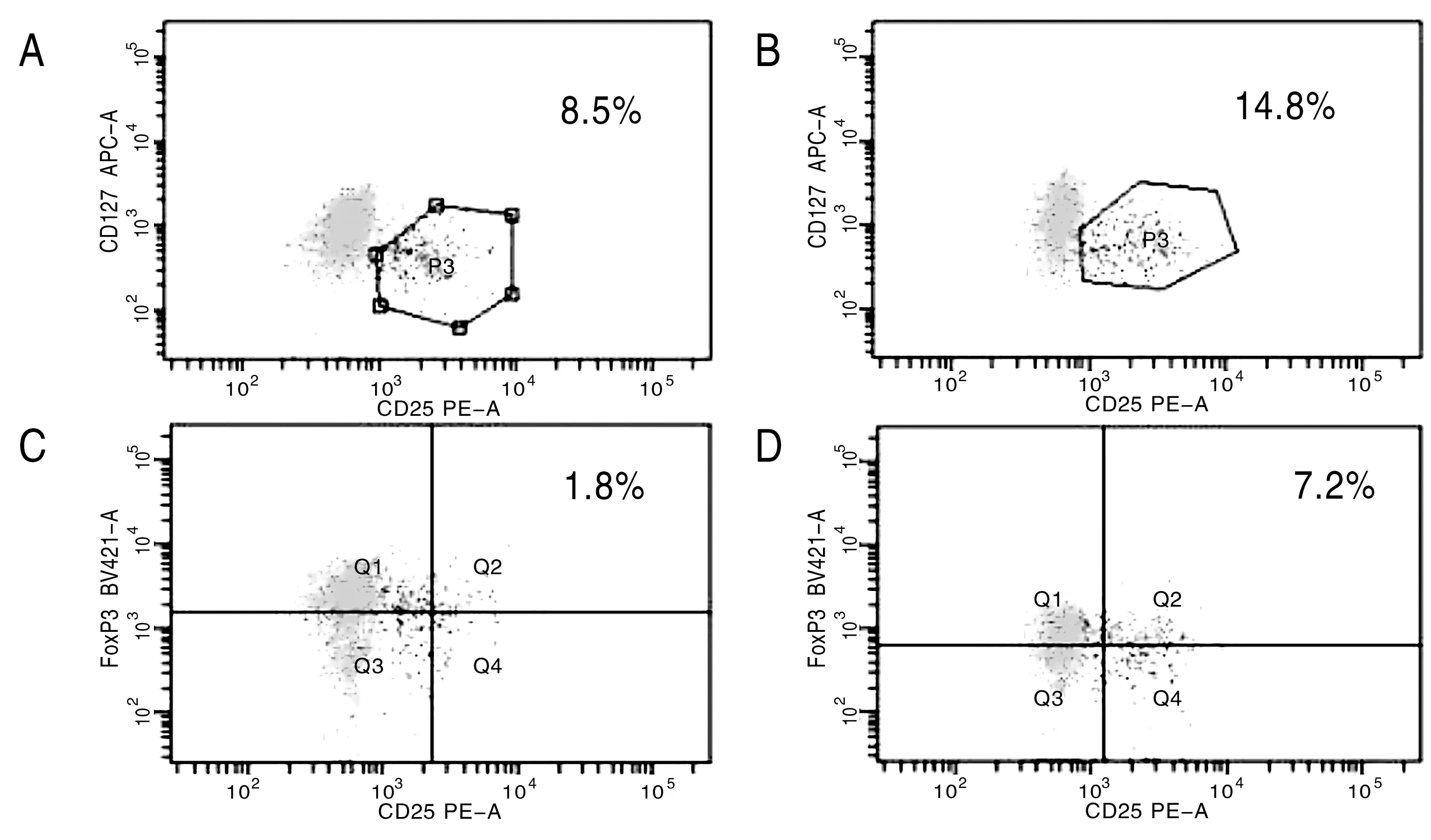
A为健康对照组,B为泡型包虫病组,C为健康对照组,D为泡型包虫病组
图1健康对照组与泡型包虫病组中CD4+CD25+CD127lowTreg、CD4+CD25+Foxp3Treg细胞含量图
Figure1ThecontentofCD4+CD25+CD127lowTregandCD4+CD25+Foxp3Tregincontrolgroupandalveolarechinocococosisgroup
2.3 CD4+CD25+CD127low Treg细胞中Foxp3的表达量
健康对照组与泡型包虫病组脾淋巴细胞在P3门下检测CD4+CD25+CD127lowTreg细胞中Foxp3的含量(图1),健康对照组中CD4+CD25+CD127lowTreg细胞中Foxp3的含量为70.7%,泡型包虫病组为67.7%,泡型包虫病组与健康对照组中CD4+CD25+CD127lowTreg高表达Foxp3(图2)。
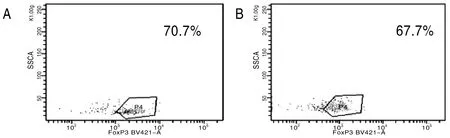
A:健康对照组 B:实验组
图2健康对照组与泡型包虫病组中CD4+CD25+CD127lowTreg细胞中Foxp3的含量图
Figure2Foxp3contentinCD4+CD25+CD127lowTregsincontrolgroupandalveolarechinocococosisgroup
2.4 泡型包虫病组CD4+CD25+CD127low Treg细胞与病灶大小的相关性
泡型包虫病组中脾淋巴细胞CD4+CD25+CD127lowTreg的含量与病灶大小进行Pearson相关性分析,两指标呈正相关,r=0.894,P=0.01(图3)。
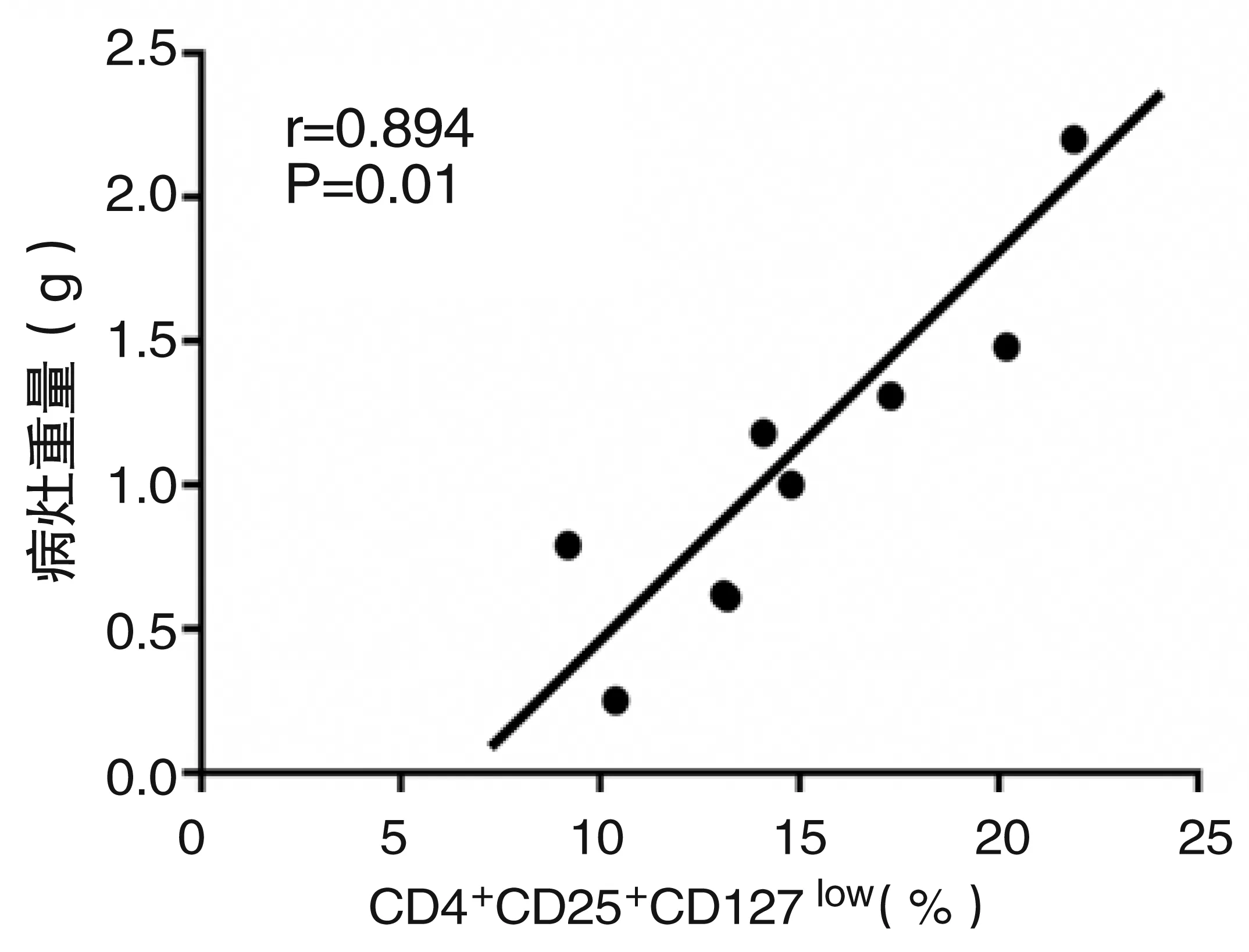
图3实验组CD4+CD25+CD127lowTreg细胞与病灶大小相关性分析图
Figure3CorrelationAnalysisbetweencontentofCD4+CD25+CD127lowTregandsizeoflesioninalveolarechinocococosisgroup
2.5 泡型包虫病组CD4+CD25+Foxp3 Treg细胞与病灶大小的相关性
泡型包虫病组中脾淋巴细胞CD4+CD25+Foxp3 Treg细胞的含量与病灶大小进行Pearson相关性分析,两指标呈正相关,r=0.714,P=0.031(图4)。
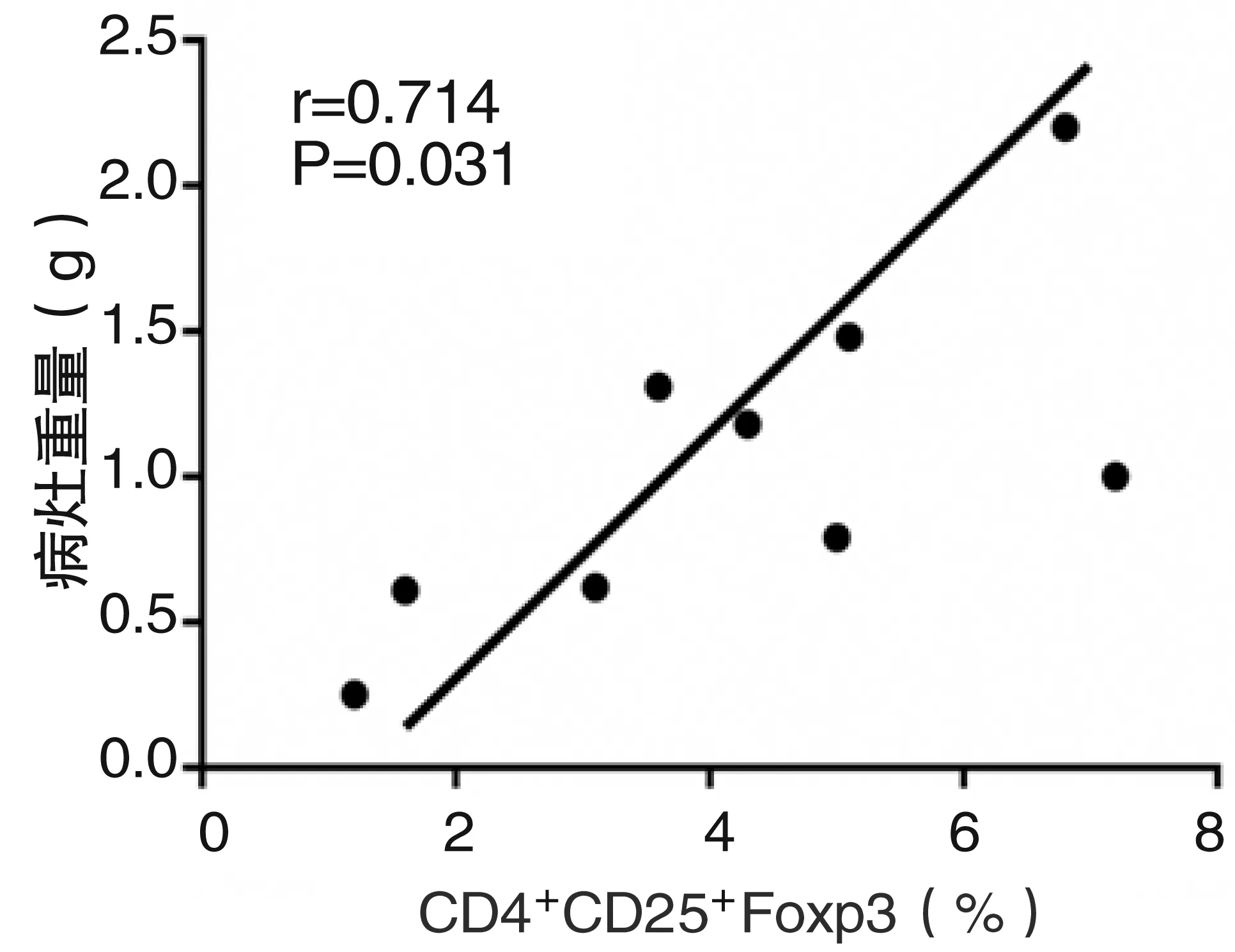
图4实验组CD4+CD25+Foxp3Treg细胞含量与病灶大小相关性分析图
Figure4CorrelationanalysisbetweencontentofCD4+CD25+Foxp3TregandsizeoflesioninalveolarechinocococosisGroup
2.6 健康对照组与泡型包虫病组血清IFN-γ、IL-10、TGF-β1的表达水平
健康对照组与泡型包虫病组小鼠分别进行眼球采血,离心(2500g,20min)取血清行ELISA检测,健康对照组IFN-γ为8.39±0.82,泡型包虫病组为560.95±123.71(P<0.000V.S.健康对照组)。健康对照组IL-10为 538.52±55.82,泡型包虫病组为1946.80±260.89(P<0.000V.S.健康对照组)。健康对照组TGF-β1为 223.90±56.34,泡型包虫病组为 321.35±36.44(P<0.001V.S.健康对照组)(表2)。
表2泡型包虫病组与健康对照组血清中IFN-γ、IL-10、TGF-β1的表达水平
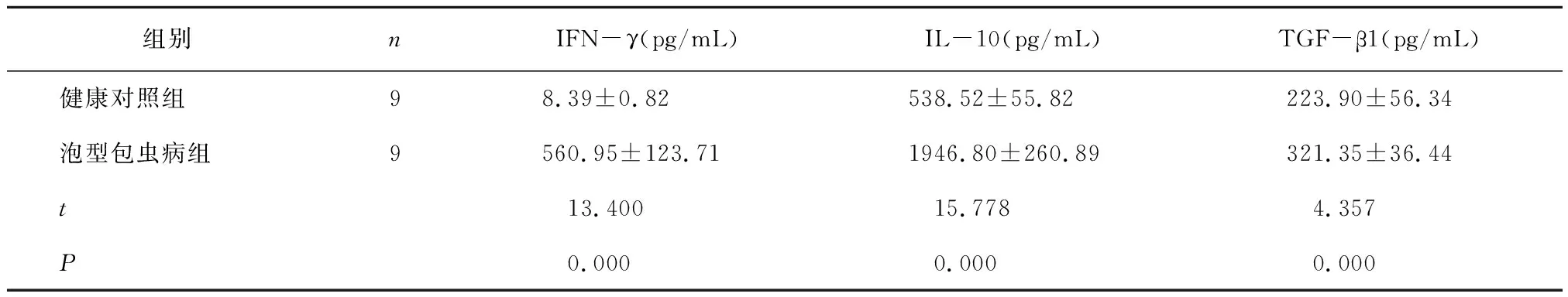
Table 2 The levels of IFN-γ、IL-10、TGF-β1 in serum in alveolar echinocococosis group and control group
3 讨论
本研究通过采用泡球蚴感染小鼠的动物模型观察CD4+CD25+CD127lowTreg细胞对Foxp3的表达及CD4+CD25+CD127low/Foxp3 Treg在感染泡球蚴小鼠中作用机制,结果发现泡球蚴感染的小鼠刺激CD4+CD25+CD127low/Foxp3 Treg细胞增殖,CD4+CD25+CD127lowTreg细胞高表达Foxp3,CD4+CD25+CD127low/Foxp3 Treg细胞能促进泡型包虫病的发展。
近几年对Treg细胞的鉴别及特异性标记物一直都有争议,活化标记物CD25不仅仅表达在Treg细胞上,也表达在活化的T细胞上。因此,不能通过CD25从活化的T细胞中区分出Treg细胞,CD25和Treg细胞的其他标记物如GITR、CTLA-4和CD45RB并不是在所有活化的CD4+细胞上都有表达[7-8],近几年Foxp3作为Treg的标记物。但其是核内蛋白,限定了Treg细胞的体外分离及其进一步的功能研究,在胃肠道疾病中研究发现,通过表面标记物CD127联合CD4+CD25+分离的CD4+CD25+CD127lowTreg细胞高表达Foxp3。并具有免疫抑制作用,其可作为Treg细胞的表面标记物[9]。本研究以小鼠动物模型为载体,观察CD4+CD25+CD127lowTreg对Foxp3的表达,结果显示,不管是健康小鼠还是泡型包虫病小鼠CD4+CD25+CD127lowTreg细胞都高表达Foxp3,证实CD4+CD25+CD127lowTreg细胞在泡型包虫病中也可作为Treg细胞的表面标记物。
Treg细胞可通过细胞间的接触和分泌细胞因子发挥免疫调节作用,通过与效应性T细胞(Teff)的表面配体细胞毒性T细胞相关抗原4(CTLA-4)、可诱导共刺激因子(ICOS)和程序性死亡分子1(PD-1)结合,抑制Teff的功能[10],从而降低机体的免疫功能。Treg细胞还可分泌TGF-β1、IL-10来发挥免疫抑制作用,TGF-β1抑制细胞毒性T淋巴细胞(CTL)和Th1、Th2细胞的分化,同时促进外周Treg、Th17、Th9、Tfh细胞产生[11]。而白细胞介素(IL)-10是抑制抗原呈递和促炎细胞因子释放的调节性细胞因子[12],我们实验显示泡球蚴感染的小鼠刺激CD4+CD25+CD127low/Foxp3 Treg细胞增殖,同时显示Treg细胞分泌的细胞因子(IFN-γ、IL-10和TGF-β1)显著升高、CD4+CD25+CD127low/Foxp3 Treg细胞含量与病灶的大小呈正相关。
综上所述,我们可以初步推测:泡型包虫病小鼠CD4+CD25+CD127lowTreg细胞高表达Foxp3,在泡型包虫病中可作为Treg细胞的表面标记物;CD4+CD25+CD127low/Foxp3 Treg细胞能促进泡型包虫病的发展,同时初步揭示CD4+CD25+CD127low/Foxp3 Treg细胞在泡型包虫病的作用机制可能与抑制机体的免疫功能有关。
本实验的样本量少,并且机体免疫包括非特异性免疫和特异性免疫,它们之间并非孤立存在,而是存在密切的联系。因此,对于泡型包虫病的发病机制的研究,需要大量的、更深入的研究去阐明。
