sFRP2和Wnt/β-catenin通路在结直肠癌发生发展中的作用
2018-12-14史友权崇杨汤东熊清泉黄玉琴周怀成张琪金芝祥5王道荣
史友权 崇杨 汤东 熊清泉,4 黄玉琴,5 周怀成 张琪 金芝祥,5王道荣
近年来结直肠癌发病率愈来愈高,在全球肿瘤中发病率位于第三位,致死率位于第二位[1]。有研究认为 sFRP2(Secreted Frizzled-related proteins 2)表达减少或消失,导致与Wnt蛋白竞争性结合减少,Wnt/β-catenin通路被激活,β-catenin异常表达从而促进结直肠癌的发生发展[2-3]。目前关于sFRP2对结直肠癌细胞株HCT116细胞的增殖、迁移、侵袭等研究鲜见相关报道。我们检测了正常结直肠黏膜组织和结直肠癌组织中sFRP2和β-catenin的表达,以及在结直肠癌细胞株HCT116转染上调sFRP2后,对比转染前后细胞增殖、迁移和侵袭方面的变化,以探讨sFRP2和Wnt/β-catenin通路在结直肠癌发生发展中的作用。
材料与方法
一、材料
1.细胞和组织:结直肠癌细胞株HCT116来源于江苏省苏北人民医院实验中心。谷歌生物科技有限公司帮助构建包含sFRP2蛋白全长的pcDNA3.1质粒。结直肠组织标本来源于江苏省苏北人民医院2015~2017年手术切除或内镜活检确诊的标本,正常结直肠黏膜标本32例(非结直肠癌患者),结直肠癌标本32例,共64例,所有结直肠癌患者术前均未行放化疗,临床病理特征详见表1。
2.主要试剂:兔抗人sFRP2多克隆抗体(Abcam)、兔抗人β-catenin抗体(Santa Cruz)、免疫组化试剂盒(凯基生物)、胰蛋白酶(凯基生物)、Western Blot试剂盒(凯基生物)、CCK-8试剂盒(Dojindo)、胎牛血清(杭州四季青)、DMEM培养基(Hyclone)、脂质体Lipofectamine TM3000(Invitrogen)、Transwell小室(Corning Corstart)和Matrigel基质胶(BD)。
二、实验方法
1.免疫组化(SP):选取上述结直肠组织标本,经福尔马林固定,脱水,石蜡包埋后切片。依次使用二甲苯常规脱蜡、酒精梯度复水和抗原修复后,根据免疫组化试剂盒说明书进行后续实验。每批均设置阴性和阳性对照,阴性对照:PBS替代一抗,阳性对照:已确定的sFRP2、β-catenin表达阳性的结直肠组织。
我们根据以下标准判定sFRP2和β-catenin的染色情况:(1)sFRP2染色结果根据染色强弱和细胞阳性表达率进行综合评分。1)染色强弱:0分(无染色),1分(淡黄色),2分(棕黄色),3分(棕褐色)。2)细胞的阳性表达率:0分(≤25%),1分(26%至50%),2分(51%至75%),3分(大于76%)。综合两者进行评分,依据评分判定结果,阳性(+):两项评分之和大于3;阴性(-):两项评分之和小于等于3分。(2)β-catenin:细胞出现黄色或棕黄色颗粒为阳性表达。膜正常表达:细胞膜染色程度大于70%;膜表达缺失:小于等于70%;胞浆或胞核阳性表达:胞浆或胞核阳性率在同类细胞中比例大于10%,两者都称为异位表达。异位表达和膜表达缺失统称异常表达[4]。
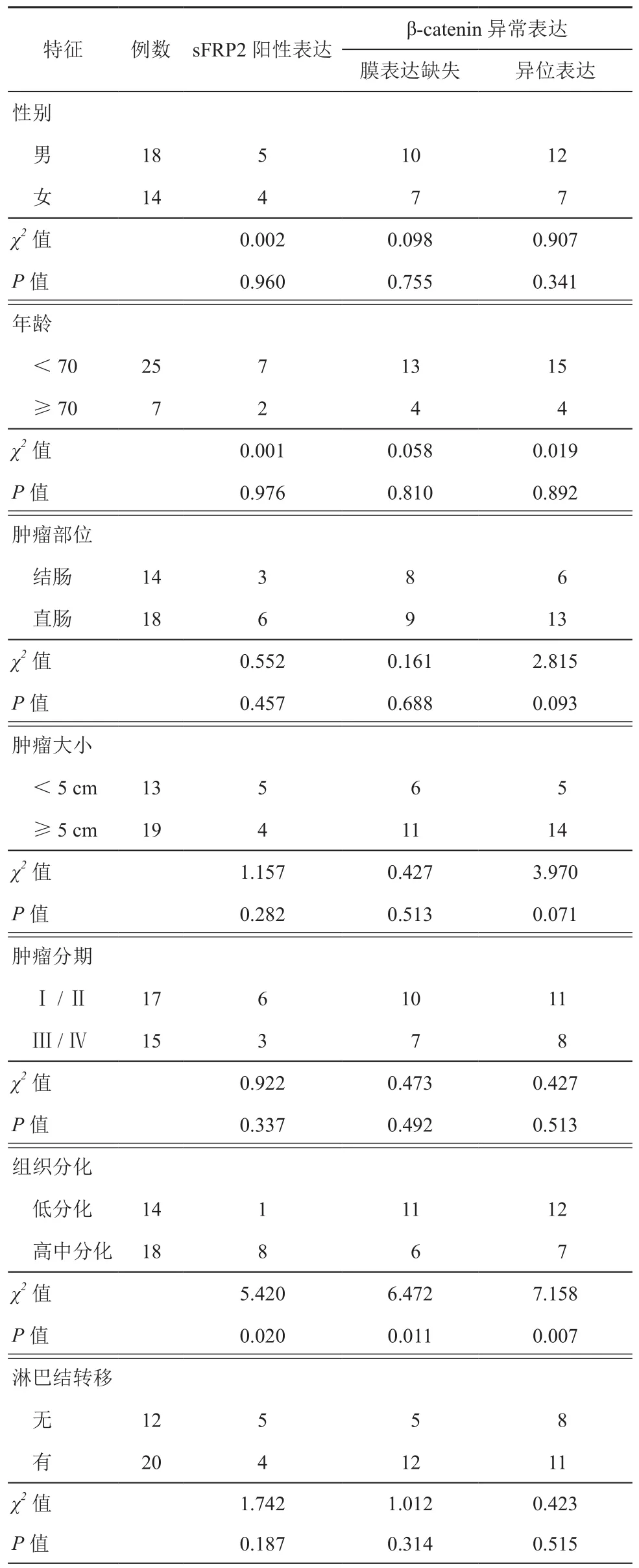
表1 sFRP2和β-catenin与结直肠癌临床特点的关系(例)
2.细胞培养及转染方法:培养条件为含10%胎牛血清的DMEM培养基+培养箱(37℃和5%CO2)。使用LipofectamineTM3000转染试剂在细胞对数生长期转染pcDNA3.1质粒。实验分为3组:(1)对照组:未转染。(2)空载质粒组:转染空白质粒。(3)sFRP2转染组。转染过程依据转染试剂说明书进行。
3.Western blot:细胞经过处理后,加入RIPA裂解缓冲液。首先使用SDS/PAGE凝胶电泳分离蛋白质样品,将其转移到PVDF膜上,配备5%脱脂奶粉封闭液,将PVDF膜上浸泡1 h,依次与兔抗人sFRP2多克隆抗体(1:1000)和兔二抗(1:1000)反应,后进行曝光显影。
4.CCK-8实验:将1.0×104个细胞接种于96孔板,根据CCK-8试剂盒产品说明书进行细胞计数。简而言之,向每个孔中加入10 μL CCK-8溶液,并将它们孵育1 h,然后在450 nm下测量吸光度,实验重复3次。
5.划痕实验:将HCT116细胞接种于6孔板中,融合至80%~90%时,在孔板中心轴处用枪头沿直线轻轻划痕,然后用PBS除去细胞碎片。无血清培养基培养,在0 h、48 h进行观察拍照。测量划痕间的距离,实验重复3次。
6.Transwell实验:Transwell小室底部膜由Matrigel基质胶包被(滤膜孔径为8 μm)。上室:无血清DMEM培养基(含细胞),下室:10%胎牛血清DMEM培养基,孵育24 h。除去上室细胞后,用多聚甲醛中固定15 min,染色20 min。随机选取5个视野(100倍)进行细胞计数,取其平均值。
三、统计学分析
应用SPSS 21.0统计软件。t检验应用于计量资料,χ2检验或Fisher精准检验应用于计数资料,Spearman分析用于检验相关性。组间比较选用独立样本t检验或单因素方差分析。P<0.05为差异有统计学意义。
结 果
一、免疫组化
1.sFRP2和β-catenin在结直肠组织中的表达:我们分别对正常结直肠黏膜组织和癌组织两组进行了免疫组化检测,正常结直肠黏膜组织中sFRP2主要在细胞质里表达(图1A),β-catenin主要在细胞膜上表达(图1C)。结直肠癌组织中sFRP2低表达或不表达(图1B)。而β-catenin异常表达增加(图1D)。两组在sFRP2的阳性率、β-catenin膜表达缺失率及异位表达率等方面表达差异具有统计学意义(P<0.01),正常黏膜组织中sFRP2的阳性率显著高于结直肠癌组,结直肠癌组中β-catenin膜表达缺失率和异位表达率癌显著高于正常结直肠黏膜组。详见表2。
2.sFRP2和β-catenin与结直肠癌临床特点的关系:如表1所示,sFRP2阳性表达、β-catenin膜表达缺失、异位表达与肿瘤组织分化存在明显差异(χ2=5.420,P=0.020;χ2=6.472,P=0.011;χ2=7.158,P=0.007),而与性别、年龄、肿瘤部位、肿瘤大小、肿瘤分期和淋巴结转移无关(P>0.05)。
3. 相关性分析:通过Spearman分析,我们研究发现sFRP2表达分别与β-catenin膜表达缺失(r=-0.39,P=0.03)及β-catenin异位表达(r=-0.47,P=0.01)负相关,β-catenin异位表达与β-catenin膜表达缺失正相关(r=0.50,P=0.004),且相关性均显著。详见表3。
二、Western blot检测
Western blot结果验证了转染后sFRP2的表达水平显著高于转染前(t=25.430,P=0.001),β-catenin表 达 水 平 亦 较 前 提 高(t=15.000,P=0.001),β-actin作为内参。如图2所示。
三、CCK-8实验
通过CCK-8方法检测发现,sFRP2转染组分别与对照组和空载质粒组比较[12 h:(t=0.016,P=0.988)和(t=0.041,P=0.970),24 h:(t=0.155,P=0.884)和(t=0.452,P=0.675),36 h:(t=0.695,P=0.525)和(t=1.173,P=0.306),48 h:(t=1.254,P=0.278)和(t=1.693,P=0.166),60 h:(t=3.440,P=0.026)和(t=3.576,P=0.023)],细胞增殖速度明显减慢(图3),说明sFRP2抑制了结直肠癌细胞HCT116的增殖。
四、划痕实验
通过比较sFRP2转染组、空载质粒组和对照组三组HCT116细胞划痕两侧直线间的距离,来判断sFRP2对HCT116细胞迁移能力的影响。结果发现:sFRP2转染组划痕两侧距离与空白组、空载质粒组比较,迁移速度明显较慢[(t=16.890,P=0.001)和(t=7.206,P=0.002)],表明sFRP2抑制了癌细胞的迁移。如图4所示。
五、Transwell实验
通过Transwell实验我们发现,对照组透膜(195.39±8.68)个,sFRP2转染组透膜(75.69±7.19)个,对照组透膜细胞数明显多于sFRP2转染组(t=25.459,P=0.001),如图5所示。
讨 论

图1 sFRP2和β-catenin在结直肠组织中的的表达。1A:正常结肠组织(sFRP2);1B:结直肠癌组(sFRP2);1C:正常结肠组织(β-catenin);1D:结直肠癌组(β-catenin)(免疫组化SP法×400)
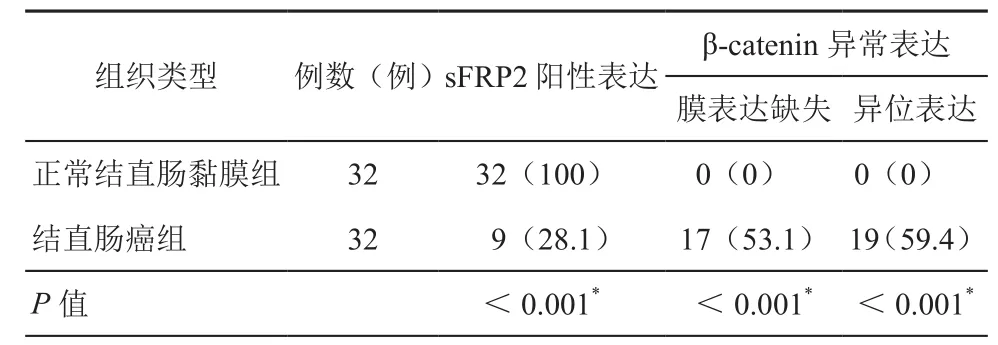
表2 sFRP2及β-catenin在两组中的表达情况[例(%)]
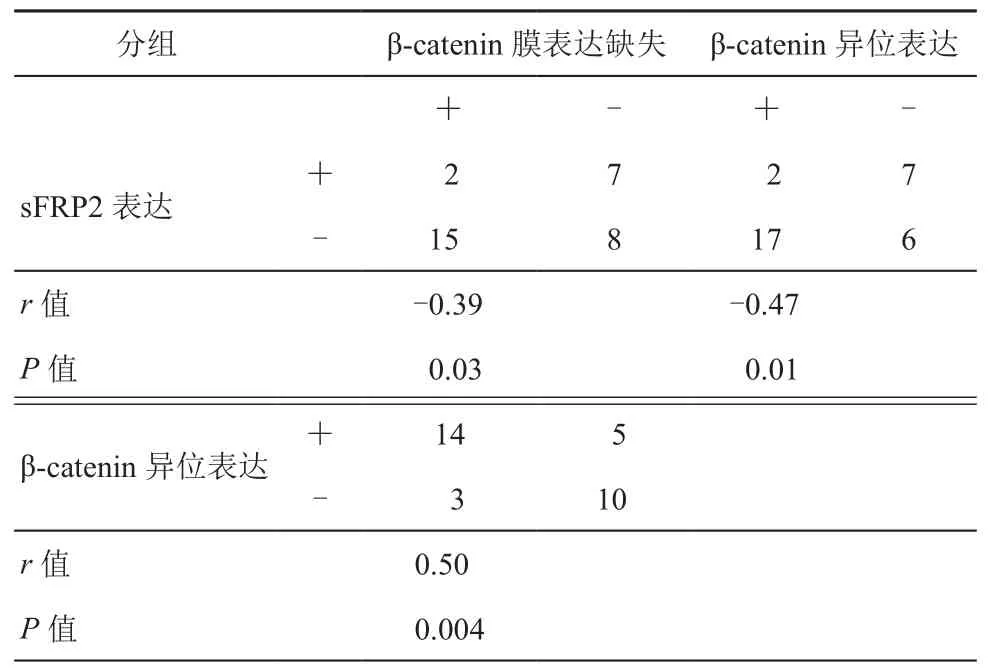
表3 结直肠癌中sFRP2和β-catenin表达的相关性(例)
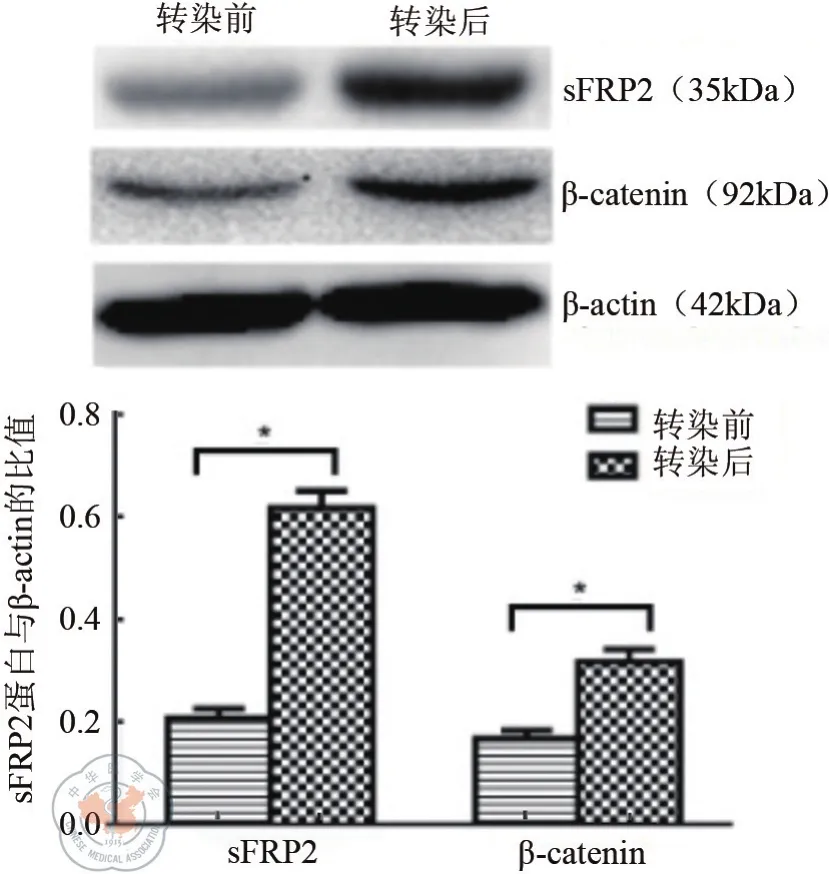
图2 转染前后HCT116细胞中sFRP2、β-catenin的表达(sFRP2及β-catenin转染前后相比*P<0.05)
sFRP2是sFRP家族7个成员之一,结构上与卷曲蛋白相似,均含有半胱氨酸富集区(cysteine rich domain,CRD)。一方面,sFRP2通过CRD与Frizzed竞争结合到Wnt蛋白上抑制Wnt通路;另一方面,sFRP2与Frizzed结合生成无功能的复合物,封闭Wnt信号通路[5],从而抑制肿瘤的发生。当sFRP2表达减少时,与Wnt蛋白竞争性结合减少,不能阻断或封闭Wnt通路,导致Wnt通路激活,便起到了促癌的作用[6-7]。我们研究发现sFRP2在正常结直肠黏膜组中的阳性表达率(100%)显著大于结直肠癌组(28.1%),差异具有统计学意义(P<0.05),这与刘宁等[8]研究结果相一致。有研究报道结直肠癌中sFRP2甲基化,可导致sFRP2表达水平下降或沉默[9-11]。

图3 sFRP2对结直肠癌HCT116细胞生长曲线的影响(sFRP2转染组与对照组相比*P<0.05)

图4 sFRP2对结直肠癌细胞HCT116细胞迁移能力的影响(sFRP2转染组与对照组相比*P<0.05)
Wnt是分泌型、脂质修饰的糖蛋白,其在胚胎发育过程中具有许多关键作用,并促进成年人的组织平衡。它们可以调节细胞的分化、增殖、迁移、存活和干细胞自我更新[12-14]。异常Wnt信号与许多疾病相关,特别是癌症[15]。Wnt/β-catenin通路是目前结直肠癌发生进展机制研究的热点[16],当Wnt通路激活时,β-catenin不被降解,进入细胞核并积聚,β-catenin出现膜表达缺失和异位表达,与转录因子相互作用,启动转录,调控基因表达,从而促进肿瘤的发生和发展[17]。我们研究发现:β-catenin膜表达缺失率在结直肠癌组(53.7%)显著大于正常结直肠黏膜(0%),β-catenin异位表达率在结直肠癌组(61.1%)显著大于正常结直肠黏膜(0%),且差异具有统计学意义(P<0.05)。这与相关研究[8]结果相一致。

图5 sFRP2对结直肠癌细胞HCT116细胞侵袭能力的影响(sFRP2转染组与对照组相比*P<0.05)
本研究发现sFRP2的表达和β-catenin异常表达均与组织分化明显相关(P<0.05),而与性别、年龄、肿瘤部位、肿瘤大小、肿瘤分期及淋巴结转移无关(P>0.05),这与相关研究[8,18-19]结果相一致。我们通过检测发现,发现sFRP2的阳性率与β-catenin的膜表达缺失率及异位表达率均呈负相关,β-catenin的膜表达缺失率和异位表达率呈正相关,与刘宁等[8]和潘世杰[20]相关研究报道一致。主要因为sFRP2的表达减少,导致Wnt通路激活,从而引起β-catenin表达的变化。
目前,在结直肠癌细胞株HCT116中转染上调sFRP2后研究其对细胞的增殖、迁移和侵袭的研究尚缺乏。我们研究发现sFRP2上调后细胞增殖速度显著减慢,抑制HCT116细胞的增殖。肖灿[21]通过质粒转染上调人舌鳞癌细胞系Tca8113细胞中sFRP2的表达,发现sFRP2的过表达显著抑制了细胞的增殖。sFRP2表达水平下降导致Wnt/β-catenin通路的激活,进而β-catenin进入胞浆和胞核并积累,与CyclinD1启动子中的LEF-1位点相互作用,激活转录过程,细胞周期蛋白依赖性激酶(CDKs)被激活后,诱导磷酸化,促进基因转录,促使细胞完成由G1期到S期的转换,并进入增殖期[22-23]。所以sFRP2表达水平升高阻断或封闭Wnt/β-catenin通路,则抑制了细胞的增殖[24]。通过划痕实验,我们发现sFRP2抑制了细胞的迁移能力。通过Transwell实验我们发现sFRP2转染组透膜细胞数明显小于对照组透膜细胞数,说明sFRP2抑制HCT116细胞的侵袭能力。但是我们的实验细胞比较单一,仅一种结直肠癌细胞,仍需要进一步在其他结直肠癌细胞中进行验证。
综上所述,sFRP2是一种抑癌基因,通过调控Wnt/β-catenin通路而发挥其作用。sFRP2结直肠癌细胞株HCT116中转染上调后,明显抑制了结直肠癌细胞的增殖、迁移和侵袭。希望本研究能为结直肠癌的治疗提供新的靶点和思路。
