固相萃取-反相高效液相色谱测定食品中大豆异黄酮含量的方法研究
2018-12-07马翛然张洛莎郑晨曦高丽华
马翛然,张洛莎,王 鹏,郑晨曦,高丽华,刘 婷*
(1.北京食品科学研究院,北京 100068;2.北京工业大学 生命科学与生物工程学院,北京 100124)
中国的传统大豆食品一般可分为非发酵的和发酵的两大类。非发酵的有整豆(如毛豆、青豆、干豆、黑豆等)、豆芽、豆浆、豆腐、干豆腐和油豆腐等;发酵的有酱油、豆豉、豆酱、腐乳和酸豆奶等,均各成一类,拥有很多花色品种。鉴于大豆显著的营养价值和功能性质,大豆食品被有关营养与食品专家认定为21世纪全球最受欢迎的健康食品之一[1]。
大豆不仅含有优质蛋白质和植物油,还含有对人体健康有益并具有各种生理功能的一类天然活性物质—大豆异黄酮[2],其化学结构见图1。大豆异黄酮是黄酮类化合物,是大豆生长中形成的一类次级代谢产物,与雌激素有相似的分子结构,同时也是一种植物多酚。其分子基本结构为2-苯基色原酮,泛指两个苯环通过三碳链相互连结而形成一系列化合物。其名称及取代基见表1。大豆异黄酮具有雌激素活性[2-4]、降低胆固醇[2-4]、预防心血管疾病[2-4]、抑制肿瘤生长[2-4]、抗氧化性[5]、预防和治疗骨质疏松[6-7]和缓解妇女更年期综合症[8-9]等特定的生理作用以及保健功能[10-15],受到人们广泛的关注及重视。

图1 8种异黄酮的化学结构Fig.1 Chemical structure of 8 isoflavones

表1 8种异黄酮的名称及取代基Table 1 Names and substituent groups of 8 isoflavones
目前,我国大豆制品生产仍存在生产集中度较低、小作坊多、技术水平低、设备陈旧简陋、产品功能性差、资源利用率低和生产管理难以标准化等诸多影响产品质量的瓶颈问题,而且我国现行的大豆异黄酮含量测定的国家标准[16-17]适用范围小,专属性不强,已不适合当前市场上品种繁多的大豆食品中异黄酮的含量分析。因此,迫切需要建立新的大豆异黄酮分析方法以完善现行的国家标准,为有效控制产品的质量提供理论依据。这不仅对企业生产中的质量控制有利,也有利于大豆食品的市场监管,在国家大豆食品安全体系的建设中占有重要的地位。
高效液相色谱法(high performance liquid chromatography,HPLC)是目前应用最广泛的一种检测方法,相较其他分析方法,具有准确度高、灵敏度高、选择性和重现性好的优点。文献报道[7-13,16-25]的HPLC法测定大豆异黄酮的含量所使用的提取方法、色谱分离方法以及仪器条件等均有不同,所涉及的样品种类不同,主要有大豆[10-12,21,27-29,31]、黑豆[29]和红豆[29]、酱油[13]、豆豉[14]、腐乳[15]、葛根[18]和三叶草[19]、膳食补充剂[20]、豆酱[21]、生物样品人体尿液[22-23]和血清[24]、豆浆[25]等,这导致异黄酮提取效率、检测结果和方法的适用范围各异。本研究以测定大豆食品中异黄酮含量为主要内容,在国家标准的基础上尝试优化黄豆黄素、黄豆黄苷、大豆苷、大豆苷元、染料木素、染料木苷、鸢尾黄酮苷、鹰嘴豆芽素A共8种异黄酮的提取方法,拟建立了一种适用范围广,而且能同时测定8种异黄酮成分的高效液相色谱法,对控质大豆食品的质量提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
甲醇(色谱纯):Fisher Chemical公司;黄豆素(纯度>99.44%)、黄豆苷(纯度>99.23%)、大豆苷(纯度>98%)、大豆苷元(纯度>99.9%)、染料木素(纯度>98%)、染料木苷(纯度>98.7%)、鸢尾黄酮苷(纯度>98.86%)、鹰嘴豆芽素A(纯度>99.65%):上海安谱科学仪器有限公司;高纯水(电阻率>18 MΩ):美国密博里公司;其余试剂均为分析纯:国药集团化学有限公司。
试验样品为大豆及大豆制品如豆浆、豆奶等共23种,均为市售产品。样品的名称和配料见表2。

表2 23种样品的名称和配料Table 2 Names and ingredients of 23 samples

续表
1.2 仪器与设备
1260型高效液相色谱仪(HPLC),配置二极管阵列检测器(diode array detector,DAD):美国安捷伦公司;固相萃取柱(Waters Sep-pakRVac 12cc(2g)C18Cartridges):美国Supelcol公司;pHS-3C型酸度计:上海仪电科学仪器股份有限公司;KQ-100DB型数控超声波清洗器:昆山市超声仪器有限公司;H-1650型离心机:上海博翎仪器设备有限公司;RE-2000A旋转蒸发器:上海亚荣生化仪器厂。
1.3 试验方法
1.3.1 标准溶液配制
(1)标准溶液储备液的配制:准确称取标准品黄豆黄苷、大豆苷、大豆苷元、染料木素、染料木苷、鹰嘴豆芽素A各10.0 mg于10 mL容量瓶中,用体积分数90%甲醇-水溶液溶解后定容至刻度,作为标准储备液;黄豆黄素和鸢尾黄酮苷在甲醇和水中的溶解性较差,分别称取10.0 mg于100 mL和50 mL容量瓶中,用体积分数为90%甲醇溶液溶解后定容至刻度,作为标准储备液。
(2)标准溶液使用液的配制:分别移取适量体积的黄豆黄素、黄豆黄苷、大豆苷、大豆苷元、染料木素、染料木苷、鸢尾黄酮苷、鹰嘴豆芽素A标准储备液于10mL容量瓶中,用甲醇定容至10.0mL,配制成质量浓度分别为1.00μg/mL、2.00μg/mL、5.00μg/mL、10.00μg/mL、20.00μg/mL、30.00μg/mL、40.00μg/mL、50.00μg/mL的标准系列工作溶液。
1.3.2 大豆异黄酮提取
(1)液体样品:准确称取1 g待测样品,用体积分数为90%甲醇溶液溶解定容至5 mL,摇匀后待净化处理。
(2)固体和半固体样品:样品粉碎过筛后,准确称取1 g样品于50 mL离心管中,加入25mL体积分数为90%甲醇溶液,超声提取30 min,经3 000 r/min离心15 min后,吸取上清液至150 mL旋蒸瓶。再向样品中加入25 mL体积分数为90%甲醇溶液,超声提取30 min,3 000 r/min离心15 min后,吸取上清液至旋蒸瓶。将收集的上清液经旋转蒸发仪浓缩至近干,用体积分数为90%甲醇定容至5 mL刻度管中,摇匀后待净化处理。
1.3.3 提取液的净化
提取液用C18固相萃取柱净化。在净化前,先加入10mL甲醇,再加入20 mL水活化柱子;再将上述经预处理后的样品提取液转移入柱并使组分保留在柱上;用15 mL水淋洗,最大程度除去干扰物;最后,用5 mL 0.5%甲酸甲醇溶液将待测物质洗脱下来并收集。收集液经0.22μm有机相滤膜过滤,待高效液相色谱测定。
1.3.4 样品加标试验
称取样品后加入适量的标准溶液,其他步骤同1.3.2。
1.3.5 色谱测定条件
色谱柱:Agilent SB-C18(250 mm×4.6 mm,5μm);流动相:A:pH 3.10磷酸水溶液,B:乙腈;流速:1.0 mL/min;柱温:40℃;检测波长:254 nm;进样量:20μL。梯度洗脱程序如表3所示。

表3 流动相梯度洗脱程序Table 3 Gradient elution procedures of mobile phase
2 结果与分析
2.1 检测条件的选择
2.1.1 检测波长的确定
8种大豆异黄酮在波长190~400 nm范围内的紫外光谱图见图2。

图2 8种大豆异黄酮的紫外吸收光谱图Fig.2 UV absorbance spectrum of 8 soybean isoflavones
从图2看出,8种大豆异黄酮在波长240~260nm处均有最大吸收。结合参考文献,比较了波长245nm[22]、254nm[18,22-24]、260 nm[5,19-21]等几个不同波长的色谱响应,结果表明,在波长254 nm处测定灵敏度高,且各组分峰的响应值均较高,因此采用254 nm作为检测波长。
2.1.2 色谱柱的选择
根据文献[15-32],对大豆异黄酮的分离分析均为采用C18柱的反相高效液相色谱。比较了8种异黄酮在Agilent ZORBAX Eclipse XDB C18、ZORBAX Stable Bond C18和C8三种型号的色谱柱上的分离效果,结果证明,在相同的色谱条件下SB-C18(250 mm×4.6 mm,5μm)对异黄酮的分离效果最好,因此选择SB-C18(250 mm×4.6 mm,5μm)色谱柱作为分析柱。
2.1.3 流动相的选择
考察了不同流动相、pH和流动相配比对异黄酮色谱行为的影响。以含0.1%的乙酸水溶液和0.1%的乙酸乙腈溶液作流动相,在采取梯度洗脱的方式时,大豆苷和黄豆黄苷、染料木苷和鸢尾黄酮苷均没有完全分离开;采用0.5%的甲酸水溶液和甲醇作为流动相,染料木苷和鸢尾黄酮苷没有完全分离开,染料木素与黄豆黄苷色谱峰重合;采用0.05%三氟乙酸水溶液和乙腈作为流动相,8种异黄酮仍然无法完全达到基线分离,且鹰嘴豆芽素A的出峰时间较长;以pH 2.96~3.98的H3PO4水溶液和甲醇为流动相,通过优化两相的配比,8种异黄酮均可获得满意的分离度,而且流动相中H3PO4水溶液pH值在2.96~3.18时,异黄酮的分离效果没有明显差异。综合考察各种影响因素后,采用pH 3.10的H3PO4和甲醇为流动相。
2.1.4 试样提取方法的选择
依据文献[16-24]报道并结合分析检测的实际情况,采用甲醇和水混合液作为异黄酮的提取溶剂。比较了甲醇和水体积比为60∶40、70∶30、80∶20、90∶10和100∶0时的提取效果,考察色谱峰峰面积与取样量的比值,提取效果以90∶10的甲醇和水溶液为最佳,最终选择体积比为90∶10的甲醇和水作为提取液。
考察了超声提取时间对提取效率的影响,平行称取同一样品3份,分别超声处理20min、30min、40min,计算峰面积与取样量的比值,结果表明,超声提取时间为30min和40min时提取效果无显著差异,而超声提取时间为20 min的提取效果较差。根据实验结果,选择超声处理时间为30 min。
考察了固相萃取洗脱溶液对净化效果的影响,结果选择0.5%甲酸甲醇溶液作为洗脱溶液。
2.2 标准曲线的线性范围
分别将不同浓度的大豆异黄酮混合标准溶液按色谱条件进行测定,得到8种大豆异黄酮标准溶液色谱图,见图3。

图3 8种大豆异黄酮混合标准溶液高效液相色谱图Fig.3 HPLC chromatogram of 8 soybean isoflavones mixed standard solution
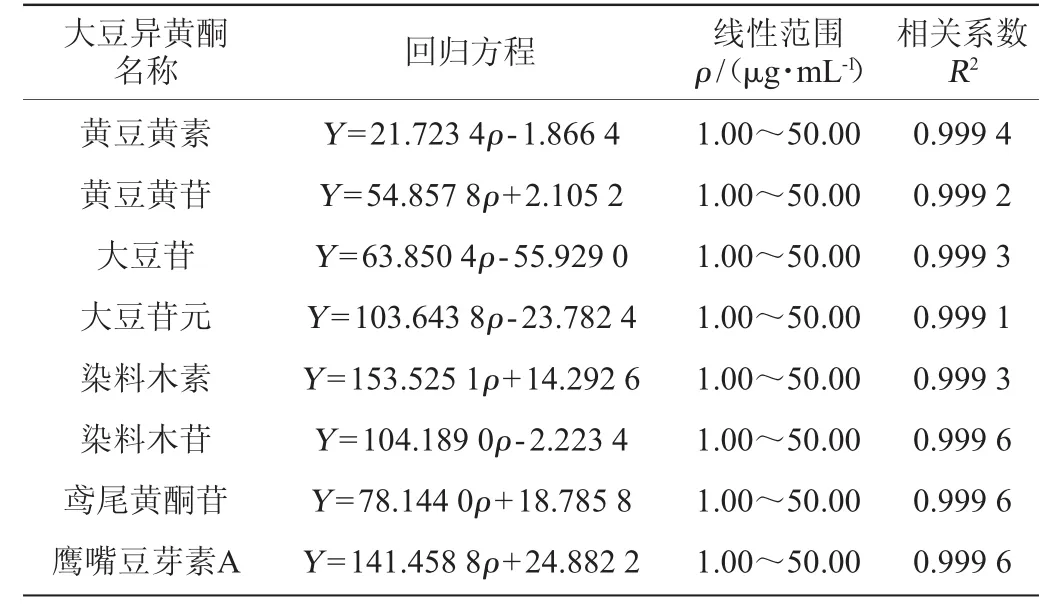
表4 8种大豆异黄酮标准曲线的回归方程和线性范围Table 4 Regression equation and linear range of standard curves of 8 soybean isoflavones
以异黄酮质量浓度(ρ,μg/mL)为横坐标、峰面积(Y)为纵坐标作图,8种异黄酮的标准曲线回归方程、线性范围和相关系数见表4。
由表4可知,8种异黄酮在质量浓度为1.00~50.00μg/mL范围内线性关系良好,相关系数R2均>0.999。
2.3 精密度试验
以质量浓度为20μg/mL的8种异黄酮混合标准溶液连续重复进样8次进行精密度试验,分别测定8种异黄酮的含量并计算相对标准偏差(relative standard deviation,RSD),结果见表5。
由表5可知,8种异黄酮标准品的测定结果RSD在1.03%~4.33%的范围内,表明该方法精密度良好。

表5 方法精密度实验结果Table 5 Results of precision tests of the method
2.4 加标回收率试验
在上述优化后的试验条件下,分别对样品添加20μg/g、40μg/g和200μg/g的标准品后进行测定,加标回收率试验结果见表6。

表6 加标回收率试验结果Table 6 Results of adding standard recovery tests

续表
由表6可知,大豆苷的回收率为79.3%~87.6%,黄豆黄苷的回收率为82.8%~86.5%,染料木苷的回收率为81.8%~88.2%,鸢尾黄酮甙的回收率为85.3%~95.1%,大豆苷元的回收率为95.6%~100.6%,黄豆黄素的回收率为94.3%~106.2%,染料木素的回收率为92.5%~104.4%,鹰嘴豆芽素A的回收率为95.6%~102.0%。测定结果表明,方法的准确性良好,8种化合物的回收率结果相对标准偏差(RSD)均≤3.1%,测定方法可以满足分析要求。
2.5 方法的检出限和定量限
根据国家标准GB/T 27417—2017《合格评定化学分析方法确认和验证指南》对检出限和定量限的规定,以3∶1的信噪比确定方法的检出限,以10倍的信噪比确定方法的定量限。黄豆黄素、黄豆黄苷、大豆苷、大豆苷元、染料木素、染料木苷、鸢尾黄酮苷、鹰嘴豆芽素A的检出限为0.2mg/kg,定量限为5 mg/kg。
2.6 样品中大豆异黄酮的含量
经测定,23种样品中所含的大豆异黄酮的具体含量见表7。

表7 样品中大豆异黄酮含量的测定结果Table 7 Determination results of soybean isoflavones contents in the samples mg/kg
由表7可知,腐竹中的大豆异黄酮种类丰富,并且含量较多,其中染料木苷的含量最多,为909.15mg/kg。而黄豆酱油所含大豆异黄酮最少,仅含有黄豆黄素、黄豆黄苷和大豆苷元,其中黄豆黄素的含量最多为2.55mg/kg。黑豆和黄豆中的异黄酮总量较高,分别为1354.10mg/kg和1054.51mg/kg,而郫县豆瓣酱中未检出大豆异黄酮。由此可见,腐竹是大豆异黄酮较为丰富的食品,大多数大豆异黄酮在加工时未被破坏,而黄豆酱油中的大豆异黄酮含量较少的原因有可能是在发酵过程中,部分大豆异黄酮降解或损失,这与周荧[15]对腐乳发酵过程中大豆异黄酮组分的变化及理化性质的研究结论是一致的,证明在发酵过程中大豆异黄酮的总含量逐渐减少。值得注意的是,大豆异黄酮的含量不仅与加工工艺有关,也取决于大豆食品加工中使用的大豆原料。此外,大豆中的主要黄酮类物质是黄豆黄素、黄豆黄苷、大豆苷、大豆苷元、染料木素和染料木苷,因此在所有样品中都没有检出鸢尾黄酮苷和鹰嘴豆芽素A。
3 结论
由于大豆制品的营养健康功效不断被人们所认识,我国大豆食品的生产和消费出现了空前的繁荣。我国地域广阔,生产的传统食用豆制品口味、品种更趋于多元化。因此,完善和提升现行国标,建立适用范围广泛的大豆异黄酮的分析方法对于大豆食品的质量控制和市场监管是极其重要的。本研究建立了一种测定多种大豆、大豆制品等食品中黄豆黄素、黄豆黄苷、大豆苷、大豆苷元、染料木素、染料木苷、鸢尾黄酮苷、鹰嘴豆芽素A共8种异黄酮含量的固相萃取-HPLC紫外光谱检测法。该法采用甲醇水溶液提取异黄酮,提取液用C18固相萃取柱净化,采用C18色谱柱分离,柱温40℃,以乙腈-磷酸水溶液为流动相,流速1.0 mL/min,紫外检测器254 nm进行检测,8种黄酮类化合物的标准曲线线性范围为1.00~50.00μg/mL,其精密度实验结果的相对标准偏差均<5%,回收率在79.3%~102.5%范围内,检出限为0.2 mg/kg,定量限为5 mg/kg。实验结果表明,本方法适用范围广、分离度好、准确性好、灵敏度高,可以作为有效控制大豆食品质量的依据,具有一定的理论意义和应用价值。
