spo0A基因缺失对克劳氏芽孢杆菌发酵生产性能的影响
2018-12-07原梨萍王瑞明路福平汪俊卿
原梨萍,肖 静,王瑞明,路福平*,汪俊卿,李 玉
(1.天津科技大学 生物工程学院 工业微生物教育部重点实验室,天津 300457;2.齐鲁工业大学 生物工程学院 山东省微生物酶技术重点实验室,山东 济南 250353)
克劳氏芽孢杆菌(Bacillus clausii)是一类好氧型、内生抗逆孢子的革兰氏阳性菌,具有很好的耐受性,能在极端环境下生长。近年来,芽孢形成及萌发过程中关键基因的研究[1-2]备受青睐,而克劳氏芽孢杆菌由于其生理特性及基因信息不明确,使其在芽孢方面的研究及工业上的应用较为落后。目前,国内外科研人员以模式微生物枯草芽孢杆菌为主对芽孢形成过程及关键基因的调控做了大量深入的研究[3-7],其中,以Spo0A、sigma因子及五种磷酸激酶基因的研究居多[8-13]。芽孢的生成是一个多层次分阶段的过程,其中Spo0A是细胞从营养生长期进入芽孢形成时期的关键应答调节蛋白(responseregulatorprotein,RSP),Spo0A-PO4通过结合到基因“OA-box”序列上可调节500多种基因的表达。
目前国内外研究发现,spo0A基因缺失对枯草芽孢杆菌(Bacillus subtilis)、梭状芽孢杆菌、苏云金芽孢杆菌(Bacillusthuringiensis)等多种芽孢杆菌的芽孢生成均产生有效的抑制作用[14-16],而且该基因一定程度上影响菌体生物量及代谢产物的产量,SANDOVAL NR等[17]敲除梭状芽孢杆菌spo0A基因后不仅对芽孢生成产生影响,而且有效提高了菌体生物量及丁醇产量。目前国内外关于spo0A基因缺失影响淀粉酶产量的报道少见。本实验通过基因敲除技术构建spo0A基因缺失菌株,研究发现spo0A基因的缺失对菌体生物量、芽孢生成率及淀粉酶活力均产生影响,该基因在菌种改良上可以作为提高淀粉酶产量的靶点,对后续芽孢缺失型工业生产菌株的构建具有重要意义,为酶工业遗传育种提供了新的选择,也为高产淀粉酶芽孢杆菌工程菌株的构建奠定了基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株及质粒
克劳氏芽孢杆菌(Bacillus clausii)QL-1、含pHT01质粒的大肠杆菌(Escherichia coli)JM109:山东省微生物工程重点实验室保存。
1.1.2 试剂
限制性核酸内切酶:大连TakaRa公司;氯霉素、Ezup柱式基因组脱氧核糖核酸(deoxyribonucleicacid,DNA)抽提试剂盒、SanPrep柱式DNA胶回收试剂盒:生工生物工程(上海)有限公司;高纯度质粒小量快速抽提试剂盒:北京艾德莱生物科技有限公司;其他试剂均属于国产分析纯。引物由生工生物工程(上海)有限公司合成。
1.1.3 培养基
LB培养基:酵母浸粉5g/L、蛋白胨10g/L、氯化钠10g/L、pH 7.0。
可溶性淀粉培养基:牛肉膏5 g/L、蛋白胨10 g/L、氯化钠 5 g/L、可溶性淀粉 2 g/L、pH 7.0~7.2、琼脂 20 g/L。
菌体增殖培养基:酵母浸粉5 g/L、蛋白胨10 g/L、氯化钠10 g/L、山梨醇91 g/L。
菌体复苏培养基:酵母浸粉5 g/L、蛋白胨10 g/L、氯化钠10 g/L、山梨醇69 g/L、甘露醇91 g/L。
上述培养基均于121℃灭菌20 min。
1.2 仪器与设备
SW-CJ-2FD型双人单面净化工作台:苏州净化设备有限公司;WFJ7200型可见分光光度计:尤尼柯(上海)仪器有限公司;4380C型电转仪、5804R低温冷冻离心机:德国Eppendorf公司;GNP-9080型隔水式恒温培养箱:上海精宏实验设备有限公司;Veriti96孔热循环梯度聚合酶链式反应(polymerasechain reaction,PCR)仪:美国应用生物系统公司;MD2000核酸超微量分光光度计:美国BioFure公司;ZQYZ-CS型恒温振荡培养箱:上海知楚仪器有限公司;DYY-12电泳仪:北京市六一仪器厂;UVIEssential V6凝胶成像仪:英国Uvitec公司。
1.3 实验方法
1.3.1 引物设计
采用Oligo软件设计引物,引物信息见表1。

表1 本实验所用引物Table 1 Primers used in this experiment
1.3.2 同源重组片段spo0A-Cmr的制备
同源重组片段spo0A-Cmr的制备流程见图1。

图1 重组菌B.clausii QL-1△spo0A构建流程图Fig.1 Flowchart of recombinant strain B.clausii QL-1△spo0A construction
spo0A基因的调取:挑取B.clausii QL-1单菌落转接于50 mL LB液体培养基,37℃,200 r/min培养12 h,使用Ezup柱式基因组DNA抽提试剂盒对B.clausii QL-1菌体基因组进行提取。1μL基因组模板、1μL spo0A F和1μL spo0A R引物、12.5μL 2×HiFi-PCRmaster、9.5μLddH2O组成的25μL反应体系进行PCR扩增,获得碱基长度为418 bp的spo0A基因片段,PCR扩增条件:95℃预变性5 min;95℃变性30 s,56℃退火30s,72℃延伸45s,30个循环;72℃再延伸10min,4℃保存。
片段Cmr基因的调取:挑取大肠杆菌JM109单菌落转接于50 mL LB液体培养基,37℃,200 r/min培养12 h,使用高纯度质粒小量提取试剂盒提取pHT01质粒。1μLpHT01质粒模版、1μL CmrF和1μL CmrR引物、12.5μL 2×HiFi-PCR master、9.5μL ddH2O组成的25μL反应体系进行PCR扩增,获得长度为1 264 bp的Cmr抗性基因片段,PCR扩增条件:95℃预变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸2 min35s,30个循环;72℃再延伸10min,4℃保存。
同源重组片段spo0A-Cmr的制备:使用SanPrep柱式DNA胶回收试剂盒回收所得的spo0A基因片段和Cmr抗性基因片段,首先进行第一步重叠PCR,2μL spo0A基因片段和2μL Cmr抗性基因片段互为模板及引物、12.5μL 2×HiFi-PCR master及3.5μL ddH2O组成的25μL反应体系进行重叠延伸PCR扩增,PCR扩增条件:95℃预变性5 min;95℃变性30 s,58℃退火30 s,72 ℃延伸2 min 35 s,8个循环;向第一步反应液中加入1μL spo0A F和1μL CmrR引物、12.5μL 2×HiFi-PCR master及10.5μL ddH2O进行第二步大量PCR扩增,PCR扩增条件:95℃预变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸3 min 30 s,30个循环;72℃再延伸10 min,4℃保存。经过上述两步重叠延伸PCR扩增得到1648bp的同源重组片段spo0A-Cmr。使用SanPrep柱式DNA胶回收试剂盒回收所得的spo0A-Cmr片段,-20℃保存备用。
1.3.3 同源重组片段spo0A-Cmr回收产物的酶切及浓缩
采用限制性核酸内切酶Bam HⅠ对所得的spo0A-Cmr片段进行酶切,30μL酶切体系:25μL PCR产物、1.5μL Bam HⅠ、3.5μL 10×K Buffer,37℃静置1.5 h。向酶切产物中加入醋酸钠(1/10体积,3mol/L)和无水乙醇(25倍体积),混合后-20℃处理20 min,12 000 r/min离心8 min得DNA沉淀;加入体积分数为70%乙醇重悬DNA沉淀,12 000 r/mim离心8 min,除去乙醇,37℃风干,加入ddH2O重悬,制得300~500 ng/μL的spo0A-Cmr浓缩DNA溶液。
1.3.4 克劳氏芽孢杆菌B.clausii QL-1感受态的制备
电转缓冲液配制:山梨醇91 g/L、甘露醇91 g/L、甘油100 g/L。
将B.Clausii QL-1单菌落接种于15 mL的LB液体培养基中,37℃、200 r/min振荡培养12 h;将上述菌液以2%接种量转接到50 mL LB培养基中,37℃、200 r/min振荡培养至OD600nm值为1.0;4 ℃、8 000 r/min离心8 min收集菌体;电转缓冲液洗涤3~4次后重悬、分装,即为制备好的感受态。感受态制备过程中均保证4℃条件下操作。
1.3.5 重组菌B.clausii QL-1△spo0A的构建
25 mg/mL氯霉素的制备:准确称取氯霉素溶解于无水乙醇,溶解后过0.22μm滤膜过滤除菌,分装后于-20℃中保存。
感受态与spo0A-Cmr浓缩片段以10∶1(V/V)比例混合,1500 V、5 ms条件下进行电转化,立即加入1 mL的菌体复苏培养基,37℃、180 r/min复苏4~5 h后涂布于氯霉素终质量浓度为25μg/mL的LB固体培养基中培养18~24 h,筛选具有氯霉素抗性的菌株。
1.3.6 阳性重组菌株的鉴定
以提取到的阳性菌株DNA为模板,spo0A F和CmrR为引物PCR扩增,扩增产物进行1%琼脂糖凝胶电泳分析,最终获得阳性重组菌株B.clausii QL-1△spo0A。B.clausii QL-1△spo0A重组菌于LB液体培养基中,在37℃、200r/min振荡培养条件下传代15次,进行菌落PCR检测。
1.3.7 出发菌株及重组菌株芽孢形成检测
将菌株B.clausii QL-1与B.clausii QL-1△spo0A分别以2%接种量接种于LB液体培养基,37℃、200 r/min振荡培养28 h,将菌液于80℃水浴处理10 min。将80℃水浴处理过的出发菌株菌液稀释10-6倍、重组菌株菌液不稀释,同样分别做三个平行,取100μL涂布于LB固体平板上,将未处理的出发菌株及重组菌株的菌液分别稀释10-6倍,做3个平行,取100μL涂布于LB固体平板上,上述平板放置于37℃培养12~18 h,用平板计数法观察并清点100μL处理菌液及未处理菌液的芽孢数及菌体数(CFU/mL)。芽孢生成率计算公式如下:

1.3.8 B.clausii QL-1△spo0A重组菌生长曲线及生物量的测定
生长曲线的绘制:挑取菌株B.clausii QL-1与B.clausii QL-1△spo0A单菌落于15mLLB液体培养基,37℃、200r/min振荡培养12 h,将菌液转接至100 mL LB液体培养基至初始OD600nm值为0.1左右,继续培养,每隔4 h取样4 mL,使用紫外分光光度计在波长600 nm处测定吸光度值。
生物量的测定:每隔12h取样10 mL,离心得菌体沉淀,于70℃烘箱烘干至恒质量后测其生物量。
1.3.9 B.clausii QL-1△spo0A重组菌淀粉酶酶活的测定
分别将出发菌株B.clausii QL-1和重组菌株B.clausii QL-1△spo0A单菌落点涂于可溶性淀粉平板中央,于37℃条件下静置培养36 h,观察并比较透明圈大小。分别以2%接种量接种在LB液体培养基中,37℃、200 r/min振荡培养,每隔6 h取样5 mL,4℃、12 000 r/min离心8 min取上清,按照国标GB/T 24401—2009《α-淀粉酶制剂》中所示方法测定淀粉酶酶活,并按干质量进行换算为U/g。
淀粉酶酶活定义:于60℃、pH值为6.0条件下,1 h液化1 g可溶性淀粉的酶量,即为一个酶活力单位(U/g)。
2 结果与分析
2.1 spo0A基因缺失菌株B.clausii QL-1△spo0A的构建
以B.clausii QL-1出发菌基因组为模板,spo0A F和spo0A R为引物进行PCR扩增,1%琼脂糖凝胶电泳检测,结果见图2a。由图2a可知,扩增产物大小为500 bp左右,与理论长度418 bp相符,说明成功获得spo0A片段;以质粒pHT01为模板,CmrF和CmrR为引物PCR扩增,1%琼脂糖凝胶电泳检测,结果见图2b。由图2b可知,扩增产物大小为1000bp左右,与理论长度1 264 bp相符,说明成功获得抗性基因Cmr片段;以胶回收所得的spo0A片段和Cmr片段为模板,spo0A F和CmrR为引物进行重叠延伸PCR扩增,1%琼脂糖凝胶电泳检测,结果见图2c。由图2c可知,扩增产物大小为1 500 bp左右,与理论长度1 648 bp相符,说明成功获得同源重组片段spo0A-Cmr。将spo0A-Cmr片段经Bam HⅠ酶切后进行浓缩,测其质量浓度为450ng/μL。将10μL回收片段与100μL的B.clausii感受态混合进行电转化,涂布于氯霉素抗性LB平板上,挑取阳性转化子,以spo0A F和CmrR为引物进行菌落PCR验证,1%琼脂糖凝胶电泳检测结果见图2d。由图2d可知,出现特异性目的条带,表明成功获得B.clausii QL-1△spo0A重组菌。
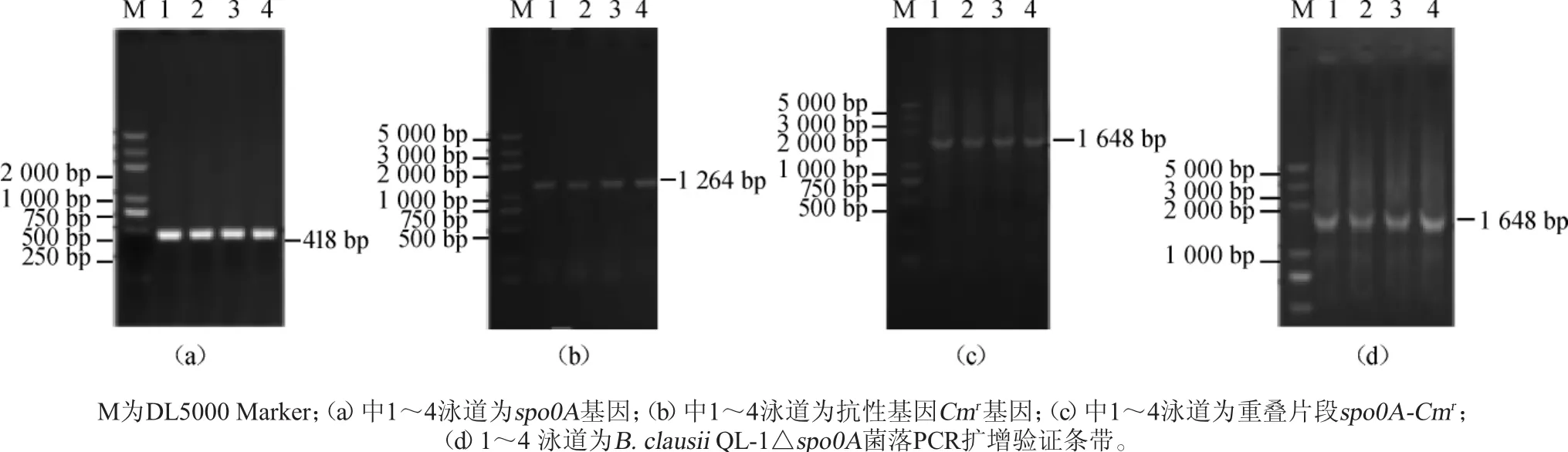
图2 spo0A-Cmr片段PCR扩增产物及菌落PCR扩增产物凝胶电泳图Fig.2 Electrophoresis of PCR amplified products of spo0A-Cmr and colony
通过连续传代15次,以CmrF和CmrR为引物进行菌落PCR扩增,1%琼脂糖凝胶电泳检测,结果见图3。由图3可知,得到扩增产物大小为1 000 bp左右,与理论长度1 264 bp相符,说明B.clausii QL-1△spo0A成功导入Cmr抗性基因,以spo0A F和CmrR为引物得到的扩增产物大小同样于1648bp出现特异性目的条带,表明重组菌株遗传稳定性较好。

图3 B.clausii QL-1△spo0A重组菌株PCR扩增产物凝胶电泳图Fig.3 Electrophoresis of PCR amplified products of recombinant strain B.clausii QL-1△spo0A
2.2 spo0A基因缺失克劳氏芽孢杆菌对芽孢萌发的影响
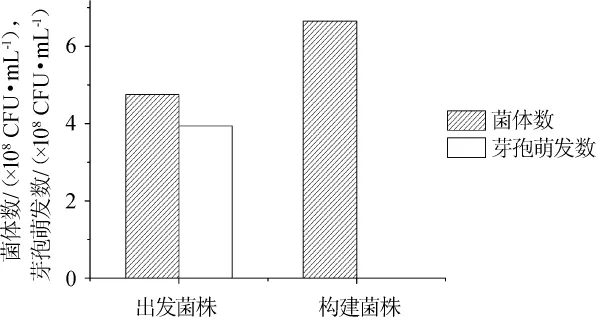
图4 spo0A基因缺失对克劳氏芽孢杆菌芽孢萌发的影响Fig.4 Effect of spo0A gene deletion on spore germination of B.clausii
通过平板计数法对出发菌株及重组菌株芽孢生成情况进行计算及比较,结果见图4。由图4可知,菌株B.clausii QL-1芽孢萌发数为3.93×108CFU/mL,菌体数为4.67×108CFU/mL,计算得到出发菌株B.clausii QL-1芽孢生成率约为84.15%,通过平板计数法及显微镜观察,B.clausii QL-1△spo0A均不生成芽孢。结果表明,spo0A基因是克劳氏芽孢杆菌芽孢萌发过程中的关键基因。
2.3 spo0A基因缺失克劳氏芽孢杆菌对菌株生长的影响
对出发菌株B.clausii QL-1及重组菌株B.clausii QL-1△spo0A进行了生长规律分析及生物量测定,结果见图5。

图5 spo0A基因缺失对菌株在LB培养基中生长周期(a)及生物量(b)的影响Fig.5 Effect of spo0A gene deletion on the growth cycle(a)and biomass(b) of strain in LB medium
由图5a可知,B.clausii QL-1△spo0A菌株与出发菌株的生长周期基本保持一致,4~18 h为对数生长期,18~28 h为稳定期,28 h后进入衰亡期。由图5b可知,在任何时间段,重组菌株B.clausii QL-1△spo0A生物量均高于出发菌株B.clausii QL-1,且均在20 h出现最大生物量,分别为3.10 mg/mL、2.50 mg/mL,生物量提高了24%。
2.4 spo0A基因缺失克劳氏芽孢杆菌对淀粉酶分泌的影响
可溶性淀粉平板初筛,重组菌株B.clausii QL-1△spo0A较出发菌株B.clausii QL-1透明圈增大,重组菌株透明圈与菌落直径比为2.75,出发菌株透明圈与菌落直径比为1.31,说明构建菌株较出发菌株水解淀粉能力更强。进一步于LB液体培养基发酵培养并测定淀粉酶酶活,结果见图6。由图6可知,重组菌株B.clausii QL-1△spo0A产淀粉能力高于出发菌株B.clausii QL-1菌株,且发酵至72 h时,淀粉酶酶活均达到最高,分别为1.58×105U/g、0.86×105U/g,较出发菌株B.clausii QL-1,重组菌株B.clausii QL-1△spo0A淀粉酶酶活提高83.72%。

图6 spo0A基因缺失对淀粉酶酶活的影响Fig.6 Effect of spo0A gene deletion on amylase activity
3 结论
本实验室通过同源单交换技术成功实现了克劳氏芽孢杆菌spo0A基因的敲除,构建了spo0A基因缺失型菌株B.clausii QL-1△spo0A,并对其发酵性能进行初步研究,发现spo0A基因缺失型菌株不生成芽孢,且较出发菌株B.clausii QL-1生物量提高24%,表明spo0A基因不仅是克劳氏芽孢杆菌芽孢形成关键基因,而且也是菌株生长的重要基因,为构建芽孢缺失型克劳氏芽胞杆菌工业生产菌株奠定了基础。通过对B.clausii QL-1△spo0A菌株的进一步研究发现,重组菌株B.clausii QL-1△spo0A较出发菌株B.clausii QL-1淀粉酶酶活提高83.72%,表明spo0A基因也是克劳氏芽孢杆菌淀粉酶生成的重要相关基因,该发现对高产淀粉酶芽孢杆菌类微生物的构建具有指导意义。
