米根霉发酵木薯淀粉产L-乳酸的工艺优化
2018-12-07黄玉龙石鹏霞孙若诗康三江
黄玉龙,石鹏霞,武 泽,孙若诗,康三江,张 芳*
(1.甘肃省农业科学院 农产品贮藏加工研究所,甘肃 兰州 730070;2.西北师范大学 甘肃特色植物有效成分制品工程技术研究中心,甘肃 兰州 730070)
L-乳酸是广泛应用于食品、医药、皮革、纺织等行业的食用有机酸和化学原料。由于L-型乳酸在人和哺乳动物体内能够直接参与代谢并被全部吸收[1],从人体营养以及代谢的角度来看,L-乳酸更受青睐。世界卫生组织(world health organization,WHO)建议使用L-乳酸含量较高的产品,尤其是生产婴幼儿营养食品应避免使用D-乳酸或D,L-乳酸[2-3]。发酵法生产L-乳酸常用的微生物主要有乳酸菌和根霉菌[4],采用米根霉(Rhizopus oryzae)发酵L-乳酸明显具有营养要求简单、发酵时间短、底物转化效率高、产物易回收等优点,目前国内多采用此方法生产L-乳酸,但存在发酵产率较低的缺点。BAID M等[5]通过驯化改良的米根霉HZS6菌株发酵玉米芯水解液,提高了菌株对木糖和葡萄糖的利用率,L-乳酸浓度比驯化前提高1倍,达到65 g/L。米根霉在一定量氮源的高糖培养基中产生和分泌乳酸,其首选发酵底物为淀粉基原料,L-乳酸对淀粉的转化率可达到0.87~0.97 g/g,发酵方式有菌种固定化发酵、液体深层游离发酵等[6-8]。PIMTONGV等[9-10]采用细胞固定化于纤维基质上的米根霉NRRL395在静态床发酵罐中发酵生产L-乳酸,通过高葡萄糖质量浓度(150 g/L)发酵,L-乳酸产量和生产效率分别为75.28 g/L和1.05 g/(L·h)。FU Y Q等[11]采用加装液体过滤和组分收集改良装置的发酵罐一步法发酵策略,发酵液中最大乳酸质量浓度和产酸效率分别为158 g/L和5.45 g/(L·h),比常规发酵的最好结果高177%和366%。本试验选取米根霉为发酵菌种,通过单因素和响应面优化试验对发酵培养基和发酵条件进行了系统研究,得出以木薯淀粉糖化液作为碳源米根霉发酵L-乳酸的最优发酵条件,旨在为不同原料发酵L-乳酸提供一定的技术支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 糖化液及菌株
木薯淀粉糖化液:超声波细胞粉碎机对木薯淀粉进行预处理,耐高温α-淀粉酶和糖化酶协同对木薯淀粉进行酶解,经测定糖化液还原糖含量为454.63 g/L。
米根霉(Rhizopusoryzae),编号BNCC336321:北纳创联生物技术有限公司。
1.1.2 化学试剂
KH2PO4、MgSO4·7H2O、ZnSO4·7H2O、CaCO3、CuSO4(均为分析纯)、异丙醇(色谱纯):天津光复科技发展有限公司;蛋白胨、酵母浸膏、麦芽粉(均为生化试剂):北京奥博星生物技术公司;L-乳酸(纯度≥99.5%)、D-乳酸(纯度≥99.5%)标准品:美国Sigma Aidrich公司。
种子培养基(采用麦芽汁琼脂培养基):取麦芽汁琼脂培养基成品40 g,加入1 000 mL蒸馏水,自然pH,121℃灭菌15 min。
发酵培养基:木薯淀粉糖化液260 g/L,蛋白胨4 g,酵母浸膏3 g,麦芽粉10 g,KH2PO40.3 g,MgSO4·7H2O 0.4 g,ZnSO4·7H2O 0.3 g,CaCO345 g,蒸馏水1 000 mL,自然pH,121℃灭菌15 min。
1.2 仪器与设备
UV1000紫外可见分光光度计:北京莱伯泰科仪器股份有限公司;YXQ-LS-50S立式压力蒸汽灭菌器:上海博迅实业有限公司;HR40-ⅡA2生物安全柜:青岛海尔特种电器公司;LRH-250-G光照培养箱:广东省医疗器械厂;L-535R离心机:湘仪离心机仪器有限公司;PHS-3C精密酸度计:上海三信仪表有限公司;SBA-40D生物传感器:山东省科学院;MCIGEL CRS10W液相手性柱(4.6 mm×50 mm,3μm):日本三菱化学集团;Ultimate 3000高效液相色谱仪:美国Thermo Fisher Scientific公司:WZZ-2B自动旋光仪:上海精密科学仪器有限公司。
1.3 方法
1.3.1 米根霉的活化
将4℃保存的米根霉冻干粉用体积分数为75%的酒精擦拭管壁,移入安全柜用小砂轮划圈后敲断管壁。将0.3mL左右无菌水注入冻干管中,吹打,充分溶解成菌悬液。吸取米根霉菌悬液打入3个5°Bé麦芽汁琼脂培养基的平板,在28℃培养5~7 d。复苏后再传代1~2次恢复活力后使用。将恢复活力后的菌种接入已酶解后的糖化液为唯一碳源的发酵培养基中,即可进行糖化液发酵L-乳酸试验[12]。
1.3.2 米根霉生长曲线的绘制
取6%活化后的菌种接种于发酵培养基上,每组3个平行,在28℃静置培养24 h,每隔2 h取样在波长600 nm处测定菌体密度OD600nm值。以培养时间为横坐标,以所对应的OD600nm值为纵坐标绘制米根霉菌种生长曲线。选择对数生长中后期作为该菌种接入发酵培养基中的种龄。
1.3.3 培养基配方优化单因素试验
以木薯淀粉糖化液为唯一碳源,通过单因素试验,研究各成分对L-乳酸发酵的影响。培养基基础配方为:糖化液250 g/L、蛋白胨6 g/L、酵母膏4 g/L、麦芽粉10 g/L、KH2PO40.3 g/L、MgSO4·7H2O 0.4 g/L、ZnSO4·7H2O 0.3 g/L、CaCO345 g/L。单因素变量梯度为:糖化液添加量(10 g/L、15 g/L、20 g/L、25 g/L、30 g/L、35 g/L)、蛋白胨添加量(2 g/L、4 g/L、6 g/L、8 g/L、10 g/L)、酵母浸膏添加量(1 g/L、2 g/L、3 g/L、4 g/L、5 g/L、6 g/L)、麦芽粉添加量(2.5 g/L、5.0 g/L、7.5 g/L、10.0 g/L、12.5 g/L、15.0 g/L)。
1.3.4 培养条件优化单因素试验
在培养基配方单因素优化试验的基础上,研究培养条件中的培养温度(22℃、25℃、28℃、31℃、34℃)、初始pH值为(4.2、5.2、6.2、7.2、8.2)、培养时间(24 h、48 h、72 h、96 h、120 h、144 h)、接种量(2%、4%、6%、8%、10%)对L-乳酸发酵的影响。培养条件的其他参数为培养温度28℃、pH 5.20、静置培养时间72 h、接种量6%。
1.3.5 响应面法优化米根霉发酵工艺条件
在培养基配方单因素和培养条件单因素试验结果的基础上,选取影响L-乳酸发酵的主要因素糖化液质量分数、培养时间、培养温度以及初始pH值为考察变量,选取L-乳酸含量(Y)为评价指标,采用Design Expert 8.0.6设计响应面优化验,试验设计因素与水平见表1。

表1 米根霉发酵条件优化响应面试验因素与水平Table 1 Factors and levels of response surface experiments for Rhizopus oryzae fermentation conditions optimization
1.3.6 分析检测
(1)L-乳酸含量的测定
L-乳酸含量、残糖剩余量的测定采用SBA-40D型生物传感器[13]。
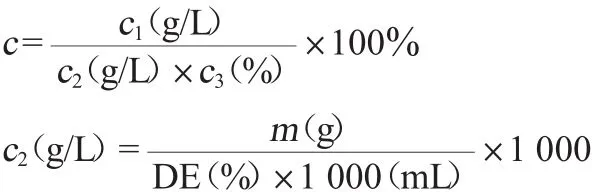
式中:c为葡萄糖对L-乳酸的转化率,%;c1为L-乳酸产量浓度,g/L;c2为初始糖浓度,g/L;c3为木薯淀粉糖化液的百分数,%;m为木薯淀粉的质量,g;DE为木薯淀粉的糖化率,%。
(2)L-乳酸的纯度分析
L-乳酸的纯度分析采用高效液相色谱(high-performance liquid chromatography,HPLC)法。其色谱条件为MCIGEL CRS10W手性柱;流动相:2 mmol/L CuSO4∶异丙醇=95∶5(V/V),流速0.5 mL/min,柱温30℃;检测波长254 nm,紫外检测器,进样量10 μL[14]。
L-乳酸标准曲线的制作:准确称取L-乳酸标准品2.5mg,加1 mL超纯水制成2.5 mg/mL的L-乳酸标准品母液。取适量母液分别稀释成1.0mg/mL、2.0mg/mL、3.0mg/mL、4.0mg/mL和5.0mg/mL的L-乳酸标准液置于1.5mLEP管中,用0.22μm孔径滤头过滤,使用平头进样器进样10μL,测其峰面积。以L-乳酸标准液的各质量浓度(x)对应的峰面积(y)制作L-乳酸标准曲线,得到标曲回归方程为:y=266.47x+28.40(相关系数R2=0.998 5)。
(3)L-乳酸发酵液比旋光度的测定
依据池利民等[15]测定麦芽糖比旋光度的方法略作修改:取L-乳酸发酵液加入10cm测定管中,于20℃、589.44 nm钠单色光源条件下测定样品的比旋光度。
2 结果与分析
2.1 米根霉生长曲线
通过米根霉菌体生长曲线可知菌体生长状况,选择菌体浓度适宜、菌体及产酶活力较高时的菌液用于接种发酵[16]。由图1可知,米根霉在0~4 h为适应期,生长4 h左右进入了对数期,大约20h进入稳定期,在24h左右进入衰亡期。由于通常情况下18 h的菌种活力比较高,适于发酵乳酸,故选择18 h的种子进行发酵试验。
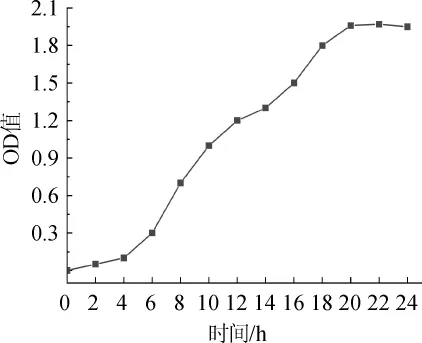
图1 米根霉生长曲线图Fig.1 Growth curve of Rhizopus oryzae
2.2 培养基配方优化单因素试验
2.2.1 糖化液添加量对L-乳酸发酵的影响
米根霉可利用的碳源很广泛,糖类、淀粉、糖蜜和纤维素等都能用来发酵乳酸。以木薯淀粉糖化液为碳源进行乳酸发酵,从理论上讲,提高淀粉糖化液的浓度会增加乳酸产量,但菌种对高浓度底物的耐受能力是固定的,初糖浓度太高,会使发酵周期延长,影响L-乳酸的生产能力,因此,有必要确定最佳糖化液浓度[17]。由图2可知,当糖化液添加量较低时,L-乳酸产量较低;随着糖化液添加量的增加,米根霉产酸能力也逐渐上升,在糖化液添加量为25 g/L时达最大值77.5g/L,此时发酵液中L-乳酸含量显著高于其他试验组(P<0.05),之后随糖化液添加量>25 g/L,增加L-乳酸含量有所下降。因此,选择最佳糖化液添加量为25%。

图2 糖化液添加量对L-乳酸发酵的影响Fig.2 Effect of saccharification liquid addition on L-lactic acid fermentation
2.2.2 蛋白胨添加量对L-乳酸发酵的影响

图3 蛋白胨添加量对L-乳酸发酵的影响Fig.3 Effect of peptone addition on L-lactic acid fermentation
由图3可知,蛋白胨添加量为6 g/L和8 g/L时,发酵液中L-乳酸的含量显著高于蛋白胨添加量为2g/L、4g/L和10g/L时L-乳酸的含量(P<0.05)。原因可能是,对根霉菌而言,其主要营养成分是可溶性蛋白、磷酸盐和铵盐等,发酵时添加的蛋白胨过少,不利于菌体生长,产酸量较低;当其浓度过高时,菌体生长过于旺盛,菌体消耗过多的营养用于生长,产酸量反而下降。因此,选择最适蛋白胨添加量为6g/L。
2.2.3 酵母浸膏添加量对L-乳酸发酵的影响
由图4可知,酵母浸膏添加量为3 g/L、4 g/L和5 g/L时,发酵液中L-乳酸的含量显著高于其他的试验组(P<0.05),随着酵母浸膏添加量增加,发酵液中L-乳酸含量呈先增后减的趋势。这可能是因为酵母浸膏中含有的嘌呤、嘧啶以及B族维生素等碱基和维生素是米根霉生长和产酸的必需因子,酵母浸膏添加量低时,有利于L-乳酸发酵,酵母浸膏含量高导致营养过剩,不利于L-乳酸发酵,反而促进了菌体的生长[18]。因此,选择最适酵母浸膏添加量为3 g/L。

图4 酵母浸膏添加量对L-乳酸发酵的影响由Fig.4 Effect of yeast extract addition on L-lactic acid fermentation
2.2.4 麦芽粉添加量对L-乳酸发酵的影响

图5 麦芽粉添加量对L-乳酸发酵的影响Fig.5 Effect of malt powder addition on L-lactic acid fermentation
由图5可知,麦芽粉添加量为10.0g/L、12.5g/L和15.0g/L时,发酵液中L-乳酸的含量显著高于麦芽粉添加量为2.5g/L、5.0 g/L和7.5 g/L时发酵液中L-乳酸的含量(P<0.05),且麦芽粉添加量从2.5~15.0 g/L,L-乳酸含量逐渐上升,在10.0 g/L和12.5 g/L时达最大值后又出现下降的趋势。原因可能是在L-乳酸发酵的过程中,麦芽粉除提供氮源等营养外,可能还具有发酵所必需的某些因子,随着发酵因子的增加,菌种生长越来越旺盛,对底物的消耗增加,造成产酸量下降。因此,考虑成本、发酵效率等因素,选择最佳麦芽粉添加量为10.0 g/L。
2.3 培养条件优化单因素试验
2.3.1 接种量对L-乳酸发酵的影响
不同的接种量对乳酸发酵结果有不同的影响,接种量过少,就会延长发酵的周期,降低生产效率;接种量过多,菌种生长过旺,消耗大量的营养物质,降低原料的转化率,造成成本的提高。由图6可知,接种量为6%时,L-乳酸的产量显著高于接种量为2%、4%、8%、10%的L-乳酸产量(P<0.05)。因此,选择最适接种量为6%。

图6 接种量对L-乳酸发酵的影响Fig.6 Effect of inoculum on L-lactic acid fermentation
2.3.2 培养温度对L-乳酸发酵的影响
培养温度对米根霉L-乳酸发酵的影响。由图7可知,L-乳酸的含量随培养温度的升高出现先增高后降低的趋势,当培养温度为28℃时,L-乳酸的产量显著高于培养温度为22℃、25℃、31℃和34℃时的L-乳酸产量(P<0.05)。说明温度的变化影响了各种酶反应的速率,培养温度升高酶反应速率增大、生长代谢加快,产物生成提前;但是温度过高,酶自身越容易失活,菌体加快衰老,最终影响产量[19]。因此,选择最适培养温度为28℃。

图7 培养温度对L-乳酸发酵的影响Fig.7 Effect of culture temperature on L-lactic acid fermentation
2.3.3 初始pH对L-乳酸发酵的影响

图8 初始pH值对L-乳酸发酵的影响Fig.8 Effect of initial pH value on L-lactic acid fermentation
pH过高或过低都会对发酵过程中的酶有影响。考察pH 4.2~8.2范围内米根霉发酵L-乳酸的变化规律,结果见图8。由图8可知,pH 4.2~5.2,L-乳酸的含量呈增加趋势,pH 5.2~8.2,L-乳酸的含量则呈降低趋势;当pH 5.2时,L-乳酸的产量显著高于pH 4.2、pH 6.2、pH 7.2、pH 8.2的L-乳酸产量(P<0.05)。因此,选择最适初始pH值为5.2。
2.3.4 培养时间对L-乳酸发酵的影响
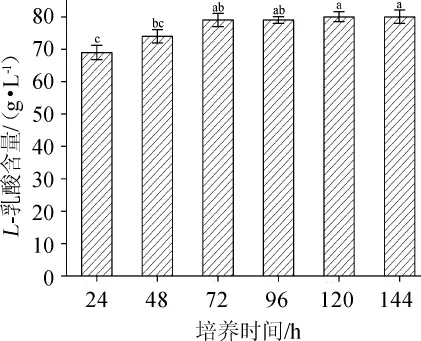
图9 培养时间对L-乳酸发酵的影响Fig.9 Effect of culture time on L-lactic acid fermentation
由图9可知,当培养时间为24~72 h时,L-乳酸的产量随着发酵时间的延长而不断增加;当培养时间>72 h时,L-乳酸的产量随着发酵时间的延长而不再有明显的变化。显著性分析可知,培养时间为72 h、96 h、120 h和144 h时,发酵液中L-乳酸的含量显著高于培养时间为24 h、48 h时发酵液中L-乳酸的含量(P<0.05),而培养时间为72 h、96 h、120 h和144 h时,发酵液中L-乳酸的含量不具有显著性(P>0.05),可能是培养时间过长,菌体死亡率加大,导致微生物代谢能力降低,也可能是发酵时间过长,发酵液中的营养物质已接近消耗殆尽[20]。因此,选择最适培养时间为72 h。
2.4 响应面法优化米根霉发酵工艺条件
2.4.1 响应面试验设计及结果
在单因素试验基础上,以L-乳酸产量(Y)为响应值,选取糖化液添加量、培养时间、培养温度以及初始pH设计4因素3水平的响应面分析方法,优化L-乳酸的发酵工艺条件,响应面设计及结果见表2。
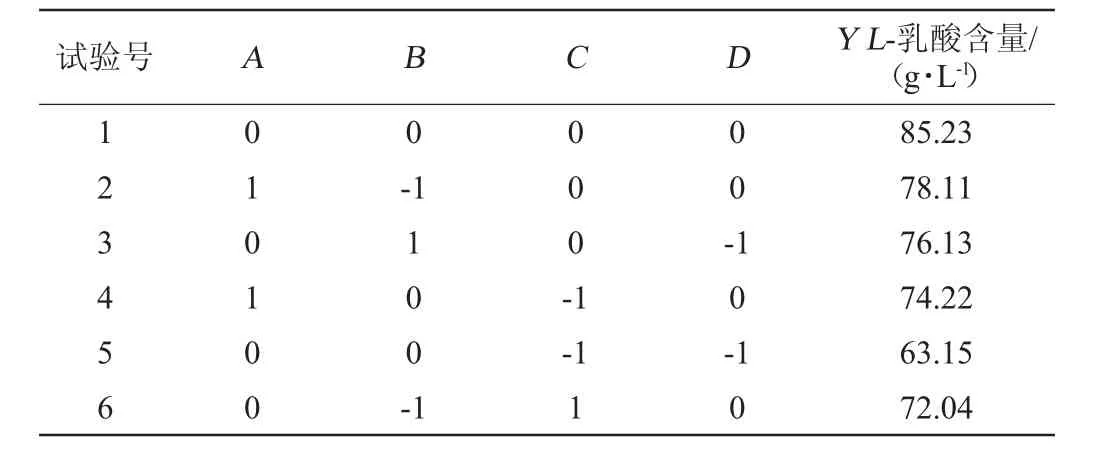
表2 米根霉发酵条件优化响应面试验设计结果Table 2 Results of response surface experiments design for Rhizopus oryzae fermentation conditions optimization
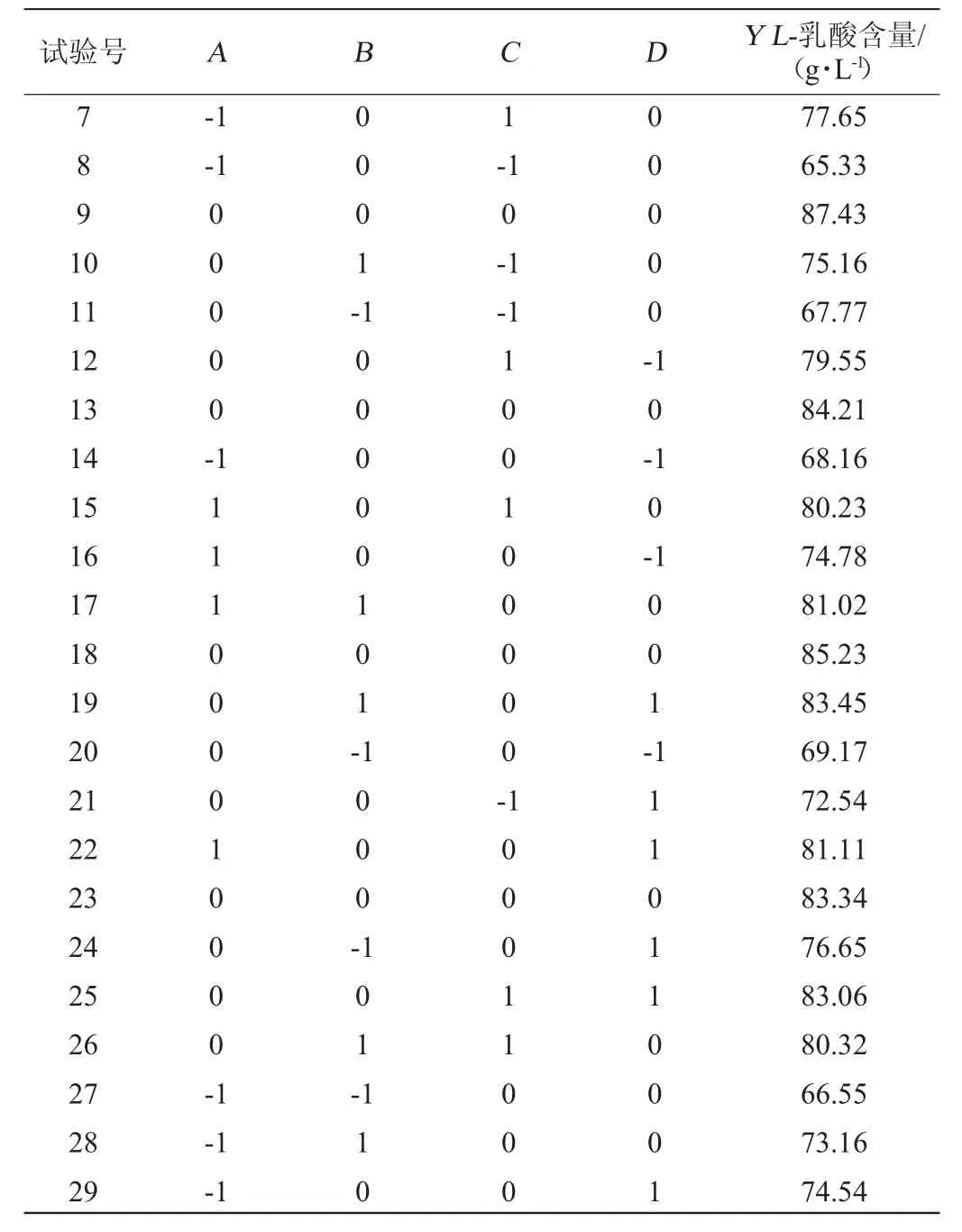
续表
2.4.2 回归模型的建立与分析

表3 回归模型方差分析Table 3 Variance analysis of regression model
利用响应面软件对表2试验数据对其进行分析,得回归方程:

通过回归模型分析响应面的回归参数(表3)可知,模型P<0.0001,说明该模型极显著;失拟项P=0.198 9>0.05,失拟项不显著;一次项(A、B、C、D)、二次项(A2、B2、C2、D2)的P值都<0.05,对结果影响显著。通过以上数据可看出,该模型拟合程度良好,可以用此模型来描述以上发酵因素与L-乳酸发酵之间的关系。
由回归方程分析可得出,4个因素对米根霉发酵L-乳酸工艺的影响从大到小的顺序依次是C(培养温度)>A(糖化液浓度)>D(初始pH)>B(培养时间);交互效应对米根霉发酵L-乳酸的影响从大到小的顺序依次是AC>CD>AB>BC>BD>AD。
该模型拟合度R2=0.94,说明试验的误差较小,拟合度良好;变异系数(coefficient of variation,CV)为2.86%,说明此模型试验的可靠性高;预测拟合度(0.71)与矫正拟合度(0.89)接近,试验性噪比为13.43。通过以上数据可得出,该模型拟合程度良好,可以用此模型来描述以上发酵因素与L-乳酸发酵之间的关系。
2.4.3 优化发酵参数和验证模型
经优化得米根霉发酵L-乳酸的理论模型预期条件为糖化液质量分数26.33%,培养时间79.58 h,培养温度28.95℃,初始pH 5.52,在此条件下,L-乳酸含量的理论值为87.35g/L。
为了验证该试验是否可行,采用优化后的试验条件进行米根霉发酵L-乳酸的验证试验,同时考虑到实际操作的可控性,将试验条件稍作修订,以修订后的试验条件(糖化液质量分数26%,培养时间80 h,培养温度29℃,初始pH 5.5)进行3次重复试验,测定出发酵液中L-乳酸含量实际平均值为84.33 g/L。
2.5 L-乳酸的生成量、残糖剩余量及葡萄糖对L-乳酸的转化率
按本试验最佳配比配制米根霉发酵培养基(糖化液添加量26%(葡萄糖含量约为118 g/L),蛋白胨6 g/L,酵母浸膏4g/L,麦芽粉10g/L,KH2PO40.3g/L,MgSO4·7H2O 0.4g/L,ZnSO4·7H2O 0.3g/L,CaCO345g/L,采用米根霉发酵L-乳酸最佳培养条件(培养时间80 h,培养温度29℃,初始pH 5.5,接种量6%)进行培养,每隔10 h取样检测绘制米根霉发酵L-乳酸发酵曲线,结果见图10。
由图10可知,木薯淀粉糖化液刚开始用于生产L-乳酸时,L-乳酸积累量很少;30 h时L-乳酸开始出现线性增长,而糖化液中葡萄糖剩余量在20 h左右也出现线性降低;至60 h时L-乳酸积累已逐渐平稳,而糖化液中葡萄糖剩余量已基本耗尽;80 h时,L-乳酸积累量最大,葡萄糖含量接近零,发酵结束。L-乳酸含量以84.33 g/L计算,整个发酵过程葡萄糖对L-乳酸的最大转化率为71.34%。

图10 培养时间对L-乳酸得率的影响Fig.10 Effect of culture time on the yield of L-lactic acid
2.6 HPLC对发酵液中L-乳酸的定性及光学纯度分析
糖化液质量浓度260 g/L时的葡萄糖含量约为118 g/L,发酵结束后L-乳酸产量为84.33 g/L,葡萄糖对L-乳酸的转化率为71.34%。将处理好的发酵液与乳酸标准溶液进行HPLC分析,乳酸混标及发酵液高效液相色谱图见图11。由图11可知,发酵液中以L-乳酸为主。采用高效液相色谱法[21]分析发酵液,得到L-乳酸的光学纯度为75.62%。选用比旋光度计测定米根霉发酵液的比旋光度,其数值为+2.12,说明发酵液中主要以L-乳酸为主,含有少量的D-乳酸。
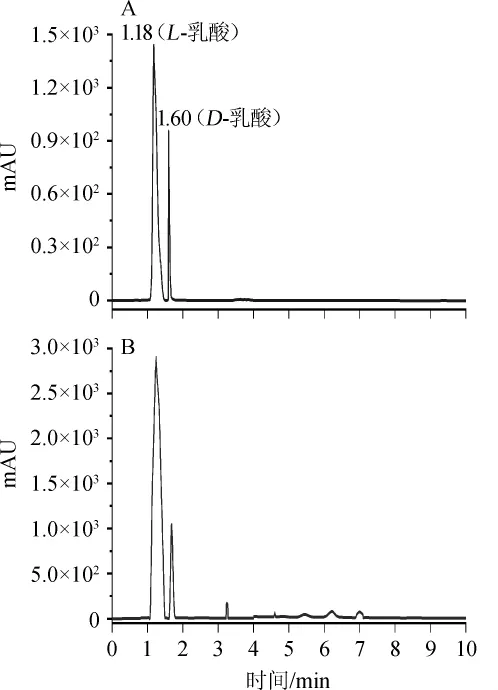
图11 乳酸混标(A)及发酵液(B)的高效液相色谱图Fig.11 HPLC chromatogram of lactic acid mixed standard(A)and fermentation broth(B)
3 结论
选取培养18 h的米根霉菌种,在响应面优化后的培养基配方(糖化液添加量26%,蛋白胨6g/L,酵母浸膏4g/L,麦芽粉10 g/L,KH2PO40.3 g/L,MgSO4·7H2O 0.4 g/L,CaCO345 g/L,ZnSO4·7H2O 0.3 g/L)和优化后的培养条件(培养时间80 h,培养温度29℃,pH 5.5,接种量6%)条件下,发酵液中L-乳酸的含量可达84.33 g/L,此时,葡萄糖对L-乳酸的转化率为71.34%。根据HPLC对米根霉发酵产物定性及光学纯度的分析,可知发酵液中L-乳酸的光学纯度为75.62%,用比旋光度计测定发酵液的比旋光度,其值为+2.12。
