柠檬明串珠菌TD1产胞外多糖条件的响应面法优化及其抗氧化性研究
2018-12-07叶广彬陈源红王长丽杨睿睿宾晓芸银联飞
叶广彬,陈源红,王长丽,杨睿睿,宾晓芸,银联飞*
(右江民族医学院,广西 百色 533000)
乳酸菌(lactic acid bacteria,LAB)是一类能够利用碳水化合物产生大量乳酸的细菌,作为公认安全的益生菌,乳酸菌具有促进肠道有益微生物的生长、缓解乳糖不耐症、降低胆固醇、抗氧化等优点,广泛应用在工业、农业、食品、医学等领域[1-2]。乳酸菌胞外多糖(expolysaccharides,EPS)是乳酸菌在生长代谢过程中发酵产生并分泌到细胞外的黏液或荚膜多糖,是一种天然高分子聚合物[3]。能够产生EPS的乳酸菌主要包括:片球菌属(Pediococcus)、肠膜明串珠菌(Leuconostoc mesenteroides)、柠檬明串株菌(Leu.citreum)、魏斯氏菌(Weissella)、干酪乳杆菌(Lactobacilluscasei)、德氏乳杆菌(Lb.delbruecckii)、瑞士乳杆菌(Lb.helveticus)、马乳酒样乳杆菌(Lb.kefiranofaciens)、嗜酸乳杆菌(Lb.acidophilus)、乳酸乳球菌(Lc.1actis)、嗜热链球菌(S.thermophilus)等[4-6]。其中20世纪40年代开发出的由Leu.mesenteroides产生的右旋糖酐是最早被开发利用的乳酸菌胞外多糖,也是美国食品药品监督管理局(food and drug admin istration,FDA)批准的第一种可用于食品的微生物EPS[7]。大量研究表明,乳酸菌胞外多糖具有降低胆固醇、抗氧化、抗肿瘤、调节消化道等特点,能够使微生物在脱水、营养缺乏、有毒物质、噬菌体、渗透压和拮抗物等不利条件下生存[8-9]。目前,乳酸菌胞外多糖已作为稳定剂、增稠剂被用于酸奶、奶酪等发酵奶制品的生产中[10]。
EPS的生物合成因菌种不同而发生在生长的不同阶段和环境条件下,按合成位点和合成模式的不同,EPS分为位于细胞壁外合成的同型多糖与位于细胞膜上合成的异型多糖,分子质量在4.0×104~6.0×106Da[11]。同型多糖的合成为不依赖C55-lipid-pp的合成模式,异型多糖的合成则为依赖C55-lipid-pp的合成模式[12]。近几十年来,由于微生物EPS在产品结构、性能及生产方面所具有的特别优势而得到大力研究和开发,新的微生物EPS的开发已成为工业微生物研究的热点之一[13]。然而国内众多学者对EPS的研究,主要集中在真菌多糖(如灵芝多糖、虫草多糖和香菇多糖等[14])。LAB作为食品级工业生产菌,与其他微生物相比安全性高。随着对LAB研究的不断深入,LAB EPS因具有益生功能逐渐引起研究者的关注[3],然而EPS产量低,菌株稳定性差,是制约其大规模生产的主要因素[15]。此外,由于LAB对生长条件较为苛刻,培养基成分较为复杂,发酵条件的微小改变都会显著影响EPS的产量。
本课题组之前从东北自然酸菜发酵液中分离得到多株高产EPS的LAB,通过一系列生物化学方法鉴定其种属地位,并利用单因素试验考察了培养基组分及培养条件对EPS产量的影响。本研究为了提高目标菌株的EPS产量,满足工业化生产需求,在单因素试验的基础上通过响应面法优化菌株产EPS能力,并探索其抗氧化性质,为该EPS的分离纯化奠定基础,为益生元特性研究提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与试剂
柠檬明串珠菌(Leuconostoc citreum)TD1:分离自东北自然发酵酸菜样品。葡萄糖、胰蛋白胨、牛肉膏、酵母提取物、K2HPO4、无水乙酸钠、柠檬酸铵、MgSO4·7H2O、MnSO4·H2O、吐温80、硫酸、苯酚、乙醇、三氯乙酸、过硫酸钾、邻苯三酚、水杨酸、亚硝酸钠、对氨基苯磺酸、盐酸萘乙二胺等(均为分析纯):天津市科密欧化学试剂有限公司。
1.1.2 培养基
初始发酵培养基:蔗糖80 g/L,酵母提取物8 g/L,牛肉膏12 g/L,蛋白胨12 g/L,无水乙酸钠6 g/L,K2HPO42 g/L,MgSO4·7H2O 0.58 g/L,MnSO4·H2O 0.25 g/L,柠檬酸铵2 g/L,吐温80 1 mL/L,121℃条件下灭菌20 min。
1.2 仪器与设备
UV-2450紫外可见分光光度计:日本岛津公司;5804R型离心机:德国Eppendorf公司;DHP-420电热恒温培养箱:天津中环实验电炉有限公司;SPX-100B-D振荡培养箱:上海博讯实业有限公司;FE20 pH计:梅特勒-托利多(上海)有限公司。
1.3 方法
1.3.1 EPS的提取
取500 mL发酵液,于4 ℃、4 000×g条件下离心60 min,取上清。上清液加入3倍体积的预冷体积分数95%的乙醇,醇沉过夜,4℃、12000×g离心40min收集多糖沉淀,用250mL超纯水30~40℃溶解多糖沉淀,加入250mL 10%三氯乙酸,充分搅拌4℃静置10 h,4℃、12 000×g离心40 min收集上清液。随后再次加入3倍体积的预冷体积分数95%的乙醇,醇沉过夜,4℃、12 000×g离心40 min收集多糖沉淀,重溶于超纯水中,装入透析袋(截留分子量14 000 Da)中,4℃透析2 d,每8 h换一次水。
1.3.2 EPS含量的测定
采用苯酚-硫酸法测定EPS的含量,将1 mL EPS样品与1 mL体积分数6%的苯酚溶液、5 mL浓硫酸溶液混匀,静置冷却至室温后,于波长490nm处测定吸光度值。以葡萄糖为标准制作标准曲线[16],根据标准曲线计算EPS的含量。
1.3.3 Plackett-Burman试验设计
Plackett-Burman(PB)试验设计是响应面试验设计的一种,用于中心组合试验之前挑选优化因素的一种试验设计方法。依据DU RP等[17]的方法,选择影响EPS产量的10个因素蔗糖(X1)、蛋白胨(X2)、Ca2+浓度(X3)、酵母提取物(X4)、无水乙酸钠(X5)、牛肉膏(X6)、初始pH值(X7)、装液量(X8)、摇床转速(X9)、培养温度(X10),以EPS产量(Y)为响应值,选取N=12的PB试验设计对影响EPS产量的10个因素的显著性进行考察,将每个因素分为高(+1)、低(-1)2个水平。PB试验设计因素与水平见表1。

表1 两水平析因试验因素与水平Table 1 Factors and levels of factorial tests with two levels
1.3.4 响应面分析试验设计
根据PB试验的结果,以EPS产量(Y)为响应值,对EPS产量的影响因素蔗糖(X1)、Ca2+浓度(X3)、无水乙酸钠(X5),进行响应面分析试验,得到最优方案。响应面试验设计因素与水平见表2。
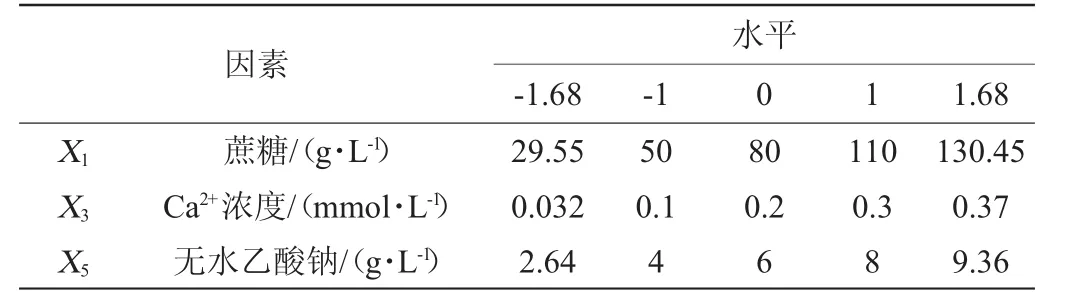
表2 菌株TD1产胞外多糖条件优化中心组合设计因素与水平Table 2 Factors and levels of central composite design for the conditions optimization of EPS production by strain TD1
1.3.5 测定方法
超氧阴离子自由基清除率:按照参考文献[18]的方法测定;羟基自由基清除率:按照参考文献[19]的方法测定;DPPH自由基清除率:按照参考文献[20]的方法测定。NO2-清除率:按照参考文献[21]的方法测定。
2 结果与分析
2.1 供试菌Leu.citreum TD1培养条件优化
2.1.1 显著因素筛选结果
在对Leu.citreum TD1产EPS单因素条件研究基础上,通过两水平析因设计筛选对产EPS影响显著的因素,试验设计及结果见表3,回归分析结果见表4。

表3 两水平析因设计试验结果Table 3 Results of factorial design tests with two levels
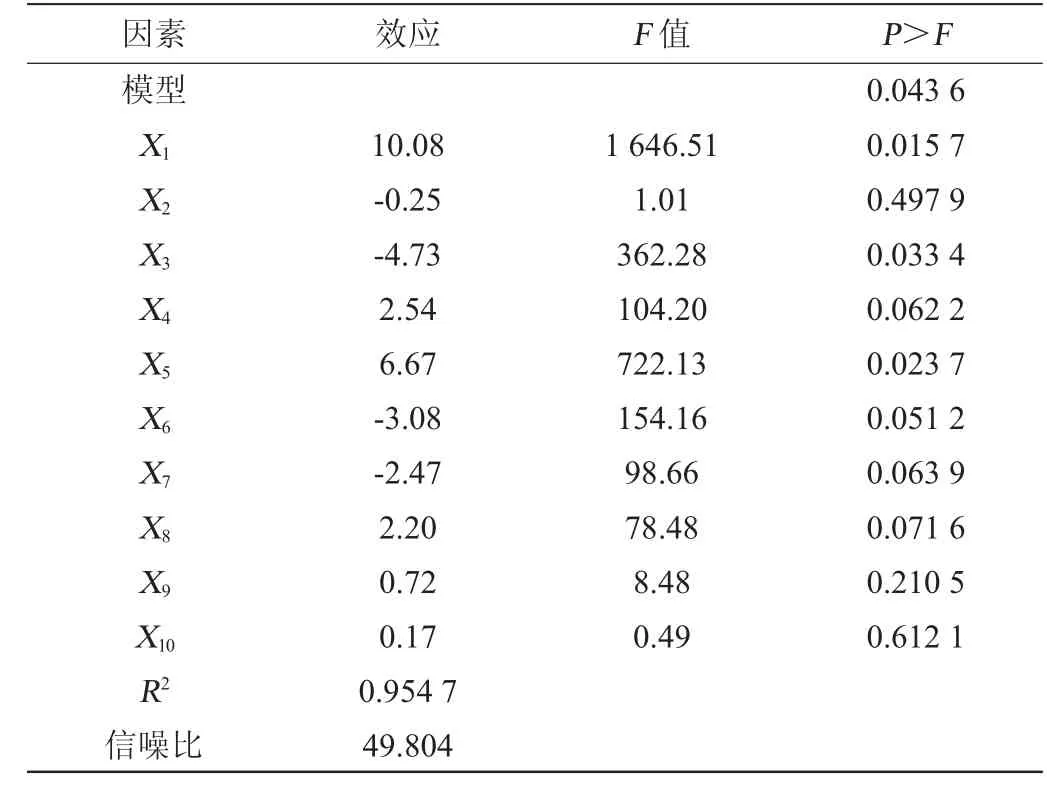
表4 两水平析因设计回归分析结果Table 4 Regression analysis results of factorial design with two levels
由表3、表4可知,两水平析因试验模型项显著(P=0.0436<0.05),R2=0.954 7,调整R2=0.996 5,二者均接近1,信噪比=49.804(>4),表明模型能够很好的拟合试验数据。各变量对响应值影响显著程度依次为X1>X5>X3>X6>X4>X7>X8>X9>X2>X10,即蔗糖(X1)、Ca2+浓度(X3)和无水乙酸钠(X5)对Leu.citreum TD1产EPS有显著影响(P<0.05)。其他变量在本研究条件下对发酵液EPS含量无显著影响。
模型拟合方程为TD1 EPS含量=19.893 33+0.503 83X1-0.062 500X2-1.181 67X3+1.267 50X4+3.336 67X5-30.833 33X6-1.233 33X7+0.110 00X8+0.361 67X9+0.034 667X9。
2.1.2 显著因素水平优化结果
菌株TD1产胞外多糖条件优化中心组合试验结果见表5,回归分析见表6。
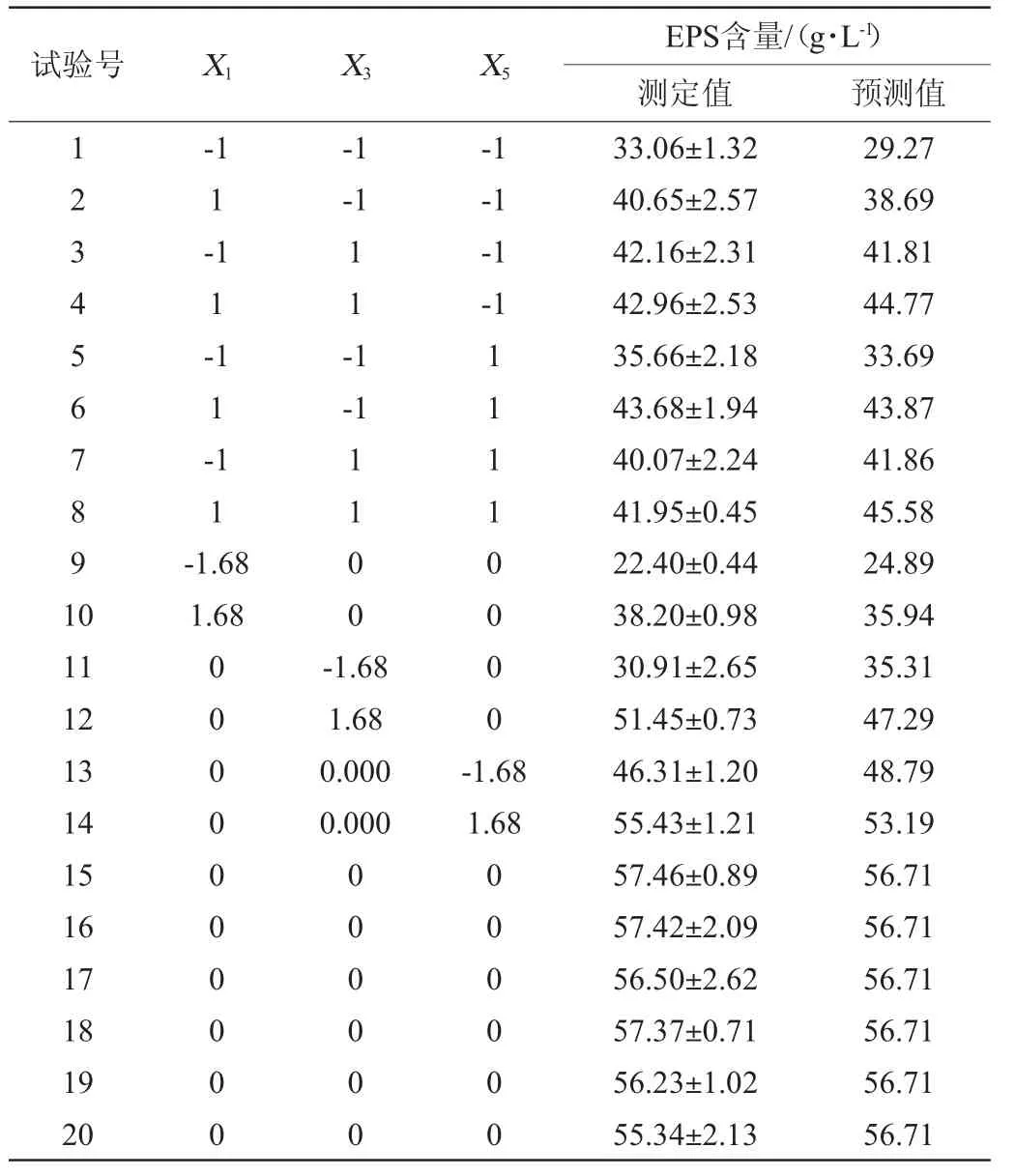
表5 菌株TD1产胞外多糖条件优化中心组合试验结果Table 5 Results of central composite tests for the conditions optimization of EPS production by strain TD1

表6 中心组合设计回归分析结果Table 6 Regression analysis results of center composite design
由回归分析(表6)可知,模型项极显著(P<0.000 1<0.05),失拟合项不显著(P=0.372 0>0.05),R2=0.948 4,调整R2=0.902 0,信噪比=33.810(>4),表明模型能够很好的拟合试验数据。X5、X1X3、X1X5、X3X5对产EPS无显著影响(P>0.05);X52对产EPS有显著影响(P<0.05);X1、X3、X12、X32对产EPS有极显著影响(P<0.01)。
各因素及交互作用对Leu.citreum TD1产EPS影响如图1所示。

图1 显著影响Leuconostoc citreum TD1产EPS的各因素交互作用响应面图Fig.1 Response surface plots of interaction of each factors significantly affecting the EPS production by Leuconostoc citreum TD1
模型拟合方程为:TD1 EPS含量(g/L)=4.83-4.83X1+0.94X3-0.36X5-1.12X1X3-4.06X1X5-0.34X3X5-6.61X12-1.89X32-1.82X52。式中二次项系数均为负值,可知方程有极大值,拟合曲面开口朝下。预测蔗糖为108.99 g/L、Ca2+浓度为0.21 mmol/L、无水乙酸钠为6.66 g/L时,TD1 EPS含量达到最大值56.60 g/L。
2.1.3 最优产TD1 EPS条件验证结果
为方便实际操作,修改培养条件为蔗糖为109 g/L、Ca2+浓度为0.2 mmol/L、无水乙酸钠为6.7 g/L,在此条件下,TD1 EPS含量为(57.58±2.04)g/mL,与预测值56.60 g/L无显著差异(P>0.05),即中心组合试验优化模型拟合性良好,结果可靠。本研究中响应面法优化后,Leu.citreum TD1产EPS水平是优化前(32.71 U/mL)的1.76倍。
2.2 供试菌Leu.citreum TD1 EPS抗氧化作用
2.2.1 对O2-·的清除作用

图2 EPS对O2-·的清除曲线Fig.2 Scavenging curve of EPS to O 2-·
由图2可知,随着TD1 EPS和维生素C(vitamin C,VC)质量浓度的增大,清除率呈现先急速升高后保持平稳的趋势,当质量浓度>0.063 2 mg/mL时,清除率提高幅度明显减小,在质量浓度为0.252 6 mg/mL时,TD1 EPS和VC对O2-·的清除率达到最大,分别为(55.23±2.18)%和(87.72±1.71)%。研究表明,O2-·是一种较弱的氧化剂,在机体中可以通过歧化作用等其他反应产生过氧化物和羟自由基,从而对机体产生一定损伤[22]。戚跃明等[23]研究EPS对O2-·清除能力发现,在质量浓度为10mg/mL时,O2-·清除率达到47.4%,显著低于本研究中的EPS清除效率(P<0.05)。由此可以看出,TD1 EPS对O2-·具有一定的清除活性,其作为添加剂可以降低机体的损伤程度。
2.2.2 对·OH的清除作用

图3 EPS对·OH的清除曲线Fig.3 Scavenging curve of EPS to·OH
由图3可知,随TD1 EPS和VC质量浓度的增加,·OH的清除率呈现先升高后趋于平缓的趋势。在质量浓度为0~0.5mg/mL时,VC对·OH的清除率始终高于TD1EPS对·OH的清除率,而质量浓度在0.5~1.0mg/mL时,TD1EPS对·OH的清除率要高于VC对·OH的清除率。当质量浓度达到1.0mg/mL时,二者对·OH的清除率分别达到(95.34±2.33)%(EPS)和(90.76±2.98)%(VC)。崔静等[24]发现ESP6对·OH具有明显的清除作用,在质量浓度为2.0 mg/mL时,清除率高达91.5%,显著低于本研究中TD1 EPS对·OH的清除作用。
2.2.3 对DPPH自由基的清除作用

图4 EPS对DPPH自由基的清除曲线Fig.4 Scavenging curve of EPS to DPPH radicals
由图4可知,随TD1 EPS和VC质量浓度的增加,DPPH自由基清除率逐渐上升,且呈现一定的量效关系。当EPS和VC的质量浓度为1.0 mg/mL时,DPPH自由基清除率分别达到(56.61±3.09)%和(87.54±2.17)%。而相较于VC,TD1 EPS的DPPH自由基清除率相对较弱。DPPH是一类较为稳定的合成自由基,其稳定性主要源于共振稳定作用及苯环的空间障碍作用。若能将DPPH清除,则表明受试化学物质具有较强的自由基清除能力。张玉龙等[25]研究不同种类ESP对DPPH的清除能力时发现,当ESP质量浓度为1.0 mg/mL时,其对DPPH的清除率为33.53%~41.92%,低于本研究中EPS对DPPH自由基清除率。TD1 EPS具有DPPH自由基有清除能力可能是由于多糖中的羟基具有供氢质体能力的结果。
2.2.4 对NO2-的清除作用

图5 EPS对NO2-的清除曲线Fig.5 Scavenging curve of EPS to NO 2-
硝酸盐在酸性条件下可转变成的亚硝酸,亚硝酸具有较强的氧化性,可将血液中的二价铁离子氧化成三价铁离子,进而使血红蛋白转变成高铁血红蛋白,失去结合氧的能力,从而引起组织缺氧,急性中毒[26]。此外,亚硝酸可与胺类物质反应,生成具有强致癌作用的亚硝基胺类化合物,诱发人消化道癌等疾病。尤其是在发酵食品中,亚硝酸盐的控制十分重要。大量研究表明,在食品(如酸菜)发酵过程中添加VC,可以有效地降解亚硝酸盐,提高发酵制品的安全性[27]。由图5可知,在浓度较低的情况下,NO2-的清除率与TD1 ESP浓度呈现正相关,但清除率均小于VC。在质量浓度为0.5 mg/mL时,NO2-的清除率分别为(5.32±0.18)%(TD1 EPS)和(10.89±2.11)%(VC)。之后,随着浓度的升高,NO2-的清除率升高较为缓慢。因此可以看出,TD1 EPS对亚硝酸盐具有一定的清除能力,在作为添加剂替代VC用于食品发酵上具有潜在的应用价值。
3 结论
本研究以Leu.citreum TD1为供试菌株,采用响应面方法通过三步试验设计的优化菌株产EPS条件。首先,两水平析因试验设计结果表明,蔗糖、Ca2+和无水乙酸钠对Leu.citreum TD1产EPS有显著影响。然后,中心组合设计预测培养基中蔗糖为109 g/L、Ca2+为0.2 mmol/L和无水乙酸钠为6.7 g/L时,EPS含量达到最大值56.60 g/L。在此优化条件下,TD1 EPS含量为(57.58±2.04)g/L,是优化前(32.71 g/L)的1.76倍。TD1 EPS对超氧阴离子自由基、羟基自由基、DPPH自由基和NO2-均具有良好的抗氧化活性,清除效率随着浓度的增加而增强,最高分别为(55.23±2.18)%、(95.34±2.33)%、(56.61±3.09)%和(5.32±0.18)%。因此,Leu.citreum TD1发酵得到的EPS作为天然抗氧化剂具有广阔的应用和开发前景。
