副猪嗜血杆菌河南流行株的分离鉴定及分型
2018-12-07李新果史志斌赵小月王玉国时庆贺
李新果,史志斌,张 磊,赵小月,王玉国,石 昂,时庆贺,陈 陆
(河南农业大学 牧医工程学院,河南 郑州 450002)
副猪嗜血杆菌(Haemophilusparasuis, HPS)在中国、澳大利亚、美国、英国等世界多国普遍流行,主要引起猪的多发性浆膜炎、关节炎和脑膜炎,临床上多与PRRSV、PCV-2等混合感染,给养殖业带来巨大损失,已经成为危害养殖业的重要细菌性病原[1-4]。HPS血清型众多,且在地域和时间上存在差异,中国主要流行的血清型为4、5、7、13型和不可分型(NT)[5]。因此,对不同时间、不同区域的HPS分离鉴定,尤其是对分离株血清型鉴定,对预防HPS至关重要。
目前,基因分型法成为鉴定HPS血清型的主要方法。常用的基因分型法为多重PCR分型法,与过去常用的分型方法琼脂扩散试验相比,方便快捷且不易受外界因素干扰,可提高对不可分型菌株的鉴别[4-7]。
为了解HPS在河南省的感染和流行情况,对2017—2018年河南省不同地区养殖场的送检疑似病料,进行HPS分离鉴定及血清学分型,旨在为副猪嗜血杆菌病的预防和治疗提供参考。
1 材料和方法
1.1 材料
1.1.1 病料 于2017年1月—2018年1月,采集来自南阳、新乡、商丘、焦作、鹤壁、洛阳、开封、登封等地区的10个大型养殖场的疑似病猪脾脏、肺脏、关节、肝脏和脑组织病料,共45份。
1.1.2 主要试剂 巧克力琼脂平板、麦康凯琼脂平板为郑州安图生物工程有限公司产品;胰蛋白胨大豆肉汤培养基(TSB)为美国BD公司产品;烟酰胺腺嘌呤二核苷酸(NAD)为Sigma公司产品;新生犊牛血清为浙江天杭生物科技有限公司产品;TaqDNA 聚合酶、DL1000 DNA Marker为大连宝生物工程有限公司产品。
1.1.3 标准菌株 SH0165株由华中农业大学馈赠,金黄色葡萄球菌阳性菌株由河南农业大学传染病实验室保存。
1.1.4 引物 参照Oliveira等[8]的方法,根据HPS 16S rRNA (M75065)的基因序列设计种特异性鉴定引物F/R。
F:5′-GTGATGAGGAAGGGTGGTGT-3′,R:5′-GGCTTCGTCACCCTCTGT-3′。预期扩增的片段大小为821 bp。参照Howell等[6]和Jia等[7]的报道,合成用于鉴定HPS血清型的引物(表1)。引物由生工生物工程(上海)技术服务有限公司合成。
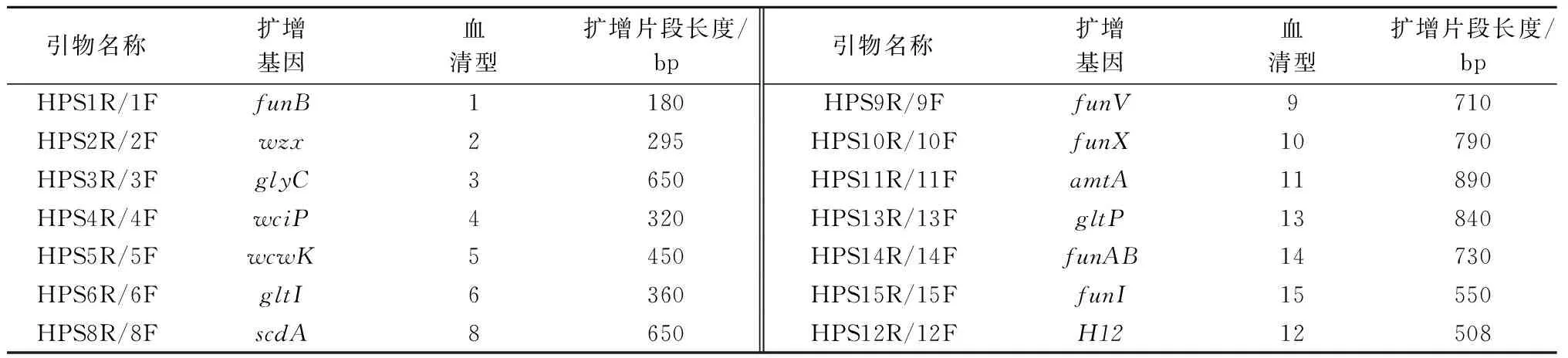
表1 HPS血清型鉴定多重PCR引物及扩增目的基因片段大小
1.2 方法
1.2.1 病原菌的分离培养 剖检疑似病猪,无菌条件下取肝脏、肺脏、脾脏、胸膜积液和关节液等病料,接种于巧克力琼脂平板上,37 ℃培养24~48 h。无菌条件下挑取光滑圆润、无色透明的露珠样菌落进行革兰氏染色,镜检,并挑取镜检可疑的单个菌落,再次接种巧克力琼脂平板纯化,备用。
1.2.2 病原菌DNA提取及PCR鉴定 挑取纯化后的单菌落,溶于30 μL单蒸水中,混匀后,煮沸法提取细菌基因组DNA[9]。PCR扩增方法按Oliveira等[8]的方法进行。
1.2.3 病原菌卫星试验 将PCR检测HPS为阳性的可疑菌落水平划线于绵羊鲜血麦康凯琼脂平板上,再挑取金黄色葡萄球菌垂直于水平线划线,37 ℃培养24~48 h,观察是否出现卫星生长现象。
1.2.4 病原菌血清型鉴定 根据Howell等[6]和Jia等[7]建立的多重PCR方法,鉴定HPS的血清型。煮沸法制备待测菌株基因组DNA,按照表1的引物进行PCR扩增,PCR反应体系为25 μL:TaqDNA聚合酶12.5 μL,ddH2O 8.5 μL,上游引物1 μL,下游引物1 μL,待检DNA 2 μL。PCR反应程序为:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火45 s,72 ℃延伸30 s,共30个循环;最后72 ℃延伸10 min。取PCR产物8 μL,80 V电压2%琼脂糖凝胶电泳1 h,AlphaImager Ep型成像仪拍照保存。
2 结果与分析
2.1 病原菌的分离培养结果
将病料接种于含NAD的巧克力琼脂平板,37 ℃培养48 h后,观察到1~2 mm左右针尖大小、灰白色半透明、圆润的菌落(图1)。单个菌落涂片进行革兰氏染色后在显微镜下观察,结果为革兰氏阴性细小杆菌,有细长、杆状的菌体(图2)。

图1 病原菌在巧克力琼脂平板的菌落形态
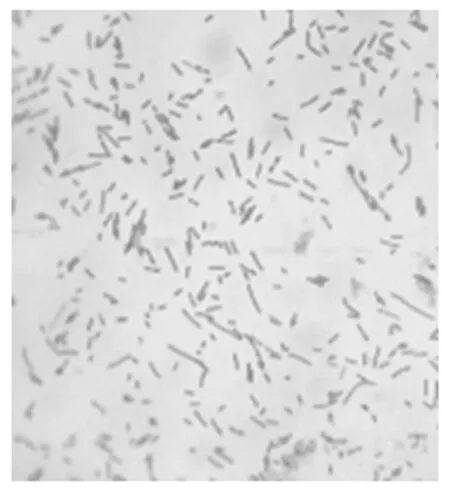
图2 病原菌革兰氏染色镜检结果(1 000×)
2.2 病原菌PCR鉴定结果
对2.1中筛选获得的12株疑似HPS菌株的16S rRNA基因进行PCR扩增,12株菌株均能扩增出预期821 bp的目的条带,且与标准株SH0165位置一致(图3),鉴定为HPS阳性,初步确定为HPS。
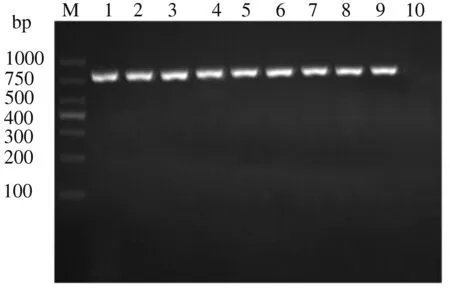
M:DL1000 DNA Marker; 1:LY-1株; 2:ZJ-1株;
2.3 病原菌卫星试验结果
分离HPS菌株离金黄色葡萄球菌菌苔越近的菌落长势越好,越远的菌落越小甚至未出现菌落,呈卫星生长现象(图4)。
2.4 病原菌多重PCR鉴定血清型结果
对HPS LY-1、NY-1株等12株分离株进行血清型鉴定,结果见图5。由图5可知,HB-1、XX-3株扩增出约180 bp的目的片段,与funB基因大小一致,鉴定为血清1型;XX-4株扩增出约295 bp的目的片段,与wzx基因大小一致,鉴定为血清2型;JZ-1株扩增出约320 bp的目的片段,与wciP基因大小一致,鉴定为血清4型;LY-1、KF-1、DF-1、XX-2株扩增出约450 bp的目的片段,与wcwK基因大小一致,鉴定为血清5型;XX-1、SQ-2株扩增出约490 bp的目的片段,与funQ基因大小一致,鉴定为血清7型;NY-1株扩增出约840 bp的目的片段,与gltP基因大小一致,鉴定为血清13型。SQ-1株未能扩增出任何片段,鉴定为不可分型(NT)。HPS分离株详细信息见表2。

1:金黄色葡萄球菌;2:HPS

M:DL1000 DNA Marker; 1:HB-1株; 2:XX-4株;

表2 病原菌分离株命名、来源、血清分型
3 结论与讨论
HPS是一种革兰阴性细菌且具有宿主特异性,是猪革拉瑟氏病的病原菌,在临床上常引起以多发性浆膜炎、关节炎和脑膜炎为特征的全身感染性疾病[10-11]。近年来,由HPS感染导致猪革拉瑟氏病的发病率和死亡率显著上升,给养猪业造成巨大的经济损失。猪革拉瑟氏病在临床诊断中十分常见,但其病原菌的分离比较困难,原因主要有以下3个方面:病料方面,从病料中分离该菌的最佳时间是12 h内,但临床分离一般都会超过最佳分离时间,所以不易分离病原菌,且病料采集部位也会影响分离率; HPS生长特性方面,该菌生长条件严苛,培养基中必须添加NAD和血清才能生长,培养48 h菌落才明显可见,且在分离培养时,易被其他细菌掩盖或污染,导致分离失败;临床药物使用方面,临床上对于副猪嗜血杆菌病的防治大多会使用抗生素,对于使用过抗生素的病猪,更不易分离病原菌。本研究针对以上原因,采取了以下方法分离HPS,采集HPS易感染的肺支气管和淋巴结等部位的新鲜病料,并且分离时要避免污染;分离培养时,初步分离使用巧克力琼脂培养基,挑取灰白色圆润针尖状菌落进行纯化,纯化后镜检再进行PCR扩增鉴定。
HPS经典血清型分型方法是琼脂扩散试验,但由于阳性血清不易制备,不可分型比率高,所以逐渐被多重PCR分型方法取代。Ma等[5]在2016年运用多重PCR方法和琼脂扩散法对中国分离株进行血清型分型,两者分型结果一致,主要流行菌株血清型是4、5、7、13、NT型(不可分型),且多重PCR分型方法明显降低NT的比率。Jia等[7]在2017年运用经典分型法和多重PCR分型法对2007—2015年南方HPS分离株进行血清型鉴定,结果表明,这2种方法鉴定的主要流行血清型结果一致,南方流行血清型为2、4、5、12、13、NT型。魏兴良[11]等于2013年对四川省HPS进行分离鉴定,结果显示,四川存在血清型有4、5、10、12、13、NT型。王乐[3]研究表明,河南省2010—2012年流行菌株血清型是4、5、12、13、14型。本研究分离的HPS血清型为1、2、4、5、7、13型,其中1型、5型和7型为主要血清型,与2016年国内流行菌株相比,河南省存在血清型1型和2型,与2014年河南省流行趋势相比,5型依旧为主要血清型,但也存在差异,强毒血清型1型为新增流行血清型,中等毒力血清型2型,不致病血清型7型也都存在。本研究结果表明,除5型外,1型可能为河南省HPS血清型新的流行趋势。近几年,血清7型的临床分离率也逐渐升高[12-13],Ma等[5]从发生副猪嗜血杆菌病的临床病例中分离到了血清7型,之前研究表明,血清7型为不致病血清型,其致病特性有待进一步研究[12]。
本研究从河南省采集的病料中成功分离12株HPS,血清型分别是1、2、4、5、7、13、NT型,不同地区血清型不同,证实了HPS血清型存在区域性,提示要针对本地区流行菌株的血清型使用对应的疫苗,从而进行有效的预防和治疗。
