母源性长链非编码RNA Six2a-OT参与斑马鱼胚胎发育调控
2018-12-06景新星宋佳坤范纯新
景新星,宋佳坤,范纯新*
(1.上海海洋大学海洋生物系统和神经科学研究所,中国上海201306;2.海洋动物系统分类与进化上海高校重点实验室,中国上海201306;3.水产科学国家级实验教学示范中心,中国上海201306;4.水产动物遗传育种中心上海市协同创新中心,中国上海201306)
Six基因家族是果蝇SO(Sine oculis)的一类同源基因,可分为3个亚家族:Six1/2、Six3/6和Six4/5。它们在脊椎动物基因组中形成两个排布高度保守的基因簇:Six2-Six3和Six4-Six1-Six6[1]。Six家族成员作为一类重要的转录因子参与多个器官的发育,如Six1/2与头部神经基板的形成密切相关,参与脊椎动物内耳、肌肉以及鱼类侧线的发育;Six3/6参与视网膜的发育[2,3]。与Hox基因簇相似,Six基因簇内基因的表达与其染色体的位置密切相关[1]。虽然有文献指出染色质的精确三维结构对于Six基因簇内基因的表达具有调控作用[4],但是否存在其他调控方式的参与尚不完全清楚。
长链非编码RNA是近些年发现的一类重要的RNA分子,其长链可以形成类似于蛋白质结构的复杂空间结构,可以通过多种形式在转录或转录后水平上调控蛋白质编码基因的表达[5]。多个物种的研究显示长链非编码RNA的表达具有组织特异性,同时功能研究提示其与个体发育和疾病密切相关[6~8]。Rinn 等[9]发现Hox基因簇中存在多个长链非编码RNA,其中来自HoxC基因簇的HOTAIR通过与PcG(polycomb group)蛋白结合调控HoxD基因簇的基因表达。在鸡、小鼠和人类的Six基因簇中也发现了多个长链非编码RNA,它们都可以通过对Six基因簇基因的表达调控,参与视网膜或肌肉发育[10,11]。
本研究在UCSC(The University of California Santa Cruz)Genome Browser斑马鱼基因组数据库中发现,Six2a-Six3a基因簇旁存在一个长链非编码RNA——Six2a-OT,进而采用qPCR(real-time quantitative PCR)方法检测其在斑马鱼性腺组织和胚胎早期的表达水平,并用整胚原位S交(wholemountin situhybridization,WISH)技术检测其在胚胎早期的表达模式,最后用特异morpholino阻断Six2a-OT的成熟剪切,以探究Six2a-OT的特征和功能。以上研究为理解Six基因簇的表达调控提供了重要数据。
1 材料和方法
1.1 实验材料
本研究所用斑马鱼是野生型AB品系,养殖条件为室温26℃、14 h/10 h(明/暗)光周期。斑马鱼胚胎养在28.5℃恒温培养箱中。胚胎分期和成体斑马鱼器官的解剖参考已有文献报道的方法[12,13]。斑马鱼胚胎根据形态发育而分期,本研究主要在胚胎1细胞期(1-cell)、胚胎受精后6 h(6 hours post-fertilization,6 hpf)、胚胎受精后24 h(24 hours post-fertilization,24 hpf)和胚胎受精后48 h(48 hours post-fertilization,48 hpf)时分别提取总RNA和固定胚胎。同时选取6月龄成年斑马鱼性腺作为研究性腺表达的实验材料。
1.2 RNA提取和cDNA合成
分别解剖雌雄成体斑马鱼(5~6月龄)各3~4尾,并分离卵巢和精巢。收集1-cell、6 hpf、24 hpf和48 hpf的胚胎,每个发育时期分别收集50枚。各个样品中分别加入TRIzol(Invitrogen公司,美国)充分裂解组织或胚胎,采用“一步法”提取各样品的总RNA。总RNA经过DNaseⅠ(无RNase,美国Thermo Scientific公司)消化基因组DNA后,再利用反转录试剂盒(SuperScript域First-Strand Synthesis for RT-PCR,美国Invitrogen公司)将各个RNA反转录为cDNA,具体操作步骤参照试剂盒说明书。
1.3 Six2a-OT的克隆和鉴定
首先,根据UCSC数据库中长链非编码RNA基因(BX537274.1)的序列设计跨内含子的引物(表1),其中引物Six2a-OTF2、Six2a-OTR2 分别匹配该基因第一外显子和第四外显子序列。然后,以卵巢cDNA为模板,利用2×EasyTaq PCR Super Mix(北京全式金生物技术有限公司)进行PCR扩增,将得到的PCR产物送生工生物工程有限公司进行测序。最后,将序列通过UCSC数据库中斑马鱼基因组进行BLAT比对。

表1 本研究所使用的引物序列Table 1 Primer sequences used in this study
1.4 qPCR
根据BX537274.1的全外显子序列设计qPCR的引物Six2a-OTF1/R1,引物详细信息见表1。以斑马鱼不同组织、胚胎各时期以及不同处理后的cDNA作为模板,采用SYBR FAST Universal qPCR Kit(KAPA公司,美国),在ABI 7500 Real-Time qPCR仪上进行实时定量PCR反应:95℃预变性3 min;95℃变性5 s,60℃退火/延伸30 s,40个循环。每个待检基因设置3个平行,并用Elfα基因作为内参来对数据进行标准化处理[14]。利用公式:相对表达量=2-ΔΔCt,计算待检基因的相对表达量,实验数据处理方法参见已有文献报道[15],用ttest对两基因间相对表达量进行差异显著性分析。
1.5 整胚原位S交
我们以cDNA为模板,PCR扩增出BX537274.1基因的片段,然后将之克隆至pGEM-T载体(美国Promega公司)。重组质粒扩增后,送生工生物工程股份有限公司测序验证其序列的正确性。以线性化的质粒为模板,利用T7 RNA Polymerase(美国Invitrogen公司)合成地高辛标记的反义RNA探针,并用RNA纯化试剂盒(RNA Clean&Concentrator TM-25,美国Zymo Research公司)纯化探针。
斑马鱼的整胚原位S交实验参考已有文献方法[16]。首先,斑马鱼胚胎用4%多聚甲醛(paraformaldehyde,PFA,V/V)于4℃固定过夜,经甲醇脱水保存于-20℃冰箱中。然后,样品经过梯度复水至 PBST(PBS pH 7.4,含0.1%Tween20,V/V),使用10%H2O2(V/V)对24 hpf往后的胚胎进行脱色素处理。利用10 μg/mL蛋白酶K于室温孵育增加胚胎细胞的通透性,孵育时间参照文献方法进行,即48 hpf斑马鱼胚胎处理15 min[16]。预S交和S交在65℃完成,然后依次经过非特异结合、探针S交、探针回收及漂洗、封闭液封闭、抗体孵育、漂洗等步骤,最后用碱性磷酸酶底物四唑硝基蓝(5-bromo-4-chloro-3-indolyl phosphate/tetranitroblue tetrazolium chloride,NBT/BCIP)显色。待充分显色后终止显色反应,并将样品浸泡于100%甘油过夜,最后在解剖镜下拍照。
1.6 反义吗啡啉的显微注射
我们在长链非编码RNA BX537274.1的第三外显子和第三内含子交界处设计特异性反义吗啡啉(morpholino,美国Gene Tools公司)来阻断其剪接。Morpholino设计及实验方法参见已有文献报道[17]。
该反义吗啡啉(Six2a-OT Mo)的序列为5′-G-′(虚下划线:内含子;实下划线:外显子)。将0.5 mmol/L的反义吗啡啉注射到刚受精单细胞胚胎的卵黄中,每颗胚胎中注射1.4 nL。为了排除注射morpholino的非特异性毒性,我们用随机序列的吗啡啉(standard control morpholino,Standard Mo)作为阴性对照。
2 结果
2.1 Six2a-OT基因特异性表达于卵巢
通过分析UCSC斑马鱼2014年数据库(GRCz10/danRer10),我们发现在Six2a-Six3a基因簇上存在一个长链非编码RNA(BX537274.1)。为验证该非编码RNA确实存在,我们在第一外显子和第四外显子上设计一对引物(Six2a-OTF2/R2,见表1),以卵巢cDNA为模板进行PCR扩增。利用UCSC中BLAT工具比对Six2a-OT的PCR产物测序结果发现,该序列完美匹配到斑马鱼第13号染色体的BX537274.1上,覆盖其第一外显子、第二外显子和第三外显子全部序列以及部分第四外显子(图1B)。BX537274.1剪接前全长137 837 bp,其中第一外显子、第二外显子和第三外显子位于Six2a基因的上游,第四外显子位于Six3a的上游(图1A)。上述结果表明:该长链非编码RNA BX-537274.1确实以成熟RNA的形式存在于斑马鱼的卵巢组织中。根据长链非编码RNA的命名规r[18],将其命名为Six2a-OT(Six2aoverlappingtranscript)。

图1 Six2a-Six3a亚簇、Six2a-OT基因(A)及Six2a-OT基因PCR产物(B)示意图Fig.1 The map of Six2a-Six3a subcluster,Six2a-OT gene(A)and its PCR product(B)
数据库中显示该长链非编码RNA是在卵巢中发现的,我们利用qPCR检测Six2a-OT在雌雄成体斑马鱼性腺中的表达情况。结果显示:Six2a-OT在卵巢中的表达量显著高于精巢(t-test,P<0.001),而且这种表达差异有10倍以上(图2)。这暗示Six2a-OT基因可能参与了卵巢发育或卵子形成。
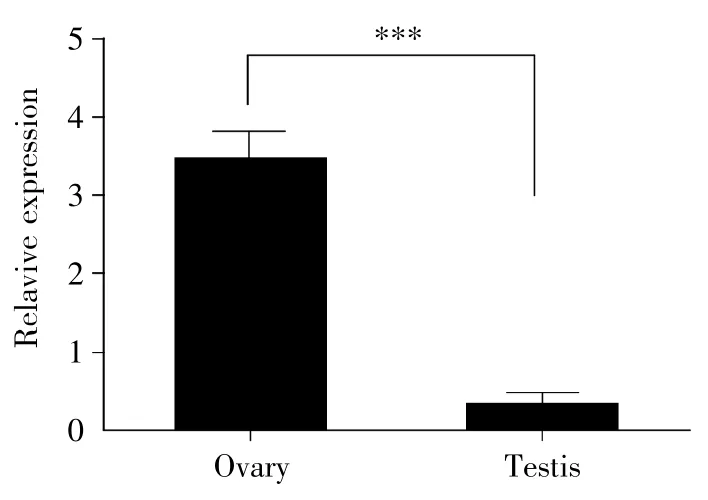
图2 Six2a-OT在成年雌雄斑马鱼性腺中的差异表达***:差异极显著;数据表现为均值±标准误;实验重复3次。Fig.2 Differential expression of Six2a-OT in gonads of adult female and male zebrafish***:The difference is extremely significant.The data are shown as±s.The experiment was repeated three times.
2.2 Six2a-OT基因在胚胎发育早期高表达
Six2a-OT基因特异地表达于卵巢,推测其很可能通过母源性因子参与早期发育。因此,我们分别选取了胚胎 1-cell、6 hpf、24 hpf和 48 hpf几个时间点,利用qPCR检测了Six2a-OT基因在野生型斑马鱼胚胎发育早期各阶段的表达。结果显示Six2a-OT基因在胚胎1-cell和6 hpf表达较强,而在24 hpf和48 hpf仅有极微弱的表达,其中胚胎1-cell的表达量显著高于24 hpf和48 hpf的表达量(t-test,P<0.001,图3)。另外,相对1-cell,胚胎6 hpf的表达也表现出下降趋势。

图3 Six2a-OT在斑马鱼胚胎早期阶段的差异表达***:差异极显著;数据表现为均值±标准误;实验重复3次。Fig.3 Differential expression of Six2a-OT in the early stage of zebrafish embryos***:The difference is extremely significant.The data are shown as ±s.The experiment was repeated three times.
2.3 Six2a-OT的时空表达模式
为了进一步了解Six2a-OT基因在胚胎发育中的时空表达,我们进行了原位S交实验。结果显示:在1-cell(受精卵)和6 hpf(原肠胚早期),Six2a-OT在胚胎的所有细胞中强烈表达,无明显特异性,但卵黄中无信号;在24 hpf(分节期),Six2a-OT的表达也无特异性,广泛表达于整个胚胎;在48 hpf(出膜期),Six2a-OT特异性表达于耳囊、躯干中线和鳃弓等部位(图4)。综合qPCR和原位S交结果表明:Six2a-OT在斑马鱼原肠胚之前强烈的非特异性表达;在胚胎受精后48 h表达下降,且呈现组织特异性表达。
2.4 Six2a-OT敲低l成发育缺陷
前面的表达分析提示,Six2a-OT的表达具有组织特异性和发育上的动态性,那么它是否参与胚胎发育,在胚胎发育中具有何种作用?考虑到Six2a-OT行使作用的机制尚不完全清楚,目前还无法像mRNA那样,通过CRISPR技术插入或缺失少量碱基产生移码,进而使其失活。Morpholino是一种稳定的、可以与DNA或RNA单链配对结合的寡聚分子,常用于阻断mRNA的翻译和剪接。因此,我们设计了能够特异结合Six2a-OT的第三外显子和第三内含子序列边界的反义聚合物Six2a-OT Mo(图5)。注射Six2a-OT Mo后,在胚胎48 hpf对其形态进行观察,发现约有63%的斑马鱼呈现明显的发育畸形,如躯干短小并伴有侧弯、腹腔肿大(心包积水)等表型特征;而注射随机吗啡啉(Standard Mo)的斑马鱼胚胎无异常表现,表明注射Six2a-OT Mo产生的表型是特异的(图6)。

图4 Six2a-OT在斑马鱼胚胎早期的时空表达模式b:鳃弓;e:眼睛;h:后脑;m:中脑;o:耳囊;p:头肾;t:躯干中线;s:脊柱;标尺:450 μm。Fig.4 Spatio-temporal expression pattern of Six2a-OT in the early embryo of zebrafishb:Branchial arch;e:Eye;h:Hindbrain;m:Middle brain;o:Otic vesicle;p:Pronephros;t:Trunk midline;s:Spinal.Scale bar=450 μm.

图5 Morpholino(Six2a-OT Mo)阻断Six2a-OT的剪切位点Fig.5 Morpholino(Six2a-OT Mo)blocking the splicing site of Six2a-OT
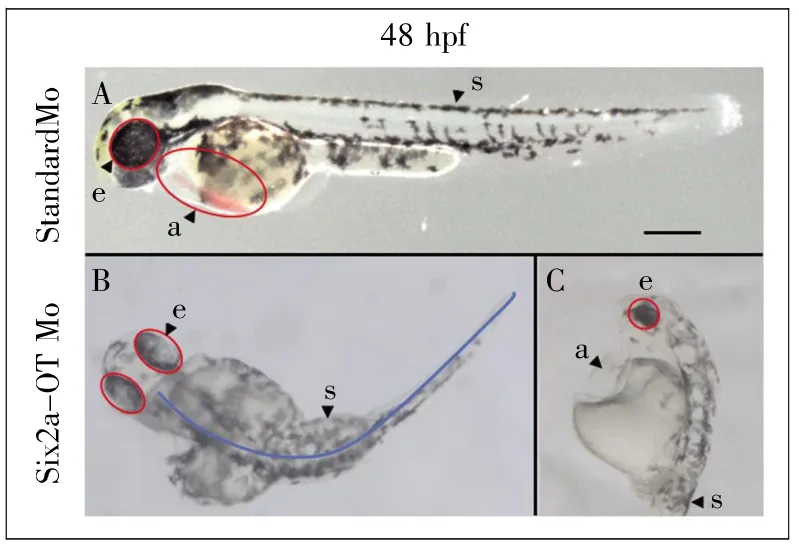
图6 显微注射Six2a-OT Mo和Standard Mo的胚胎发育表征(标尺:500 μm)A:注射Standard Mo的斑马鱼胚胎(48 hpf);B、C:注射Six2a-OT Mo 的斑马鱼胚胎(48 hpf)。 a:心腔;e:眼睛;s:脊柱。Fig.6 Characterization of embryonic development by microinjection of Six2a-OT Mo and Standard Mo(scale bar=500 μm)A:The 48 hpf embryo of zebrafish after microinjection with Standard Mo;B,C:The 48 hpf embryo of zebrafish after microinjection with Six2a-OT Mo.a:Atrium;e:Eye;s:Spinal.
为了检测Six2a-OT Mo是否有效地敲低了Six2a-OT,我们利用qPCR(引物Six2a-OTF1结合Six2a-OT基因的第一外显子,引物Six2a-OTR1结合Six2a-OT基因的第二外显子)检测了吗啡啉注射后胚胎中Six2a-OT基因的表达量。结果显示:与Standard Mo注射组比较,注射Six2a-OT Mo后Six2a-OT的表达显著下降(t-test,P<0.001),下降程度超过1/2(图7)。以上结果表明Six2a-OT Mo在胚胎中发挥了特异性作用。
2.5 敲低Six2a-OT导致Six2a和Six3a表达下降
为进一步探讨Six2a-OT敲低产生胚胎缺陷的机制,我们需要了解吗啡啉注射后,胚胎中哪些基因受到了影响。因Six2a-OT与Six2a-Six3a基因簇在基因组上彼此重叠,所以我们首先需要知道Six2a-OT是否参与Six2a-Six3a基因簇中Six2a和Six3a的表达调控。基于此,我们利用qPCR分别检测了注射Six2a-OT Mo和Standard Mo后,Six2a和Six3a的表达情况。结果显示:在注射Six2a-OT Mo后Six2a和Six3a的表达均显著下降(t-test,P<0.001,图 8)。这表明Six2a-OT很可能通过调控Six2a和Six3a的表达发挥作用。

图7 Six2a-OT的表达量被Six2a-OT Mo成功敲低***:差异极显著;数据表现为均值±标准误;实验重复3次。Fig.7 Inhibition of Six2a-OT expression by Six2a-OT Mo***:The difference is very significant.The data are shown as ±s.The experiment was repeated three times.

图8 注射Six2a-OT Mo的24 hpf胚胎中Six2a和Six3a的表达量显著性降低***:差异极显著;数据表现为均值±标准误;实验重复3次。Fig.8 Decreased expression of Six2a and Six3a in 24 hpf embryos injected with Six2a-OT Mo***:The difference is very significant.The data are shown as ±s.The experiment was repeated three times.
3 讨论
本研究在斑马鱼中发现了一个新的母源性长链非编码RNA——Six2a-OT,并对它的表达模式及其在胚胎发育中的功能进行了研究。qPCR和原位S交结果都显示Six2a-OT在单细胞期和早期原肠胚期表达量最高,随后显著下降。这充分说明Six2a-OT是以母源性因子的形式发挥作用。其中,原肠胚后表达的下降可能与中期囊胚转换阶段母源性因子的降解有关[19]。在胚胎的24 hpf期,qPCR显示Six2a-OT表达显著下降,而原位S交的信号遍布整个胚胎。在48 hpf期胚胎中,Six2a-OT的表达呈现组织特异性,集中表达在胚胎的鳃弓、耳囊和躯干中线,这与反义吗啡啉阻断Six2a-OT剪接l成的特异性表型相一致。
近年有多个研究指出非编码RNA可以参与特定组织的早期发育。我们在本研究中使用反义吗啡啉特异阻断Six2a-OT的剪接,l成Six2a-OT表达量的下降,由此产生躯干变短、弯曲和心包积水的缺陷表型。同时我们还发现阻断Six2a-OT的剪接可导致Six2a和Six3a基因表达的下降。已有研究表明:多个Six家族基因参与肌肉和骨的发育[20,21]。躯干中线结构与体节的发育密切相关,体节将发育形成躯干的椎骨和轴肌等结构。鳃弓r可以发育形成下颌和心脏等结构[22,23]。结合Six2a-OT在48 hpf胚胎中的特异性表达,我们推测Six2a-OT可以通过促进Six2a和Six3a的表达,参与斑马鱼躯干和鳃弓的发育。
Six基因簇在个体发育和疾病中发挥重要作用,它们的表达受到严格的调控[2]。本研究发现斑马鱼长链非编码RNASix2a-OT覆盖整个Six2a-Six3a基因簇,其中第一外显子、第二外显子和第三外显子位于Six2a的上游;第四外显子位于Six3a的上游。鸡、小鼠和人类的Six基因簇中也发现了长链非编码RNA[10,11]。最近的一项研究表明:长链非编码RNA的转录和剪接都可以正向调控相邻基因的表达[24]。我们通过阻断Six2a-OT第三外显子和第四外显子的剪接后,确实发现Six2a和Six3a表达均下降。这个结果与其他物种Six基因簇的长链非编码RNA的功能相似,都可以调控周围Six基因的表达[10,11]。脊椎动物中另一个非常经典、排布高度保守的Hox基因簇的内部也存在多个长链非编码RNA,它们对Hox基因的表达调控也极为重要[9]。因此,长链非编码RNA很可能是这类保守的共线性表达基因的通用调控因子,但具体的机制还需进一步研究确定。
