一株深海来源放线菌的次级代谢产物研究
2018-12-06周广敏
王 鸿,周广敏,华 熠
(浙江工业大学药学院,浙江 杭州 310014)
海洋微生物因处于独特的高压、高盐、低温等环境造就了其与陆地微生物不同的代谢途径[1],海洋来源的放线菌产生了许多具有生物活性的次级代谢产物,包括抗菌、抗肿瘤、细胞毒性、免疫抑制剂等,生长在未知或未开发环境中的放线菌,包括研究较少的海洋环境中的放线菌,成为开发新次级代谢产物的主要来源[2]。
本文针对一株分离自西南印度洋2945 m深的海洋沉积物中的稀有放线菌新菌株Amycolatopsis sp.WP1,进行发酵,以抗菌活性追踪为导向,对其次级代谢产物进行了研究。
1 实验部分
1.1 实验仪器与材料
Amycolatapsis sp.WP1是采自西南印度洋深海洋沉积物中的稀有放线菌新菌株,由国家海洋局第三研究所张改云老师鉴定[3],保藏于中国微生物菌种保藏管理委员会普通微生物中心,编号CGMCCNo.10738。
金黄色葡萄球菌 (Staphylococcus aureus AB 2010021)、大肠杆菌(Escherichia coli AB 94012)、白色念珠菌(Candida albicans AY 204006)、枯草芽胞杆菌(Bacillus subtilis CMCC(B)63501)为浙江工业大学药学院保存。
1.2 实验方法
1.2.1 实验培养基
ISP2海水液体培养基(g/L):酵母提取物4 g;麦芽提取物 10 g;葡萄糖4 g;海盐 33 g;pH=7.3,121 ℃,1×105Pa灭菌 20 min待用。
ISP2海水固体培养基(g/L):酵母提取物4 g;麦芽提取物10 g;葡萄糖4 g;海盐 33 g;琼脂 15 g;pH=7.3,121 ℃,1×105Pa灭菌 20 min 待用。
AM2 海水液体培养基(g/L):大豆粉 10 g,蛋白胨2 g,葡萄糖20 g,可溶性淀粉5 g,酵母提取物 2 g,K2HPO40.5 g, MgSO4·7H2O 0.5 g,CaCO32 g,pH=7.4,121 ℃,1×105Pa灭菌 20 min待用。
1.2.2 菌株的发酵、萃取
菌株在ISP2海水固体培养基活化后,挑取适量的单菌落接种到ISP2海水液体培养基中,于30℃,180 r/min下振荡培养3 d,该菌液作为发酵的种子液。
按照10%的接种量,将种子液接种到含有AM2海水液体培养基中,于30℃,180 r/min下振荡培养5 d。发酵液在8000 r/min、4℃条件下离心10 min,取上清液,用等体积乙酸乙酯萃取二次后,乙酸乙酯层浓缩至干,称重。
1.2.3 粗提取物的分离纯化、结构鉴定
利用小孔树脂MCI对粗提取物进行初步分离,以纯水、纯水-甲醇(4 ∶1)、纯水-甲醇(3 ∶2)、纯水-甲醇(2 ∶3)、纯水-甲醇(1 ∶4)、纯甲醇各 2个柱体积依次洗脱,收集各个梯度洗脱液。将洗脱液旋蒸、浓缩,纯水段舍弃,获得5个分段,分别为 A、C、B、D、E段。用 DMSO将分段溶解成50 mg/mL的样品,备用。选用革兰氏阳性菌金黄色葡萄球菌、枯草芽胞杆菌,革兰氏阴性菌大肠杆菌,真菌白色念珠菌作为指示菌株,采用杯碟法检测各个分段的抑菌活性[4]。
对5段进行HPLC分离纯化,在分析型色谱柱 Phenomenex(USA,Luna 5u C18)进行条件摸索,后用半制备型色谱柱(Agilent XDB C18)进行分离,最后用分析型色谱柱纯化得到单体化合物,通过NMR分析,文献对比,确定化合物结构。
1.2.4 单体化合物的体外抗菌MIC评价
DMSO溶解单体化合物使浓度为5 mg/mL,备用。使用微量稀释法对单体化合物进行体外抗菌MIC评价[5]。将待测样品加至96孔板中,利用新鲜培养基等倍稀释成以下浓度梯度:100μg/mL、50 μg/mL、25 μg/mL、12.5 μg/mL、6.25 μg/mL、3.125 μg/mL、1.5625 μg/mL、0.7825 μg/mL, 并加入指示菌菌悬液至100 mL。等体积的DMSO作阴性对照,等体积的氨苄青霉素钠或两性霉素B作阳性对照。细菌在37℃下培养24 h,真菌在28℃下培养48 h后,观察实验结果,以肉眼判断无菌生长的最低浓度为MIC(μg/mL)。
2 实验结果与讨论
Amycolatapsis sp.WP1菌株共发酵培养100 L,获得粗提取物23.5 g。
2.1 粗提取物各分段的抗菌活性
抑菌实验效果结果如图1所示,D段对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌都有一定的抑制作用,A、C、E段只对金黄色葡萄球菌有一定的抑制作用,5段对白色念珠菌均没有抑制作用。

图1 各段的抗菌结果
2.2 单体化合物的分离、结构鉴定
根据各段的不同,采用不同的分离条件,分离得到7个化合物,经过NMR分析和文献对比,确定化合物的结构。
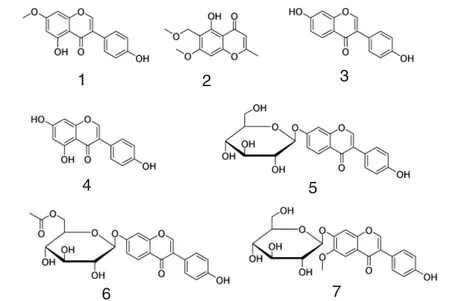
图2 化合物的结构
化合物1:淡黄色晶体,可溶于甲醇,分子式C16H12O5,分子量 284。1H-NMR(500 MHz,DMSO-d6):3.85 (3H, s), 6.40 (1H, d, J=1.7), 6.64(1H, d, J=1.65), 6.82 (2H, d, J=1.65), 7.37(2H,d,J=7.1),8.39 (1H, s),9.70 (1H,s),12.95 (1H, s);13C-NMR (125 MHz,DMSO-d6):56.22, 92.53, 98.18, 105.54, 115.23, 121.16,122.65,130.29,154.50,157.58,157.65,161.85,165.37, 180.56。 与文献[6]对比,确定为樱黄素(4',5-diidroxi-7-metoxiisoflavona)。
化合物2:淡黄色晶体,可溶于甲醇、乙腈,分子式 C13H14O5,分子量 250。1H-NMR(500 MHz,CDCl3):2.35 (3H, s), 3.40 (3H, s), 3.90 (3H,s), 4.55 (2H, s), 6.04 (1H, s), 6.37 (1H, s),13.02 (1H, s);13C-NMR(125MHz,CDCl3):20.63,56.35, 58.39, 61.77, 89.79, 105.26, 109.08,109.28,158.37, 160.74,164.39,166.82,182.63。与文献[7]对比,确定为6-甲氧基甲基丁香酚(6-methoxymethyleugenin)。
化合物3:淡黄色晶体,可溶于甲醇,分子式C15H10O4,分子量254。淡黄色晶体,可溶于甲醇,分子式C15H10O5,分子量270。1H-NMR (500 MHz,DMSO-d6):6.80 (2H, d, J=8.6), 6.86 (1H, d,J=2.25), 6.93 (1H, dd, J=2.2, 8.7), 7.37(2H, d, J=8.8), 7.96 (1H, d, J=8.8), 8.29(1H, s), 9.53 (1H, s),10.76 (1H, s);13C-NMR(125 MHz,DMSO-d6):102.09, 114.94, 115.13,116.62, 122.53, 123.47, 127.30, 130.08, 152.84,157.17,157.43,165.52, 174.69。与文献[8]对比,确定为 4', 7-二羟基异黄酮 (Daidzein, 4', 7-Dihydroxyisoflavone)。
化合物4:淡黄色晶体,可溶于甲醇,分子式C15H10O5,分子量270。淡黄色晶体,可溶于甲醇,分子式C15H10O5, 分子量270。1H-NMR (500 MHz,DMSO-d6):6.23 (1H, d, J=2.1), 6.39 (1H, d,J=2.1), 6.82 (2H, d, J=8.65), 7.37 (2H, d,J=8.65), 8.33, (1H, s), 9.61 (1H,s),10.87(1H, bs), 12.96 (1H, s);13C-NMR (125 MHz,DMSO-d6):93.64,98.95,104.44,115.03,121.18,122.26, 130.13, 153.96, 157.39, 158.58, 161.98,164.27,180.19。 与文献[9]对比,确定为 4',5,7-三羟 基 异 黄 酮 (Genistein, 4',5,7-trihydroxyisoflavone)。
化合物5:白色针晶,可溶于甲醇,分子式C21H20O9,分子量 416。1H-NMR(500 MHz,DMSO-d6):3.16-3.72 (6H,m), 5.08 (1H,m), 6.81(2H, d, J=8.6), 7.14 (1H, dd, J=2.25, 8.85),7.23 (1H, d, J=2.25), 7.41 (2H, d, J=8.55),8.04 (1H, d, J=8.9), 8.39 (1H, s);13C-NMR(125 MHz,DMSO-d6):60.63, 69.62, 73.12,76.47, 77.21, 99.97, 103.37, 114.97, 115.58,118.46, 122.30, 123.69, 126.95, 130.08, 153.69,157.03,157.26,161.39, 178.74。与文献[9]对比,确定为大豆苷,即4’,7-二羟基异黄酮-7-O-β-D-吡喃葡萄糖 (4',7-hydroxyisoflavone-7-O-β-D-glucopyranoside)。
化合物6:白色针晶,可溶于甲醇,分子式C23H22O10,分子量 458。1H-NMR(500 MHz,DMSO-d6):3.74-4.45 (6H, m),5.16 (1H,d,J=7.35),6.82 (2H,d,J=8.6),7.13 (1H,dd,J=2.35,8.9),7.22 (1H,d,J=2.3),7.40 (2H,d,J=8.65), 8.05 (1H, d, J=8.9), 8.39 (1H, s);13CNMR(125 MHz,DMSO-d6):20.67, 63.09, 69.80,73.06, 73.81, 76.26, 99.65, 103.48, 115.02,115.49, 118.55, 122.27, 123.76, 127.00, 130.10,153.42, 157.02, 157.33, 161.15, 170.27, 174.79。与文献[10]对比,确定为 6″-乙酰基-大豆苷(6″-O-acetylgenistin)。
化合物7:白色针晶,可溶于甲醇,分子式C22H22O10,分子量 446。1H-NMR(500 MHz,DMSO-d6):3.88 (3H,s),4.61 (1H, t), 5.15 (1H, d,J=4.95), 5.43 (1H, d, J=2.7), 5.17 (2H, d, J=7.15), 5.43 (1H, d, J=2.7), 6.81 (2H, d, J=8.6), 7.32 (1H, s),7.40 (2H,d, J=8.6),7.48 (1H, s),8.38 (1H,s), 9.57 (1H,s);13CNMR(125 MHz,DMSO-d6):55.83, 60.62, 69.57,73.02, 76.76, 77.21, 99.61, 103.42, 104.72,114.99, 117.81, 122.59, 123.13, 130.08, 131.54,147.46,151.54,153.06,157.21, 174.39。 与文献[11]对比,确定为黄豆黄苷(Glycitin)。
2.3 单体化合物的MIC
选用金黄色葡萄球菌、大肠杆菌、白色念珠菌、枯草芽胞杆菌作为指示菌株,采用微量稀释法对化合物进行体外抗菌活性MIC评价。实验结果显示,7个化合物对四株指示菌都没有较好的活性(MIC>100 μg/mL)
2.4 讨论
粗提取物具有抗菌活性,但最终没有分离得到具有抗菌活性的化合物,分析原因:分离过程中,多使用紫外检测器对化合物进行分离,有些具有活性的化合物没有较好的紫外吸收,或所选用的波长不是该活性化合物最大吸收波长,因而在纯化过程总可能被忽略舍弃;粗提物和各段中的多种化合物之间产生的抑菌作用协同、相加,表现出明显的透明圈,而单个化合物可能产生的抑菌效果较弱;由于分离手段和分离经验不足,使得具有良好抑菌效果的化合物没有分离到。
3 结论
对一株深海来源的放线菌进行发酵,发酵液经乙酸乙酯萃取,得到粗提取物,以抗菌活性追踪为导向,将粗提取物初步分离为5段,并对这5段进行抗菌实验,其中有4段对金黄色葡萄球菌都有较好的抑菌活性,有1段对金黄色葡萄球菌、大肠杆菌、枯草芽胞杆菌都有很好的抑菌作用。进一步的分离,得到7个已知化合物,分别是樱黄素(1),6-甲氧基甲基丁香酚(2),4', 7-二羟基异黄酮(3),4',5,7-三羟基异黄酮(4),大豆苷(5),6″-乙酰基-大豆苷(6),黄豆黄苷(7),这 7个化合物均是首次在这株菌中分离得到。对这7个化合物做了抗菌活性评价,MIC结果显示,7个化合物都没有较好的抗菌活性 (MIC>100μg/mL)。虽然这些化合物没有显示出较好的抗菌活性,但是生物活性导向仍然是活性化合物分离的重要方式。如何有效快速地分离得到具有生物活性的化合物,是微生物次级代谢产物的重点和难点,加强海洋来源微生物的研究依然是重要和有意义的。
