我国仿制药品医疗保险支付标准的实证探索:基于参考定价方法
2018-12-05张玉丽谢诗桐
张玉丽 谢诗桐 吴 晶
1 背景
2015年,国家发展和改革委员会会同国家卫生和计划生育委员会等六部委联合发布《推进药品价格改革的意见》(发改价格〔2015〕904号),其中指出:“除麻醉药品和第一类精神药品外,取消药品政府定价”,并明确了医疗保险应该站在购买方的立场上制定支付标准。针对专利药品、独家生产药品,我国已建立起公开透明、多方参与的价格形成谈判机制。2017年与2018年开展的两轮国家医疗保险(简称“医保”)目录准入谈判,分别有36个和17个创新药品成功纳入医保,并形成了相应的医保支付标准。反观过期专利药品和仿制药品,由于一直存在“质量差异”的质疑,我国一直未能形成以通用名为基础的医保支付标准制定体系。2015年8月国务院《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)与2016年3月国务院办公厅《关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)两个文件的正式出台,意味着一致性评价的大幕正式拉开[1]。目前已有共计75个(41个品种)药品通过了仿制药品质量和疗效一致性评价(以下简称“一致性评价”)[2]。随着一致性评价的持续开展和通过一致性评价药品数量的不断增多,这使得以通用名为基础制定医保支付标准更加具有可行性。本文尝试借鉴德国参考价格的制定方法,结合我国医药市场的实际情况,利用真实世界数据进行医保支付标准的实证测算。
2 德国医保药品支付标准制定原理简介
德国是世界上最早实行社会保险的国家[3]。对于创新药品,德国根据药品的创新程度确定医保药品的支付标准,“具有附加效益(Added benefit)”的创新药品通过谈判获得医保支付资格与相应的支付标准;对于不具有附加效益的新药、过期专利药品和仿制药品(这三类药品后文统称为“非创新药品”),则被放入参考定价(Reference pricing)体系。德国于 1989年由《医疗市场改革法案》(Health Care Reform Act)引入药品参考定价体系,该体系包含参考定价适用范围的确定、参考价格组的划分、参考价格的具体测算以及参考价格信息的发布四部分内容,经由该体系制定出的参考价格即为医保给予支付的法定最高标准[4]。
对于非创新药品,德国目前设有三个级别的参考价格组。第一等级参考价格组内的药品含有相同的活性物质,主要由过期专利药品及被证明具有生物等效性的通用名药品组成;第二等级参考价格组内的药品具有相似的药理作用和疗效,特别是具有相似的化学结构,通常包含同种药品的me-too类药物;第三等级参考价格组内的药品常用于治疗相同的疾病或症状,尤其是复方制剂组。在以上组别的基础上,再进一步结合药品的给药途径、药剂释放速度等,最终形成若干参考价格组。然后遵循参考价格制定步骤,逐组制定参考价格[5-6]。
德国在制定参考价格时要求选定的参考价格不超过市场供应产品最低价和最高价之间下 1/3分位处的最高价格;且为了保障药品的供应安全、医师与患者有充分的选择余地和促进产品之间的充分竞争,参考价格之下(等于或低于参考价格)应涵盖至少20%的产品数量与处方数量(下文简称“双20%规则”)。同时,为防止个别产品定价过高、恶意拉高参考价格的情况发生,在选定标准包装品参考价格时,会排除在产品组内市场份额权重不足1%的最高价格产品[5]。
3 我国非创新药品参考价格的实证测算
本研究从《天津市基本医疗保险、工伤保险和生育保险药品目录(2015年版)》中,选择三个符合以下条件,并用于治疗常见疾病的通用名药品进行支付标准的实证测算:①有过期专利产品;②有部分已经通过一致性评价的仿制品;③有部分尚未通过一致性评价的仿制品;④有三个(含)以上的生产厂商。本研究最终选择了用于调节血脂的药物阿托伐他汀钙、用于治疗高血压的药物厄贝沙坦以及用于治疗骨质疏松的药物阿法骨化醇进行实证测算,并从2015年天津市城镇职工基本医保数据库获取这三个药品通用名下各产品的销售量数据。
3.1 实证测算步骤第一,将选出的三种药品按照通用名、给药途径和药剂释放速度划分测算产品组,并计算组内各个产品的销售量百分比,作为市场份额权重(见表1-3)。
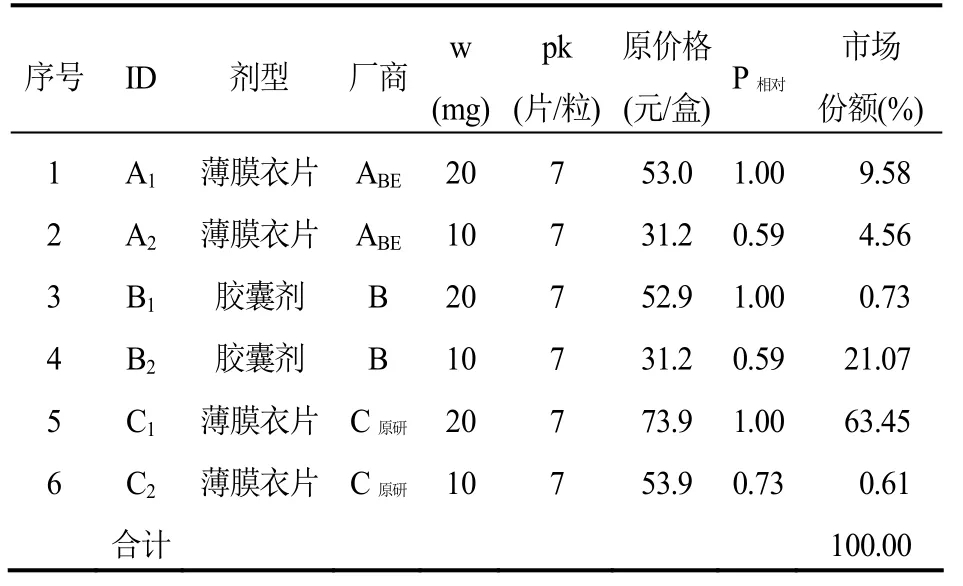
表1 阿托伐他汀钙口服常释剂型产品组(标准包装:20 mg×7片或粒/盒)
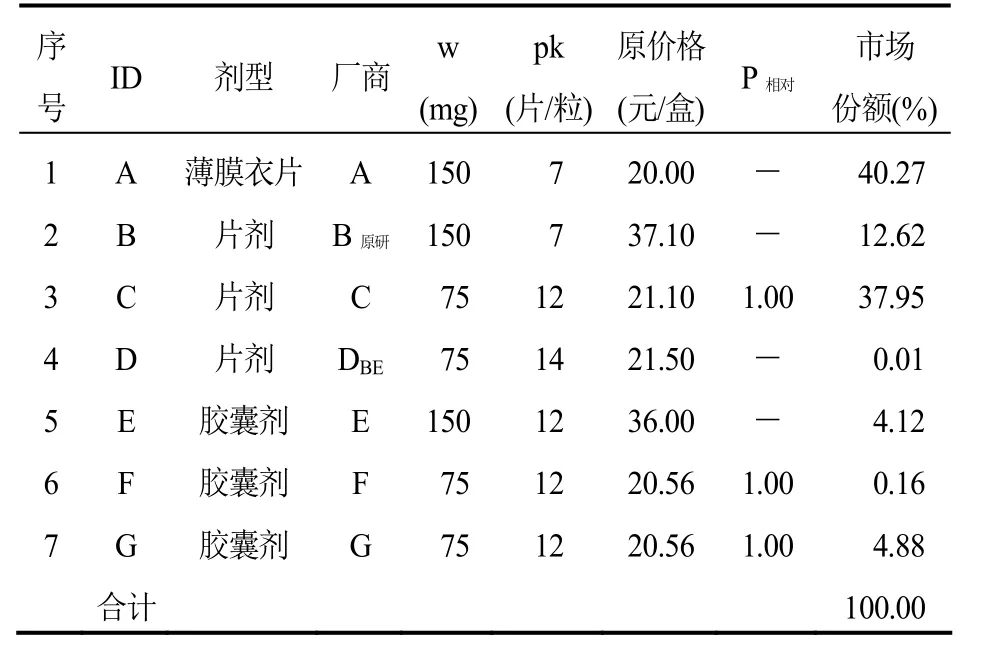
表2 厄贝沙坦口服常释剂型产品组(标准包装:75 mg×12片或粒/盒)

表3 阿法骨化醇口服常释剂型产品组(标准包装:0.25 μg×20片或粒/盒)
第二,选择标准包装品并进行同厂商产品价格标化。标准包装是参考价格组内最多厂商能够供应的规格(如20 mg/片)和包装量(如7片/盒)的组合。若上述标准可以提供多个选项,则选择市场份额大的作为标准包装。具有标准包装的产品称为标准包装品,例如表 1阿托伐他汀钙产品组的标准包装为20 mg×7片(或粒)/盒[6]。选定标准包装后,将标准包装品的相对价格(P相对)设为1,并对同厂商的非标准包装品进行价格标化,公式为:

第三,拟合回归系数。制定参考价格的主要公式为:

其中,P代表相对价格(P相对);w代表产品有效成分的含量(规格),通常用mg、ml等作为计量单位;pk代表包装量,如片、粒等;a是倍增因子,b和c分别是w和pk的指数;(F2)是(F1)的变形,用于拟合a、b和c三个系数[6]。
使用生产标准包装品的厂商的所有产品数据(规格、包装量和相对价格),通过公式(F2)进行回归,即可估计出倍增因子a、系数b和c。例如表1中,使用产品 A1、A2、B1、B2、C1、C2的规格、包装量和相对价格数据,拟合出的倍增因子 a=0.138 257 416,系数b= 0.660 4857,系数c=1(根据德国参考价格的制定规则,若c的拟合结果为0,令 c=1)[5]。

第五,选定(虚拟)标准包装品的参考价格(表4-5)。经过以上四步,药品组内每个厂商都有一个(虚拟)标准包装品,将这些(虚拟)标准包装品按照价格由低到高排序,然后选取价格序列中不超过下 1/3分位处的价格(P1/3)作为(虚拟)标准包装品的参考价格,例如表4中,ID为B1的产品的价格(52.90元/盒)即为该组标准包装品的参考价格。

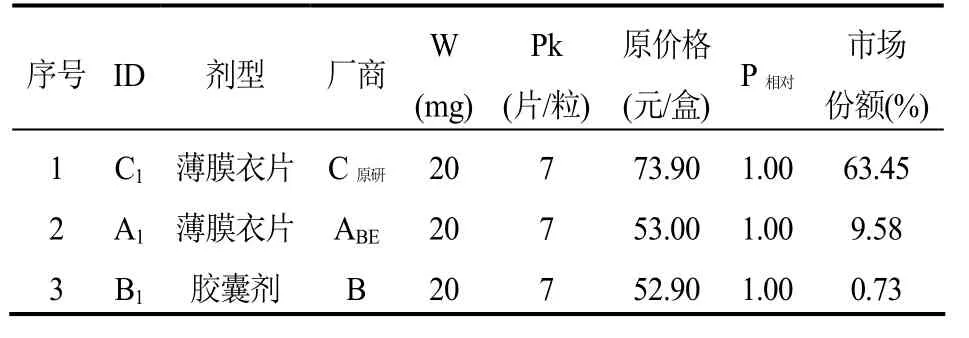
表4 阿托伐他汀钙口服常释剂型产品组-选定标准包装品的参考价格
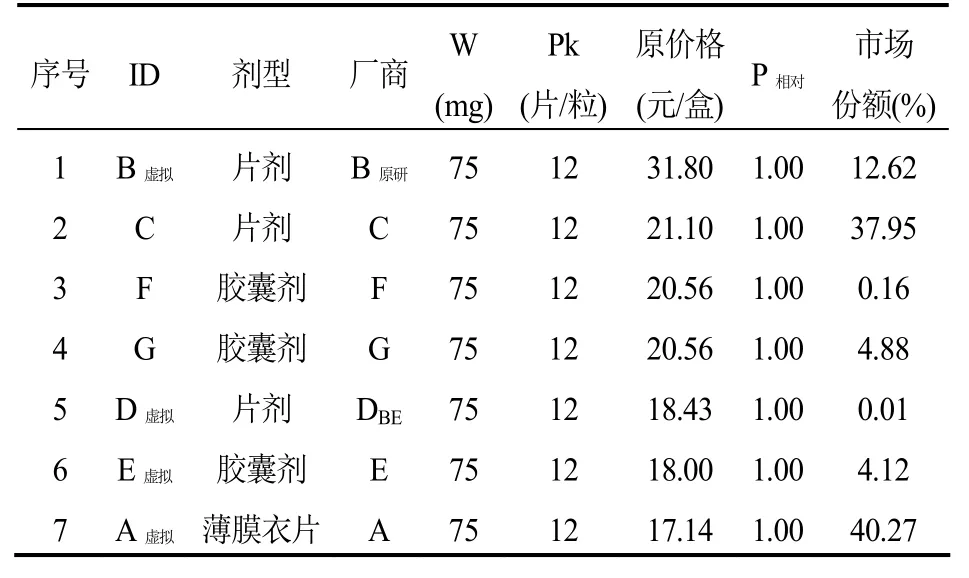
表5 厄贝沙坦口服常释剂型产品组-选定(虚拟)标准包装品的参考价格
第七,计算全组产品的P相对。将a校正、b和c带入公式(F1)计算可得全组产品的P相对(表6-7)。
最后,计算全组产品的参考价格。组内各个产品的P相对乘以第五步选定的标准包装品的参考价格,即可得到全组产品的参考价格(表6和表7)。
3.2实证测算结果阿托伐他汀钙口服常释剂型产品组可通过测算获得 1/3分位下的参考价格(P1/3),组内不低于 P1/3的产品个数和市场份额合计分别是50.00%和26.36%,符合保障药品供应安全、医师有充分的选择余地和促进产品之间形成竞争的要求。从价格和销售量来看,组内原研产品的原价格最高,销量最好(市场份额权重为63.45%),其参考价格相比其原价格降低了28%。组内通过了一致性评价产品(A1和A2,同为厂商A的产品,表1)的销售量一般,原价格与组内尚未通过一致性评价的产品基本持平,其参考价格略低于原价格(表 6)。如果按照当年的销售量执行参考价格(P1/3),阿托伐他汀钙产品组可以为医保节省高达21%的费用。
厄贝沙坦口服常释剂型产品组可通过测算获得1/3分位下的参考价格(P1/3),而且,不低于P1/3的产品个数和市场份额合计分别是28.57%和44.39%,符合“双20%规则”。从价格和销售量来看,组内原研产品价格高,销售量占比(12.62%)不突出,其参考价格相比原价格降低了 43%。另外,组内通过了一致性评价产品的原价格较低,其市场份额在仿制产品中排名靠后(表 7)。如果按照当年的销售量执行参考价格P1/3,厄贝沙坦产品组可以为医保节省12%的费用。

表6 阿托伐他汀钙口服常释剂型产品组-全组的参考价格(标准包装品的参考价格=52.90)
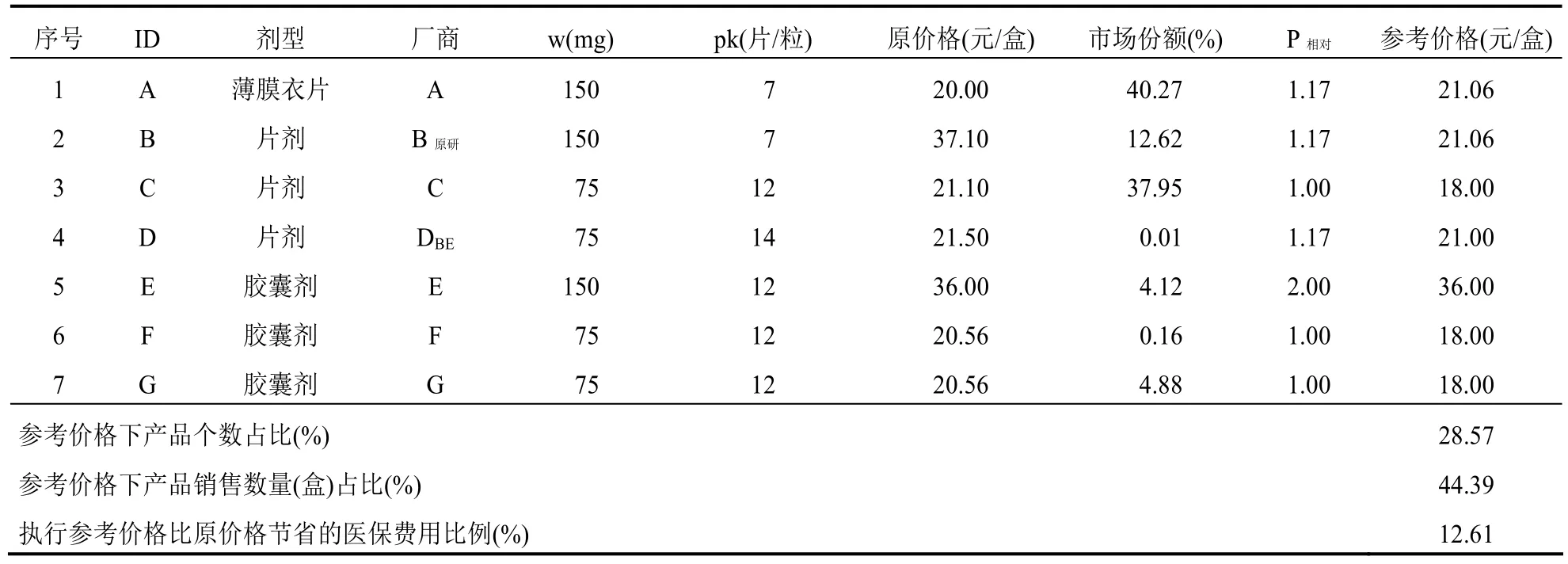
表7 厄贝沙坦汀口服常释剂型产品组-全组的参考价格(标准包装品的参考价格=18.00)
阿法骨化醇口服常释剂型产品组内原研产品价格最高,销售占比也极高(两个规格的产品分别占比80%和10%),无法通过测算获得1/3分位下的参考价格。虽然组内通过了一致性评价产品的价格较低,但其市场份额在仿制产品中排名靠前(表3)。
4 讨论和启示
德国参考定价的基本思想是对于质量与疗效具有可比性的药品,应当给予同样的医保支付标准,但药品的销售价格则由厂商和市场竞争共同决定。中国一致性评价的持续开展,使得按照通用名制定医保支付标准具备了基本条件,本研究也表明使用德国的参考定价方法制定医保支付标准是可行的。但是,我国的医药市场有自身的独特之处,实际实施时需要注意以下几个方面:
第一,本研究发现即使是用于治疗常见疾病的药品,每个通用名产品组内的产品数量也比较少。以阿托伐他汀钙为例,组内只有6个产品,但通过原国家食品药品监督管理总局网站可以查询到23个阿托伐他汀钙的“国药准字”批准文号,产品数量更是超过30个[7]。组内产品数量少意味着不能引发充分的竞争,影响合理市场价格的形成。这可能是地方的招标采购政策,如“一品双规”,所形成的地方市场准入壁垒,也可能是厂商的销售策略,如出于价格管理的考虑,放弃部分市场所导致的。
第二,德国在选定标准包装品参考价格的过程中,为防止个别高价产品恶意拉高整组产品的参考价格,排除在产品组内市场份额权重不足1%的最高价格产品。然而,本研究实证测算的结果显示,高价格的产品往往拥有较高的市场份额;相反,低价格产品的市场份额也比较低,这些低价格产品可能会拉低整组产品的参考价格,从而导致制定出的支付标准也较低。所以,在制定参考价格时,若参考价格P1/3不能保障双20%条件时,可以考虑在选定标准包装品的参考价格时排除销售量占比不足1%的产品,从而达到按照市场主流的产品价格来制定支付标准的目的。另外,医药产品的销售价格、市场份额权重可能随着市场竞争程度、集团采购、销售策略等因素发生变化,相关部门应建立价格采集机制,定期采集相关的信息以适时制定或调整支付标准。
第三,关于产品销售量的计算口径,德国采用“市场最小零售包装”销售量,计算各个产品在参考价格组内的市场份额权重。在我国,部分产品的零售包装规格差异很大,某产品一盒药品的有效成分含量(例如mg)可能是另一产品一盒药品的两倍。例如厄贝沙坦,组内7个产品有4种不同的零售包装规格:150 mg×12片/盒、150 mg×7片/盒、75 mg×14片/盒和75 mg×12片/盒,显然以“盒”和以“有效成分含量”的销售量得出的市场份额权重会有所不同。
第四,在通用名产品组内,有时会出现某产品销售权重很大,从而无法制定出1/3分位参考价格的情况。例如阿法骨化醇产品组中,产品C1的市场权重高达82%,若按照制定参考价格的要求,满足“参考价格之下(等于或低于参考价格)应涵盖至少20%的产品个数和处方数量”的标准,则该组产品的支付标准短期内需要按照原研产品的价格来制定。
第五,通常认为原研产品具有先发优势及品牌优势,其市场份额权重往往也会较大,但本研究发现情况并不总是如此。虽然,本研究测算的阿托伐他汀钙和阿法骨化醇,无论是销售价格还是市场份额权重,其原研产品都远远高于组内的其他产品。但是,厄贝沙坦产品组中原研产品价格高但销售量占比却并不突出;相反,另一个价格较低且目前尚未通过一致性评价的产品的市场份额权重最大(40.27%)。
本研究存在一定的局限性。第一,因实证测算的产品数量有限,尚不能全面反映将德国参考价格制定方法应用于我国制定医保支付标准可能遇到的所有问题;第二,本研究只是使用了天津一个城市的数据,其产品竞争情况和市场份额权重可能不具有全国代表性。
根据德国参考价格定价的方法,制定我国过期专利药品及其仿制药品医保支付标准是基本可行和非常值得探索的。但我国医药市场有其独特之处,实际实施时需要根据具体情况对测算方法进行相应调整。
