活化诱导胞嘧啶核苷酸脱氨酶对膀胱癌T24细胞表型的影响
2018-11-29周治彦吴遥西陈金火金应霞李浩勇梁培育
李 琦,马 哲,周治彦,吴遥西,陈金火,金应霞,宋 鹏,程 帆,李浩勇,,梁培育
(1.海南医学院第一附属医院泌尿外科,海南海口 570102;2.武汉大学人民医院泌尿外科,湖北武汉 430060;3.武汉大学人民医院中心实验室,湖北武汉 430060)
活化诱导胞嘧啶核苷酸脱氨酶(activation-induced cytosine deaminase,AID)是脱氨酶家族的一员,具有通过其突变活性介导人体抗体多样性的功能,研究发现在胃癌和皮肤癌细胞中也检测到了AID的表达,AID可以通过类别转换重组(class switch recombination,CSR)、体细胞高频突变(somatic hypermutation,SHM)等特性介导多种原癌以及抑癌基因发生突变[1-2]。本研究旨在探讨AID在膀胱癌组织中的表达以及抑制其表达对膀胱癌细胞株T24在增殖、迁移、侵袭以及凋亡方面的影响。
1 材料与方法
1.1组织样本临床标本来自武汉大学人民医院病理科2016年6月至2017年2月收集的16例根治性膀胱全切术的膀胱组织。标本切除后迅速分别放入多聚甲醛固定液或液氮中,分别用于免疫组化和蛋白质印迹法(Western bolt)实验。
1.2细胞及细胞培养T24细胞购买自武汉普诺赛生命科技有限公司。实验所用细胞(转染和未转染的T24细胞)均置于细胞培养箱中(5% CO2、37℃环境下),使用含10%胎牛血清和1%双抗(青霉素、链霉素)的细胞冻存培养基(RPMI)1 640培养基进行培养。所用细胞在培养瓶内培养致70%~80%融合度时用胰酶消化并收集用于相关实验。
1.3细胞转染及单克隆细胞的筛选将T24细胞以5×104/孔接种于6孔板,分为shAICDA-T24组和阴性对照组(negative control-T24,NC-T24),细胞贴壁后将LV-AICDA -RNAi或Negative scrambled(无义序列)慢病毒溶液(30 μL/孔)、Polybrene(聚凝胺溶液)(0.5 μL/孔)分别加入shAICDA组和NC组进行转染,18 h后更换1 640完全培养基继续转染至72 h,使用荧光倒置显微镜观察转染情况。从转染后的T24细胞中随机选取100个细胞利用含20%胎牛血清的RPMI 1 640培养基继续培养,20 d后当出现肉眼可见的细胞簇后,用荧光倒置显微镜进行观察,选取带有绿色荧光的细胞转移至24孔板中分别进行培养,当细胞达到90%融合度时,转移至6孔板进行培养。以备后用。
1.4蛋白质提取以及WesternBolt试验随机选取12例样本中6例黏膜层加入适量提取液(合适比例的放射免疫沉淀试验(radio immuno precipitation assay,RIPA)裂解液、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、PhosSTOP(磷酸酶抑制剂混合物)于液氮中进行研磨,充分裂解后于冰上进行超声碎蛋白,随后置于离心机,在4℃,12 000 r/min条件下离心15 min,取上清,使用酶标仪进行浓度测定,按4∶1比例加入5×上样缓冲液,100℃煮蛋白10 min,冷却后放入-80℃冰箱保存,待用;细胞蛋白提取与上述过程基本相同,胰酶消化细胞3 min,终止消化,1 000 r/min离心5 min,弃上清,磷酸缓冲液(phosphate buffer saline,PBS)洗涤2遍,加入适量提取液(合适比例的RIPA裂解液、PMSF、PhosSTOP),后步骤与组织蛋白提取相同。取100 μg蛋白样品(样品来源:组织、shAICDA-T24、NC-T24或T24)经聚丙烯酰胺凝胶电泳分离,转膜1.5 h、封闭2 h,按抗体说明书稀释一抗,4℃孵育过夜,洗膜后加入1∶15 000稀释倍数的对应荧光二抗室温孵育2 h。用Licor dyssey(奥德赛)双通道红外成像系统(美国Li-COR公司)检测杂交信号,用image J软件分析AID与β-Actin(肌动蛋白)的相对表达量,结果重复3次,取平均值。
1.5免疫组织化学染色委托武汉大学人民医院病理科对所取得的12例临床样本中的6例进行包埋切片。然后进行脱蜡和水化,PBS洗涤后进行抗原修复,切片冷却至室温后PBS洗涤2遍,每次5min。加3% H2O2进行过氧化物酶灭活,PBS洗涤2遍,封闭液室温封闭15 min,滴加一抗,4℃过夜。PBS洗涤3遍,室温孵育二抗30 min。滴加适当比例稀释的辣根酶标记链霉卵白素(PBS稀释),37℃孵育10~30 min,PBS洗涤3遍,滴加DAB(辣根过氧化物酶显色试剂盒)显色剂显色。自来水充分冲洗、复染、封片、正置显微镜观察拍照。
1.6实验检测细胞株增殖能力(cellcountingkit-8,CCK-8) 胰酶消化并收集shAICDA-T24、NC-T24以及T24细胞,以每孔5 000个细胞接种至96孔板中,每组细胞设3个副孔,以细胞贴壁时间设为0 h,分别取24、48、72 h为检测点。检测前,每孔分别加入CCK-8试剂(10 μL/孔),置于37 ℃恒温箱反应1.5 h后,用PerkinElmer Victor31420 Multilabel Counter酶标仪(美国PerkinElmer公司)检测各孔在450~490 nm处吸光度(A),取平均值以平均A值表示细胞增殖数量,实验重复3次。
1.7流式细胞数检测细胞株凋亡胰酶消化细胞并用PBS洗涤两遍,离心后用1×的BindingBuffer(结合缓冲液)重悬,稀释至1×106/ mL,取100 μL(1×105个细胞/样品)悬液移至5 mL的培养管中,分别加入5 μL的PE Annexin V和7-AAD染液,柔和震荡培养管,避光25℃孵育15 min,孵育结束后每管加1×的Binding Buffer 400 μL,随后用流式细胞仪进行检测。实验重复3次。
1.8划痕试验检测细胞株迁移能力将shAICDA-T24、NC-T24和T24细胞接种于6孔板中培养,细胞贴壁后生长至大于80%时,更换无血清培养基饥饿24 h,然后于孔板中央进行划痕,PBS洗去划下细胞后继续加入RPMI-1 640无血清培养基进行培养,于0 h和24 h利用倒置显微镜拍照,并用image J软件进行迁移细胞分析痕道修复率,实验结果重复3次。
1.9Transwell(细胞小室实验)检测细胞株侵袭能力将BD Matrixgel基质胶与无血清培养基按1∶8稀释,混合均匀后加入置于24孔板中的Transwell小室中,每个小室加混合液100 μL,温箱放置2 h,于放置小室的孔板中加入含2%胎牛血清的RPMI-1640培养基600 μL,将用无血清RPMI-1640培养基稀释的shAICDA-T24、NC-AICDA以及T24细胞按组别加入小室中,每组细胞设3个副孔。24 h后,每个小室经过PBS洗涤、多聚甲醛固定、苏木素染色、洗涤、风干后,使用倒置显微镜对小室底部进行拍照,对每组细胞随机选取5个视野,计算平均值,进行组间对比。实验重复3次。
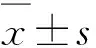
2 结 果
2.1AID在膀胱癌以及癌旁正常组织的表达通过Western bolt和免疫组化实验检测AID在膀胱癌以及癌旁组织中的表达情况,结果显示,在膀胱癌组织中,AID的表达量显著高于癌旁组织,并且在收集的12例临床样本中,均检测到了AID的表达(6例用于Western bolt,6例用于免疫组化),除此之外,癌旁组织中则几乎不存在AID的表达。其中,在Western bolt中,膀胱癌组织中AID的相对表达量为0.98±0.19,而癌旁组织中AID表达量平均值为0.16±0.05(图1A、B),组间差异有显著性统计学意义(P<0.05);在免疫组化实验中(图1 C),由于单纯计算阳性区域面积会忽略染色强度对结果的影响,所以我们使用Image Pro Plus对图片阳性染色部分进行平均吸光度值检测(图1D),其中癌组织的平均吸光度值为0.668±0.085,而癌旁组织的平均吸光度值为0.167±0.046,组间差异显著(P<0.05),并且根据染色情况可以看出AID主要表达于癌变的尿路上皮细胞。
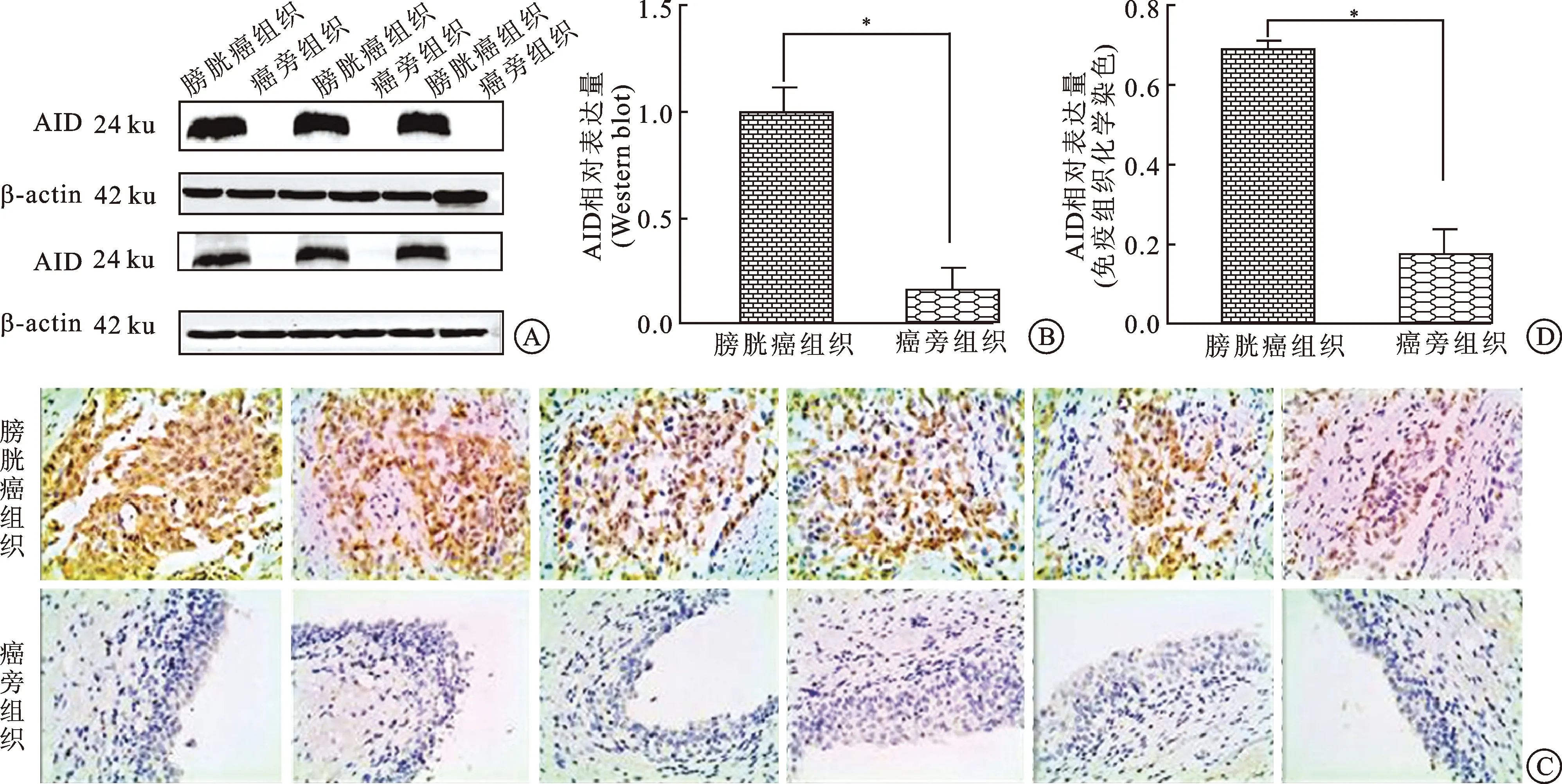
图1AID在膀胱癌及癌旁组织中的相对表达
A、B:Western bolt条带图及其柱状图(膀胱癌组织AID表达量显著高于癌旁组织,*P<0.05);C:免疫组织化学染色结果(×200)(蓝染部分为细胞核,褐染部分为目的蛋白。膀胱癌组织的阳性染色面积及染色强度均显著高于癌旁组织,*P<0.05);D:整体样本的吸光度值对比(*P<0.05)。
2.2转染后AID的表达以设计的shRNA序列通过慢病毒为载体对T24细胞中AID的表达进行抑制(图 2A),因之后进行了单克隆细胞的筛选,能够高效抑制AID的表达,所以并未对转染效率进行统计学分析。其中shAICDA-T24为实验组,NC-T24为阴性对照组,T24细胞为空白对照组,分别对3个组别的细胞通过Western bolt(图2B、C)进行AID表达量的检测。在Western bolt中,实验组中AID表达水平相对于阴性对照组下降约27%,相对于空白对照组下降约35%,其中空白对照组和阴性对照组不存在统计学差异(P>0.05),而实验组与空白对照组和阴性对照组存在统计学差异(P<0.05)。随后,我们对多克隆转染的T24细胞进行多克隆筛选,其中克隆4中AID的表达水平相对于其他单克隆组下降幅度最为显著(图2 D、E),相对于空白对照组和阴性对照组,克隆4中的AID表达水平分别下降约73%和78%(P<0.05)。因此,我们选取克隆4作为实验组细胞(shAICDA-T24)进行随后的实验。
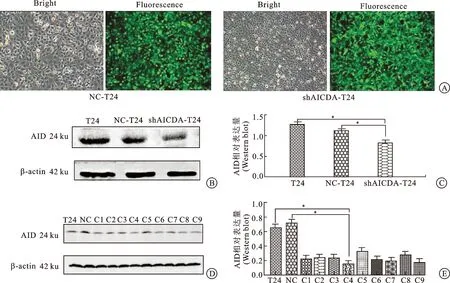
图2Westernbolt检测RANi抑制T24细胞前后AID的相对表达量及进行单克隆细胞的筛选
A:荧光倒置显微镜下观察转染细胞情况(绿色荧光为被慢病毒感染的细胞,×100);B、C:蛋白质水平检测转染前后T24细胞中AID的相对表达量及其柱状图(RANi抑制后T24细胞中AID的表达量显著降低,*P<0.01);D、E:筛选单克隆细胞株检测AID的相对表达量及其柱状图(*P<0.01)。
2.3AID对膀胱癌细胞株(T24)增殖和凋亡的影响通过CCK-8实验分别于0、24、48、72 h通过酶标仪检测3组细胞于450 nm波长处的A值,比较转染前后各组细胞的增殖情况(图3A、B)。3组细胞在0 h吸光度无差异性(P>0.05),而在24、48、72 h处,NC组与空白对照组增殖情况相同(P>0.05),但实验组与NC组差异性显著(P<0.05)。表1为3组细胞于4个检测点处增殖情况的具体信息。根据此实验结果,我们认为,抑制AID的表达导致T24细胞增殖能力的下降。随后我们利用流式细胞术对T24、NC-T24和shAICDA-T24三组细胞的凋亡率进行检测(图3C)。实验结果显示,在早期凋亡、晚期凋亡以及总体凋亡率方面,实验组细胞均显著高于空白对照组及阴性对照组(P<0.05),并且凋亡主要集中在晚期。
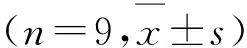
表1 T24组、NC-T24组和shAICDA-T24组的A值变化
2.4AID对膀胱癌细胞株(T24)迁移以及侵袭的影响根据近期关于AID的文献报道,AID可增强人类乳腺癌细胞ZR75.1上皮-间质转化(epithelial-mesenchymal transition,EMT)相关蛋白的表达量,从而促进了肿瘤的侵袭性。由此我们推测,在膀胱肿瘤中,AID可能也起到了同样的作用。因此,我们通过划痕以及Transwell实验来探索AID对膀胱癌细胞株(T24)迁移以及侵袭性的影响。在划痕实验中(图4A、B),shAICDA-T24组的伤口愈合率显著低于空白对照组以及NC组,而空白对照组和NC的修复率无明显差异;而在Transwell实验中,在镜下可以清晰的观察到空白对照组穿过小室底膜的细胞数远远高于实验组(图4C、D)。由此可以推断,AID促进了膀胱癌迁移和侵袭的能力。
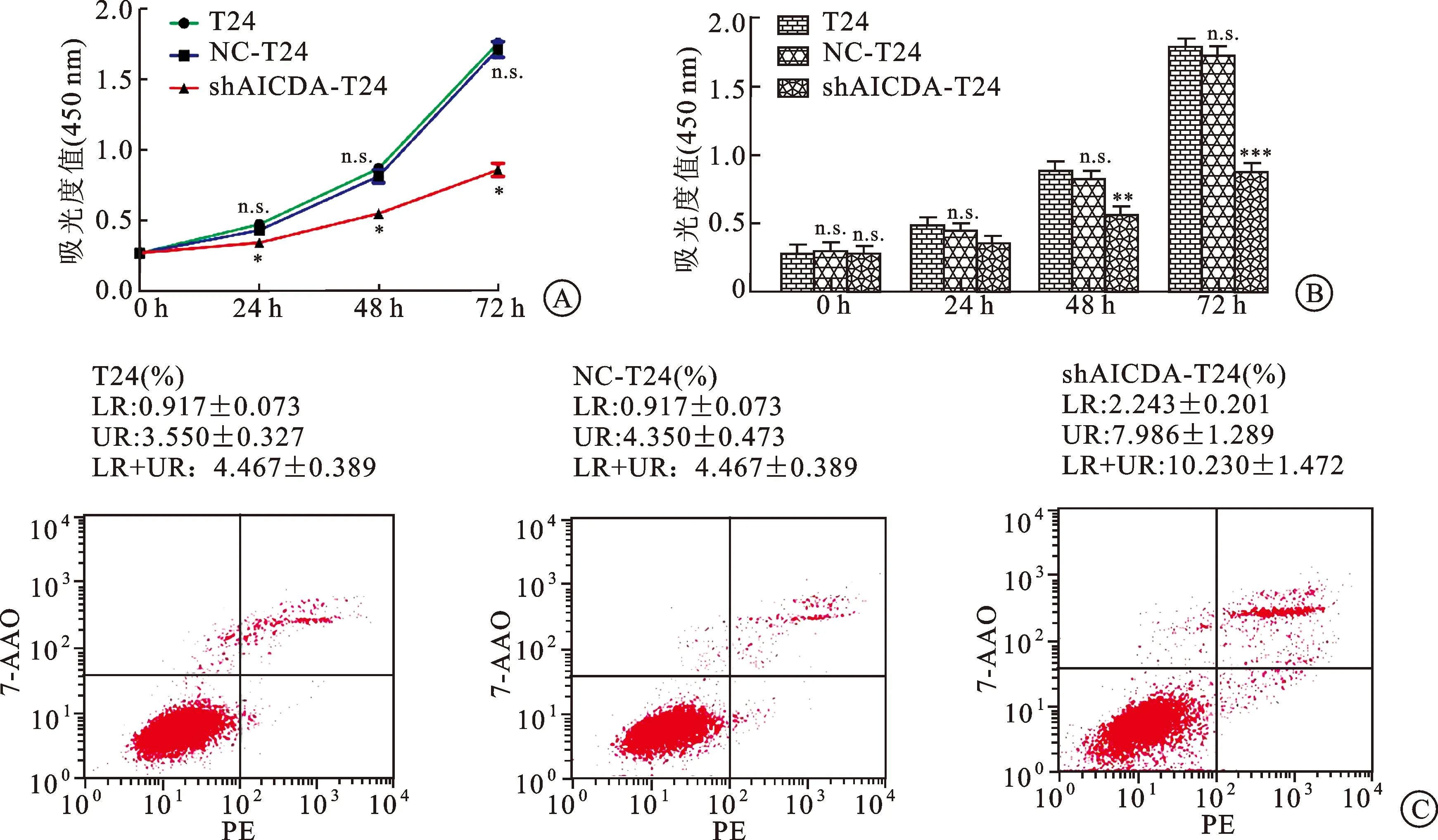
图3转染后3组T24细胞的增殖以及凋亡情况
A:增殖[与T24细胞组和NC组相比,转染后T24细胞增长明显减慢(P<0.05)];B:3组细胞在0 h以及24、48、72 h处的A值对比(在3个检测点处,转染组细胞A值明显低于空白组以及NC组,*P<0.05;并且空白组和实验组之间不存在统计学差异性,P>0.05);C:T24、NC-T24和shAICDA-T24的早期、晚期以及总体凋亡(早凋+晚凋)情况(空白对照组与阴性对照组不存在统计学差异,P>0.05;而实验组与空白对照组和阴性对照组均具有统计学差异,*P<0.05)。
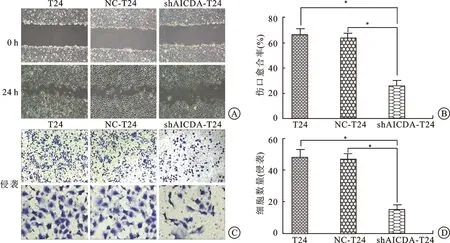
图4 显微镜下的痕道修复和细胞穿透情况以及两个实验中3组细胞差异性对比
A、B: 在划痕试验中痕道修复(×100)及其柱状图,空白对照组的伤口愈合率为(66.4±2.9)%,NC组的修复率为(63.5±2.7)%,shAICDA-T24组的修复率为(25.3±2.7)%。其中,空白对照组及NC组均与shAICDA-T24组存在显著差异(*P<0.05)。C、D:不同放大倍数(×100、×400)下观察细胞侵袭情况及其柱状图。3组细胞分别随机选取5个视野进行计数(×400),并取平均值做柱状图。空白对照组细胞数为(47.7±4.5),NC组细胞数为46.7±6.5,而实验组细胞数为15±2.9。其中,空白对照组及NC组均与shAICDA-T24组之间差异显著(*P<0.05)。
3 讨 论
AID是脱氨酶家族的一员,其功能涉及DNA/RNA的编辑[3],与基因诱导突变显著相关,它能将脱氧胞嘧啶转化成脱氧尿嘧啶,从而能够通过修改靶基因的序列而产生对人体各种有利的作用和效应[4]。其主要功能是启动人体第二抗体多样化的进程[5]。在获得性免疫应答过程中,点突变在免疫球蛋白基因的重链与轻链的可变区累积,最终增加了免疫球蛋白抗原结合区的可变性和抗原-抗体反应的亲和力[6],所以,AID是人类免疫系统最重要的因子之一。然而,AID同样具有诱导人类核酸修改和双链DNA断裂的作用[7],与AID在免疫系统中对机体良好的有利作用相比,AID的过度表达可能会影响肿瘤相关基因(原癌基因、抑癌基因)表达的改变。去甲基化是AID近年来被发现的另外一个特征[5-8],有研究证实,当AID与CpG岛的甲基化位点持续相互作用时,则会导致滤泡性淋巴瘤的恶化[9]。KITAMURA等[10]对AID转基因小鼠进行试验发现,小鼠体内AID的表达总是能导致肺形态学损伤,这种损伤与人体的不典型腺瘤增生(atypical adenomatous hyperplasia,AAH)类似,这种增生是细支气管肺泡癌的癌前病变。从肺泡表面活性蛋白来判断,与人类AAH类似,小鼠AAH样损伤导致了肺泡的分化,在电子显微镜下,小鼠AAH样损伤显著具有黏液细胞的特征,即发生了细胞化生。MUNOZ等[11]据此利用人类乳腺癌细胞ZR75.1进行了实验,发现通过抑制AID的表达,人类乳腺癌细胞ZR75.1的EMT相关蛋白表达量发生了显著降低。并且还有学者提出,AID可能通过抗原漂移从而使肿瘤细胞发生免疫逃逸[12]。以上学者研究均证实,AID通过其致突变活性具有导致恶性疾病发生和发展的潜能。
在本实验中发现,AID同样表达于膀胱癌组织,而在癌旁组织中,却很难检测到AID的表达。在对人类膀胱癌细胞株(T24)的检测中也发现了AID的表达。通过抑制AID的表达后,T24细胞增殖能力显著降低,而在划痕实验以及Transwell实验中发现,相对于NC组,实验组细胞的迁移以及侵袭能力同样受到了明显的抑制。由此我们推测在膀胱癌中AID同样也发挥了其促进恶性疾病进展的功能。在前期课题中我们发现,人类免疫球蛋白G(immunoglobulin G,IgG)具有促进膀胱癌细胞增殖并且抑制其凋亡的作用[13],但目前仍没有研究表明IgG表达的调控机制。而如上文所述,AID启动了人类第二抗体多样化的进程,通过CRS可导致不同免疫球蛋白的相互转换[14]。BCR信号与TLR信号协同作用可以通过NF-κB通路来诱导AID和CSR[15]。用抗CD79a的单克隆抗体(monoclonal antibody,mAb)阻断BCR后,AID的表达量明显下降,CRS介导产生的IgG1也随之减少,尤其是分泌型免疫球蛋白G1(secretion IgG1,sIgG1)[16]。综合本次研究的发现和前期课题的结果我们推测在尿路上皮细胞内AID可能通过激活重组激活基因-1(recombination activating gene 1,RAG-1)编辑调控IgG1基因过程中而促进膀胱肿瘤的进展[17]。
综上所述,AID在免疫系统中的作用已相对明朗,但是在肿瘤领域中,对AID的研究目前还处于初期阶段,具体生物学效应和作用机制尚不明确。本研究结果表明,AID在膀胱癌中具有促进肿瘤细胞增殖及侵袭的作用,可能是临床治疗膀胱癌的潜在靶点,在今后的研究中我们将针对其作用机制进行更为深入的研究,旨在为膀胱癌的临床治疗提供新的依据。
