桦褐孔菌多糖通过PI3K/Akt/NF-κB/MMP-9抑制哮喘小鼠气道重构①
2018-11-28李良昌赵洪伟
车 楠 李 莉 李良昌 赵洪伟
(延边大学医学院,延吉133002)
哮喘是支气管气道的慢性炎症性疾病,其特征在于慢性气道炎症,气道高反应性,黏液过度分泌和气道重构。气道平滑肌增生、气道基底膜增厚、上皮下纤维化增殖、胶原沉积等均可导致气道重构,是哮喘预后不良的重要原因[1]。Phosphatidylinositol 3-kinase/protein kinase B (PI3K/Akt) 信号通路在哮喘中具有至关重要的作用,可以促进气道炎症和高反应性,上调T辅助细胞因子水平并增加黏液产生[2]。Yang等[3]研究发现PI3K/Akt可活化核因子κB(Nuclear factor-kappaB,NF-κB)的抑制蛋白(Inhibitor of NF-κB,IκB) 激酶加速IκB的降解,促进NF-κB的核转位,增强NF-κB 的转录活性。NF-κB活化后促进基质金属蛋白酶9 (Matrix metalloprotein 9,MMP-9)的基因转录进一步发挥促气道重构的作用[4]。桦褐孔菌多糖(Polysaccharide from Inonotus oblipuus,PIO)是药用菌类桦褐孔菌(Inonotus oblipuus)的重要活性成分具有显著的抗炎、抗癌、抗氧化以及抗糖尿病等[5]。研究表明,PIO具有抗哮喘作用[6],但是其对于哮喘气道重构的作用以及机制尚无详细研究。因此本研究利用OVA诱导建立哮喘小鼠气道重构模型,给予PIO治疗,探讨PIO对气道重构的作用及相关机制。
1 材料与方法
1.1药品、试剂和仪器 OVA(Sigma,美国);IL-4、IL-5、IL-13和MMP-9 ELISA试剂盒(Invitrogen,美国); Masson三色染色液(索来宝,中国);anti-NF-κB p65(6956),anti-MMP9(3852),anti-PI3K(4255),anti-p-PI3K(4228),anti-AKT(9272),anti-p-Akt(9275)(Cell Signaling,美国);β-actin,PARP(Santa Cruz,美国);402型雾化器(四菱医疗器械厂,上海);酶联免疫检测仪,电泳设备和Gel Doc凝胶成像仪(Bio-Rad,美国);桦褐孔菌多糖由延边大学药学院提取。
1.2方法
1.2.1气道重构模型建立与分组 雌性BALB/c小鼠40只,体重(18±5)g,由延边大学医学部实验动物中心提供,标准条件下适应性饲养1周。随机分为对照组、模型组、桦褐孔菌多糖低剂量组(PIO-100)、桦褐孔菌多糖高剂量组(PIO-200)。除正常组外,其余各组小鼠于第1天和第7天腹腔注射溶于磷酸缓冲盐溶液(PBS)的100 μg OVA 和氢氧化铝混合液0.5 ml进行致敏。第12天,OVA(1 mg/ml,溶于生理盐水中)雾化吸入激发30 min,第19、20、33、34、47、48、61、62、75、76、89、90天以同样的方法在同样时间激发,共13次。桦褐孔菌多糖组分别在激发前灌服PIO 100或200 mg/(kg·d)。
1.2.2实验样本获取与处理 末次激发48 h后处死小鼠。收集支气管肺泡灌洗液(Bronchoalveolar lavage fluid,BALF)利用血球计数仪计细胞总数。4℃,3 000 r/min离心5 min,留取上清,于-80℃保存,待测细胞因子。细胞涂片后Diff-quik染色,镜下进行细胞分类计数。取右肺下叶,10%甲醛溶液固定,石蜡包埋后切片,进行HE染色和Masson染色观察。其余各肺叶液氮速冻后-80℃保存待用。
1.2.3BALF中IL-4、IL-5和IL-13含量的ELISA分析 按说明书操作,结果单位以pg/L表示。
1.2.4Western blot分析 参照文献[7]方法。BCA方法测定蛋白浓度,上样量20 μg总蛋白,10%SDS-PAGE胶上进行电泳分离,然后250 mA、90 min电转移至PVDF膜上,50 g/L脱脂奶粉TBS-T缓冲液孵育1 h封闭,按1∶1 000加入相应的稀释抗体4℃过夜。第2天,洗膜后按1∶2 500孵育二抗1 h。加ECL发光试剂,利用Gel Doc进行图像采集。
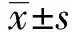
2 结果
2.1PIO减弱哮喘气道重构小鼠BALF中的细胞变化。如图1所示,与对照组相比,模型组小鼠BALF中细胞总数和嗜酸性粒细胞,淋巴细胞和嗜中性粒细胞数量均显著增加(P<0.05);PIO干预后,能够明显降低OVA诱导的炎症细胞的增多。
2.2PIO能够缓解哮喘气道重构小鼠的肺部病理变化。HE染色和Masson染色结果显示,模型组小鼠气道重构现象明显:气道黏膜水肿,上皮细胞增生,气道壁内平滑肌明显增厚,气道痉挛收缩,管腔狭窄,胶原过度沉积,气道及血管周围大量炎性细胞浸润。与模型组相比,PIO干预后的哮喘气道重构小鼠肺组织切片中炎性细胞浸润显著减少,气道结构比较完整,平滑肌增厚以及胶原沉积现象明显得到改善(图2)。
2.3PIO能够降低哮喘气道重构小鼠BALF中IL-4、IL-5和IL-13的升高。如图3所示,ELISA结果显示,模型组小鼠BALF中IL-4、IL-5和IL-13水平明显高于对照组(P<0.05)。而PIO能够明显降低哮喘气道重构小鼠BALF中IL-4、IL-5和IL-13的水平(P<0.05)。
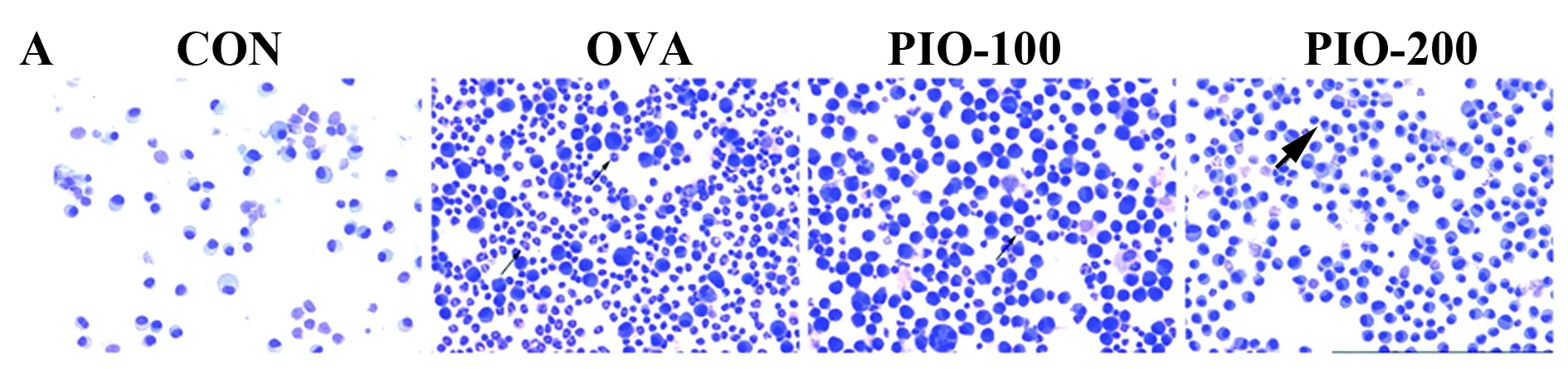
图1桦褐孔菌多糖对哮喘气道重构小鼠BALF中细胞总数及组成的影响
Fig.1Effectofpolysaccharidefrominonotusoblipuusontotalanddifferentialcellularcomponentsofbronchoalveolarlavageinasthmaticmice
Note: A.Diff-quick staining of cells in BALF(×200,the arrows point to eosinophils);B.The changes of the inflammatory cells in BALF.#.P<0.05 vs CON;*.P<0.05 vs OVA.

图2 桦褐孔菌多糖对小鼠肺部炎症的影响(×200)Fig.2 Effect of polysaccharide from inonotus oblipuus on pathologic changes in lung tissues in asthmatic mice(×200)
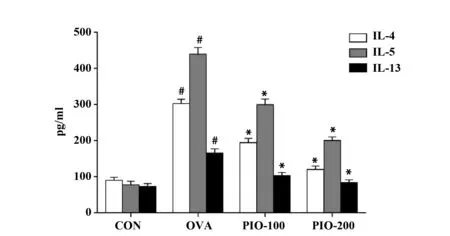
图3 桦褐孔菌多糖BALF中IL-4、IL-5和IL-13水平的影响Fig.3 Effect of polysaccharide from inonotus oblipuus on Th2 cytokines such as IL-4,IL-5,IL-13 in bronchoalveolar lavage fluids of asthmatic miceNote: #.P<0.05 vs CON;*.P<0.05 vs OVA.
2.4PIO降低哮喘气道重构小鼠AHR。如图4所示,与对照组相比,模型组小鼠乙酰胆碱雾化后的气道反应性明显升高;但是PIO的干预可以抑制哮喘气道重构小鼠的气道高反应(P<0.05)。
2.5PIO通过调控PI3K/AKT/NF-κB/MMP-9抑制哮喘气道重构。Western blot结果显示,模型组中p-PI3K和p-AKT表达水平明显升高(P<0.05),而PIO能够降低哮喘气道重构小鼠肺组织p-PI3K和p-AKT的表达,并呈剂量依赖(P<0.05)(图5A)。如图5B所示,模型组中,NF-κB的核转移以及MMP-9表达水平明显升高(P<0.05)。PIO干预能够降低哮喘气道重构小鼠肺组织NF-κB的核转移以及MMP-9的表达水平(P<0.05)。MMP-9的ELISA检测结果表明,与模型组相比,PIO干预后均下调哮喘气道重构小鼠BALF中MMP-9的表达(图5C)。
2.6PIO对哮喘气道重构小鼠WNT 5A表达的影响。Western blot结果显示,模型组中WNT 5A表达水平明显升高(P<0.05),而PIO能够降低哮喘气道重构小鼠肺组织WNT 5A的表达(P<0.05)(图6)。
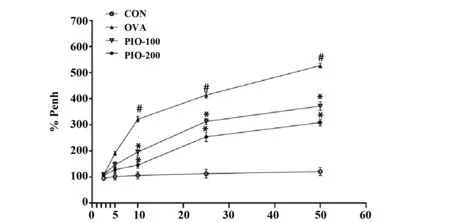
图4 桦褐孔菌多糖对气道高反应性的影响Fig.4 Effect of polysaccharide from inonotus oblipuus on airway hyperresponsiveness in asthmatic miceNote: #.P<0.05 vs CON;*.P<0.05 vs OVA.

图5 桦褐孔菌多糖对PI3K/AKT/NF-κB/MMP-9表达的影响Fig.5 Effect of polysaccharide from inonotus oblipu-us on PI3K/AKT/NF-κB/MMP-9 signaling pat-hway in asthmatic miceNote: A.WB of PI3K and Akt in lung tissue;B.WB of NF-κB and MMP-9 in lung tissue;C.ELISA of MMP-9.#.P<0.05 vs CON;*.P<0.05 vs OVA.
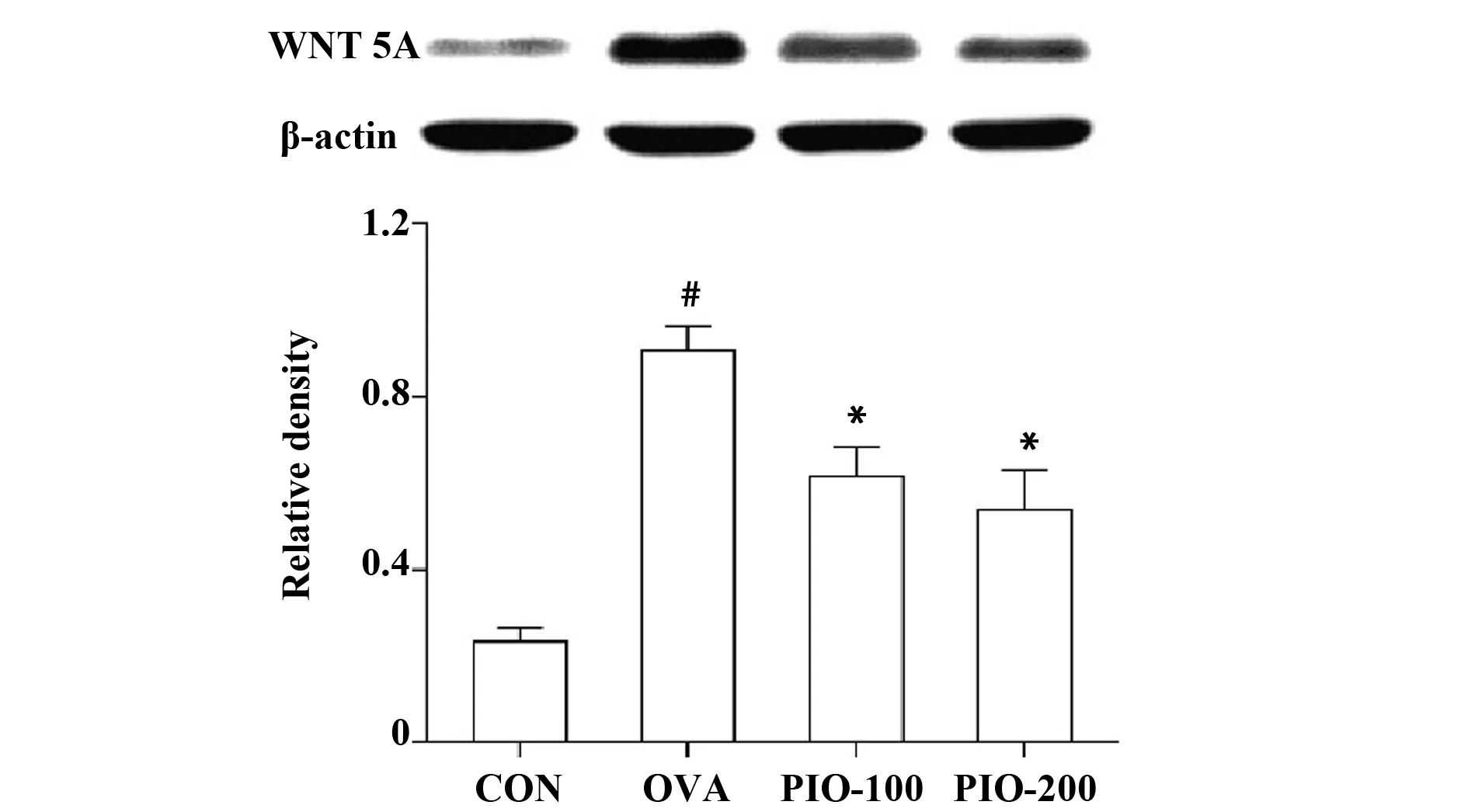
图6 桦褐孔菌多糖对WNT 5A表达的影响Fig.6 Effect of polysaccharide from inonotus oblipuus on expression of WNT 5A in asthmatic miceNote: #.P<0.05 vs CON;*.P<0.05 vs OVA.
3 讨论
气道重构的病理学特征是由于胶原蛋白沉积,杯状细胞增生,气道平滑肌厚度增加,新生血管增多等导致的上皮增厚[1]。目前哮喘的治疗主要是使用吸入性皮质类固醇。虽然这些药物在抗哮喘炎症方面非常有效,但它们在调节气道重构方面效果十分有限,并且长时间高剂量使用时会产生严重的副作用。从桦褐孔菌中提取的多糖具有抗氧化性能,可用于自由基清除和抗炎治疗,并且无副作用,已成为食品和药品研究的重点[8]。本研究结果表明,PIO能够抑制气道重构小鼠肺组织病理学改变,炎症细胞浸润,气道高反应性,BALF中细胞因子的水平。这一结果表明,PIO对于哮喘气道重构具有抑制作用。接下来我们又探讨了PIO抗气道重构可能的作用机制。PI3K通过调节基础细胞反应,包括增殖、分化和细胞迁移,在各种炎症细胞中发挥重要作用。Takeda等[9]研究表明,在PI3Kγ缺陷小鼠中,炎性细胞积聚、气道重构和气道高反应性等现象明显缓解。此外,PI3K抑制剂,LY294002和Wortma-nnin均显示在哮喘模型中发挥作用[10]。Akt是PI3K的下游效应子,是PI3K的直接靶基因,也是该途径的中心环节。通常,Akt磷酸化可以用作PIK3活性的指标[11]。作为PI3K/Akt途径的下游靶标,NF-κB是加剧炎性疾病的关键调节剂[3]。MMP-9是参与哮喘的主要蛋白酶之一,在气道重构中发挥重要作用,能够促使气道壁胶原沉积,气道狭窄,因此导致气道功能障碍。我们在研究中发现,p-PI3K、p-Akt和MMP-9的表达以及NF-κB核转移受到PIO的抑制,而在哮喘气道重构模型中则显著增加。近年来研究表明,WNT 5A参与激活PI3K信号通路并与哮喘气道炎症和气道重构关系密切,本实验研究显示PIO能够抑制哮喘气道重构小鼠肺组织WNT 5A表达的增加,暗示WNT 5A可能参与哮喘气道重构。
综上所述,本研究表明PIO可能通过PI3K/Akt/NF-κB/MMP-9信号抑制哮喘炎症和气道重构。
