米曲霉来源α-半乳糖苷酶基因gal A在毕赤酵母中的表达及其对豆浆中大豆寡糖的酶解效果
2018-11-16郭昱含杨勇智郭贺楠曹云鹤
郭昱含 杨勇智 郭贺楠 王 剑 曹云鹤
(中国农业大学动物科学技术学院,动物营养学国家重点实验室,北京 100193)
大豆、大豆产品及大豆加工副产品是人及动物重要的蛋白质来源,在食品和饲料领域有着广泛的应用。大豆中含有多种抗营养因子如胰蛋白酶抑制剂、植酸、单宁和大豆寡糖等[1-2],其中大豆寡糖中的棉籽糖和水苏糖等α-半乳糖苷类寡糖,由于人和单胃动物体内缺少相应的水解酶α-半乳糖苷酶(α-galactosidase,EC 3.2.1.22),这些寡糖只能在后肠段被微生物发酵,这一过程中会产生CO2和甲烷等气体,造成胀气、腹痛、恶心和腹泻等胃肠不适,影响营养物质的消化吸收,对人体健康和动物的生产性能造成负面影响。用α-半乳糖苷酶酶解是消除大豆寡糖抗营养因子的常用方法之一。
α-半乳糖苷酶又称蜜二糖酶,是一种外切糖苷酶,能特异性水解α-半乳糖苷末端非还原性的α-1,6-半乳糖残基,其可作用于含半乳糖的低聚寡糖如蜜二糖、棉籽糖、水苏糖和毛蕊花糖等,还可以作用于含半乳糖的多聚糖如半乳甘露聚糖和半乳糖脂等。α-半乳糖苷酶分布广泛,咖啡豆等豆科植物的种子、番茄和烟草中均可分离得到α-半乳糖苷酶[3-5],嗜热细菌HB27、巨大芽孢杆菌、热解纤维素菌、脆弱类杆菌、假交替单胞菌和天蓝色链霉菌等细菌[6-11],尖孢镰刀菌、双孢蘑菇、榆黄蘑和里氏木霉等真菌[12-15]以及人和鼠等哺乳动物[16-17]中也能分离得到α-半乳糖苷酶。
α-半乳糖苷酶在医疗、饲料、食品和造纸等行业都有广泛的应用。在医疗领域中,α-半乳糖苷酶在法布里病的治疗、血型转换和异种器官的移植方面有重要应用,Alcalay等[18]的研究结果显示α-半乳糖苷酶A与帕金森病有关联。在饲料领域,外源添加α-半乳糖苷酶能够有助于消除豆粕等饲料原料中大豆寡糖的抗营养作用,提高猪和家禽的生产性能,降低饲料成本[19-22]。在食品领域,α-半乳糖苷酶除了可以消除豆浆和豆奶中的大豆寡糖,还在制糖工业中有重要应用,能够消除棉籽糖对蔗糖的妨碍作用,提高蔗糖得率[23]。此外,在造纸生产中组合使用α-半乳糖苷酶与木聚糖酶可以增强漂白效果[24],α-半乳糖苷酶能够与环糊精相互作用,生成的α-半乳糖-环糊精在一些重要的保健食品中有应用潜力。
米曲霉是粮食食品酿造和酿酒的主要菌种之一,在药品制备、工业酶制剂和饲料生产上均有重要而广泛的应用,被美国食品药品监督管理局列为公认安全的生物体(generally recognized as safe,GRAS),可以发酵产生天门冬氨酰氨基肽酶、β-半乳糖苷酶、蛋白酶和角质酶等多种酶[25-28]。
本试验组前期从北京市通州区的土壤中分离得到了1株产α-半乳糖苷酶的米曲霉,本试验克隆了该米曲霉来源的α-半乳糖苷酶基因galA,依据毕赤酵母使用密码子的偏好性进行基因序列的优化,构建毕赤酵母工程菌株,摇瓶诱导表达研究其酶学性质,并验证该酶对豆浆中大豆寡糖的酶解效果。
1 材料与方法
1.1 试验材料
1.1.1 菌株和载体
大肠杆菌(Escherichiacoli,E.coli)Top 10感受态细胞购自北京天根生化科技有限公司,大肠杆菌克隆载体pGM-T、毕赤酵母表达载体pPICZαA、毕赤酵母X-33菌株均为本实验室保存,米曲霉是从北京市通州区的土壤中分离得到(经过18S rRNA序列鉴定)。
1.1.2 工具酶及主要试剂
Phusion DNA聚合酶、EcoRⅠ和NotⅠ购自New England Biolabs公司,Zeocin购自Invitrogen公司,dNTPs和SacⅠ购自TaKaRa公司,对硝基苯基-α-D-吡喃半乳糖苷(pNPG)购自Solarbio公司,琼脂糖凝胶回收试剂盒、真菌基因组DNA提取试剂盒、酵母基因组DNA提取试剂盒和高纯质粒小量制备试剂盒购自Omega公司,棉籽糖和蔗糖购自Dr. Ehrenstorfer GmbH公司,半乳糖和水苏糖购自北京百灵威科技有限公司。
1.2 试验方法
1.2.1 米曲霉来源α-半乳糖苷酶基因galA的克隆与分析
以NCBI数据库中公开的米曲霉来源α-半乳糖苷酶基因galA的mRNA序列(GenBank登录号:XP_001817311.1)为依据,设计1对特异性引物galA-F(5′-ATGCGACTTATCACAAGATGGATACCGCTA-3′)和galA-R(5′-TTACAATGCGACATGGACACCAGCGGGTAA-3′),以米曲霉总DNA为模板进行PCR扩增。PCR的反应条件为:98 ℃ 5 min;98 ℃ 30 s,58 ℃ 30 s,72 ℃ 2.5 min,30个循环;72 ℃延伸10 min。反应结束后,取PCR产物5 μL进行1%琼脂糖凝胶电泳,确认PCR扩增效果。将回收后的基因片段与载体pGM-T于16 ℃连接过夜后,转入大肠杆菌Top 10感受态细胞,重组质粒pGM-T-galA送至北京梓熙生物科技有限公司进行测序验证,测序引物为galA-F和galA-R。序列结果用BioEdit软件进行分析。
1.2.2 α-半乳糖苷酶基因galA毕赤酵母表达菌株的构建
以pGM-T-galA为模板,以EcoRⅠ-galA-F和NotⅠ-galA-R为引物,扩增质粒中的galA基因。引物序列如下:EcoRⅠ-galA-F,5′-CCGGAATTCATGCGACTTATCACAAG-3′(下划线为EcoRⅠ酶切位点),NotⅠ-galA-R,5′-ATTTGCGGCCGCTTACAATGCGACATG-3′(下划线为NotⅠ酶切位点)。PCR的反应条件同1.2.1。用限制性内切酶EcoRⅠ和NotⅠ对PCR产物和载体pPICZαA进行双酶切,置于37 ℃水浴酶切12 h后,将基因片段与载体于16 ℃连接过夜,转入大肠杆菌Top 10感受态细胞。将重组表达质粒pPIC-galA-wt(wt表示野生型,下同)送至北京梓熙生物科技有限公司进行测序验证,测序引物为AOX-F和AOX-R,序列结果用BioEdit软件进行分析。
根据毕赤酵母使用密码子的偏好性,对使用频率低的密码子进行替换,优化galA的基因序列。优化的合成和测序由北京梓熙生物科技有限公司完成。优化后的表达载体pPIC-galA-opt(opt表示优化型,下同)的构建方法同上。
将重组表达质粒pPIC-galA-wt和pPIC-galA-opt用限制性内切酶SacⅠ线性化。37 ℃酶切过夜后电转入新配制的毕赤酵母X-33感受态细胞,电击完成后立即加入1 mL冰预冷的1 mol/L的山梨醇溶液,充分混匀后转移至50 mL离心管中,28 ℃培养3 h。将菌体悬液涂布于YPDS固体培养基(含有100 μg/mL Zeocin),28 ℃培养约3 d,直至长出清晰的菌落。挑取单菌落划线至YPD固体培养基(含有100 μg/mL Zeocin),28 ℃培养3~4 d,至菌落清晰。
1.2.3 重组菌株的摇瓶发酵
挑取X33/galA-wt和X33/galA-opt单菌落,分别接种于10 mL的YPD液体培养基(含有100 μg/mL Zeocin)中,250 r/min、28 ℃培养约24 h,取100 μL的菌液至50 mL的BMGY液体培养基中,250 r/min、28 ℃培养至600 nm波长下吸光度(OD600)达到2.0,将全部BMGY液体培养基以5 000 r/min、4 ℃离心10 min,弃掉上清,用50 mL的BMMY液体培养基重悬菌体,250 r/min、28 ℃培养。每24 h向培养液中加无水甲醇(终浓度0.5%)进行诱导。120 h后,将菌液于常温下12 000 r/min离心10 min,取上清液,置于4 ℃保存。
1.2.4 α-半乳糖苷酶活性的测定
参照Rezessy-Szabó等[29]的方法进行α-半乳糖苷酶活性的测定。配制浓度分别为0、2、4、8、16、24、32和40 μmol/L的对硝基苯酚标准梯度溶液,测定溶液在405 nm波长下的吸光度(OD405)。以OD405为横坐标,以对硝基苯酚的浓度为纵坐标,绘制标准曲线。
取100 μL底物溶液pNPG(10 mmol/L)与100 μL用pH 4.33的柠檬酸-磷酸氢二钠缓冲液适当稀释的酶液,55 ℃条件下反应10 min,加入800 μL的Na2CO3溶液(0.5 mol/L)终止反应,测定溶液的OD405。α-半乳糖苷酶活性的定义为:在55 ℃和pH 4.33的条件下,每分钟从浓度为10 mmol/L的pNPG底物溶液中释放1 μmol对硝基苯酚所需要的酶量为1个活性单位(U)。
1.2.5 α-半乳糖苷酶的酶学性质分析
最适pH:配制pH分别为2.00、3.00、4.00、5.00、6.00、7.00和8.00的柠檬酸-磷酸氢二钠缓冲液,用上述不同pH的缓冲液稀释酶液和配制10 mmol/L的pNPG底物溶液,在55 ℃条件下测定α-半乳糖苷酶活性。
pH稳定性:在室温下,将酶液分别在上述不同pH的缓冲液中预处理30 min,最适条件下测定残余α-半乳糖苷酶活性。
最适温度:分别在10、20、30、35、40、45、50、55、60、65、70、75和80 ℃下测定α-半乳糖苷酶活性,确定最适温度。
温度稳定性:将酶液分别置于40和45 ℃保温100 min,每20 min取样;分别置于50 和55 ℃保温50 min,每10 min取样;置于60 ℃保温12 min,每2 min取样;置于65 ℃保温10 min,每2 min取样;置于70 ℃保温5 min,每1 min取样。每个温度设置1个对照组,对照组的酶液置于4 ℃保温,其余条件均与试验组相同。处理后在最适条件下测定α-半乳糖苷酶活性。
金属离子抗性:用最适pH的柠檬酸-磷酸氢二钠缓冲液配制浓度为20 mmol/L的不同金属化合物[CuSO4、KCl、(NH4)2SO4、MgCl2、CaCl2、ZnSO4、NaCl、CoSO4、NaNO3和MnSO4]溶液,将酶液与金属化合物溶液等体积混合,使金属离子终浓度为10 mmol/L。以不添加金属离子的酶液作为空白对照。室温下处理1 h后在最适条件下测定α-半乳糖苷酶活性。
酶动力学参数:用最适pH的柠檬酸-磷酸氢二钠缓冲液配制浓度分别为1、10/9、5/4、10/7、5/3、2、5/2、10/3、5、10和20 mmol/L的pNPG底物溶液。在最适条件下测定α-半乳糖苷酶活性。根据Eadie-Hofstee作图法测定米氏常数(Km)和最大反应速度(Vmax)。
1.2.6 α-半乳糖苷酶对豆浆中大豆寡糖的体外酶解效果分析
将自制的10%(质量体积分数)豆浆溶液以10 000 r/min离心15 min后取上清液,用pH 4.33的柠檬酸-磷酸氢二钠缓冲液调节pH为5.00,作为反应液。取10 mL上述豆浆反应液于15 mL离心管中,按照以下条件设置进行试验。试验设置6个处理,分别是:1)加酶量0.6 U,温度25 ℃;2)加酶量1.2 U,温度25 ℃;3)加酶量2.4 U,温度25 ℃;4)加酶量0.6 U,温度45 ℃;5)加酶量1.2 U,温度45 ℃;6)加酶量2.4 U,温度45 ℃。每个处理设置2个平行1个对照,对照加入2 mL的柠檬酸-磷酸氢二钠缓冲液(pH 4.33)。在反应0.5、1.0、1.5、2.0、2.5、3.0、4.0、5.0、6.0、8.0、10.0和12.0 h时分别取样500 μL,立即100 ℃水浴5 min,冷却至室温后10 000 r/min离心10 min,用超纯水将上清液稀释500倍,过0.10 μm滤膜于接样瓶中,进行离子色谱,分析其半乳糖、葡萄糖、果糖、蔗糖、棉籽糖和水苏糖含量的变化,并根据水苏糖和棉籽糖含量的变化计算降解率。
2 结果与分析
2.1 α-半乳糖苷酶基因gal A的PCR扩增及序列比对分析
以提取的米曲霉总DNA为模板,用特异性引物galA-F和galA-R来进行PCR扩增,经1%琼脂糖凝胶电泳检测,结果见图1,在约1 600 bp处可见1条清晰的条带,与预期结果相符。

M:DL-2000分子量标准;1:α-半乳糖苷酶基因gal A PCR扩增产物。
PCR产物与大肠杆菌克隆载体pGM-T连接后转化到大肠杆菌Top 10感受态细胞,筛选出阳性克隆进行测序。序列分析结果表明,PCR扩增得到的DNA片段为目的基因,基因全长1 605 bp,不含内含子,编码534个氨基酸,包含25个氨基酸的信号肽,有2个天冬氨酸催化位点,预测蛋白质的等电点为4.57(https://web.expasy.org/cgi-bin/compute_pi/pi_tool),属于糖基水解酶27(GH27)家族。
将该基因与NCBI上已知序列进行比对,结果见图2。本试验中米曲霉来源的α-半乳糖苷酶基因galA与2种已报道的米曲霉来源的α-半乳糖苷酶基因(NCBI参考序列:XP_001817311.1;GenBank登录号:OOO13450.1)的序列一致性为100%,但关于这2种酶的酶学性质并没有报道。
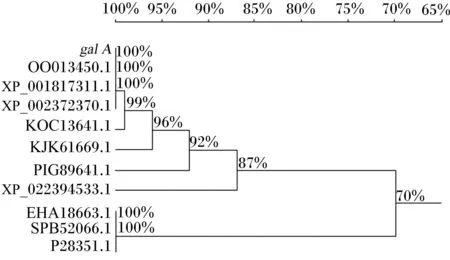
米曲霉 Aspergillus oryzae(GenBank登录号:OOO13450.1);米曲霉RIB40 Aspergillus oryzae RIB40(NCBI参考序列:XP_001817311.1);黄曲霉NRRL3357 Aspergillus flavus NRRL3357(NCBI参考序列:XP_002372370.1);黄曲霉AF70 Aspergillus flavus AF70(GenBank登录号:KOC13641.1);寄生曲霉SU-1 Aspergillus parasiticus SU-1(GenBank登录号:KJK61669.1);Aspergillus arachidicola(GenBank登录号:PIG89641.1);Aspergillus bombycis(NCBI参考序列:XP_022394533.1);黑曲霉ATCC1015 Aspergillus niger ATCC1015(GenBank登录号:EHA18663.1);黑曲霉 Aspergillus niger(GenBank登录号:SPB52066.1);黑曲霉 Aspergillus niger(UniProtKB/Swiss-Prot:P28351.1)。
2.2 α-半乳糖苷酶基因序列的优化
根据毕赤酵母使用密码子的偏好性,以不改变氨基酸序列为前提,对去除信号肽的α-半乳糖苷酶基因序列进行优化,优化前后的序列比较见图3,galA-wt与galA-opt核苷酸序列的一致性为76.68%。
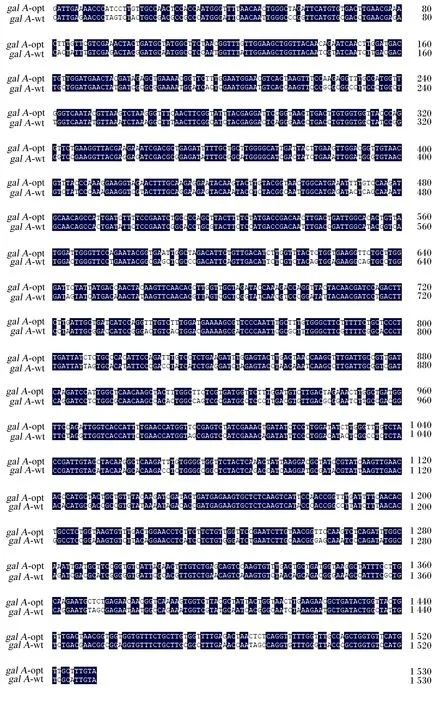
黑色阴影为野生序列与优化序列一致部分。
2.3 毕赤酵母工程菌株的摇瓶表达
将构建好的野生型和优化型α-半乳糖苷酶毕赤酵母工程菌株进行摇瓶发酵,结果见表1。由表中数据可以发现,在发酵最初的48 h,野生型和优化型工程菌株的α-半乳糖苷酶活性均快速提高,随后增速减缓。在摇瓶发酵全过程中,优化型工程菌株的α-半乳糖苷酶活性始终高于野生型工程菌株。诱导120 h后,优化型工程菌株的α-半乳糖苷酶活性比野生型工程菌株提高了285%。野生型和优化型α-半乳糖苷酶毕赤酵母工程菌株摇瓶表达产物的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)图见图4。将目的条带切下进行质谱鉴定,鉴定结果显示摇瓶发酵产物确为α-半乳糖苷酶。

表1 重组菌株摇瓶发酵活力
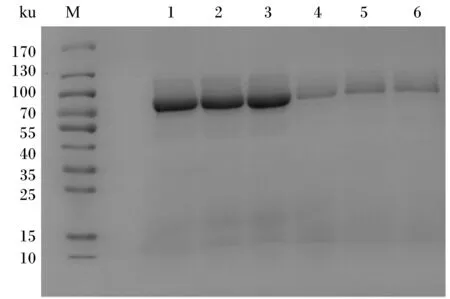
M:分子量标准;1~3:优化型工程菌株;4~6:野生型工程菌株。
2.4 α-半乳糖苷酶的酶学性质分析
2.4.1 最适pH和pH稳定性
55 ℃条件下,测定α-半乳糖苷酶在pH 2.00、3.00、4.00、5.00、6.00、7.00和8.00的柠檬酸-磷酸氢二钠缓冲液中的活性,结果显示,α-半乳糖苷酶活性最大值出现在pH 3.00~5.00间。因此,在pH 3.00~5.00间再设置梯度,55 ℃条件下再次测定α-半乳糖苷酶在pH 2.00、3.00、3.33、3.66、4.00、4.33、4.66、5.00、6.00、7.00和8.00的柠檬酸-磷酸氢二钠缓冲液中的活性,结果显示,该酶的最适pH为4.33,当pH在3.33~5.00间时可保持60%以上的相对活性(图5)。
室温下,将酶液在不同pH的柠檬酸-磷酸氢二钠缓冲液中预处理30 min后,在最适条件下测残余α-半乳糖苷酶活性,结果如图6所示,该酶在pH 3.00~8.00的条件下稳定性良好,在pH 2.00条件下处理30 min后,仍保持60%的相对活性。

图5 pH对α-半乳糖苷酶活性的影响
2.4.2 最适温度和温度稳定性
在pH 4.33的条件下,分别于10、20、30、35、40、45、50、55、60、65、70、75和80 ℃的温度下测定α-半乳糖苷酶的活性,结果显示,α-半乳糖苷酶的最适温度为55 ℃。当温度低于55 ℃时,该酶的活性随温度的升高而逐渐增加;当温度超过55 ℃时,该酶的活性则随温度的升高而下降。当温度在40~60 ℃间时,该酶的相对活性可保持在50%以上(图7)。
图8显示的是α-半乳糖苷酶活性的温度稳定性,该酶在40和45 ℃条件下预处理100 min,活性几乎不变;在50 ℃条件下预处理50 min,活性几乎不变;在55 ℃条件下预处理50 min后残余α-半乳糖苷酶的相对活性约为50%;当温度超过60 ℃时,短时间内α-半乳糖苷酶即可失活。
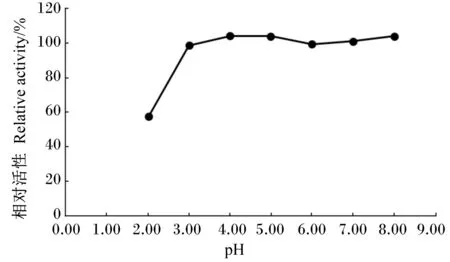
图6 α-半乳糖苷酶活性的pH稳定性

图7 温度对α-半乳糖苷酶活性的影响

图8 α-半乳糖苷酶活性的温度稳定性
2.4.3 金属离子抗性
从表2可知,MnSO4对α-半乳糖苷酶的活性有较强的抑制作用,而KCl、(NH4)2SO4和CuSO4则可提高α-半乳糖苷酶的活性。其他金属离子对α-半乳糖苷酶活性的影响不明显。
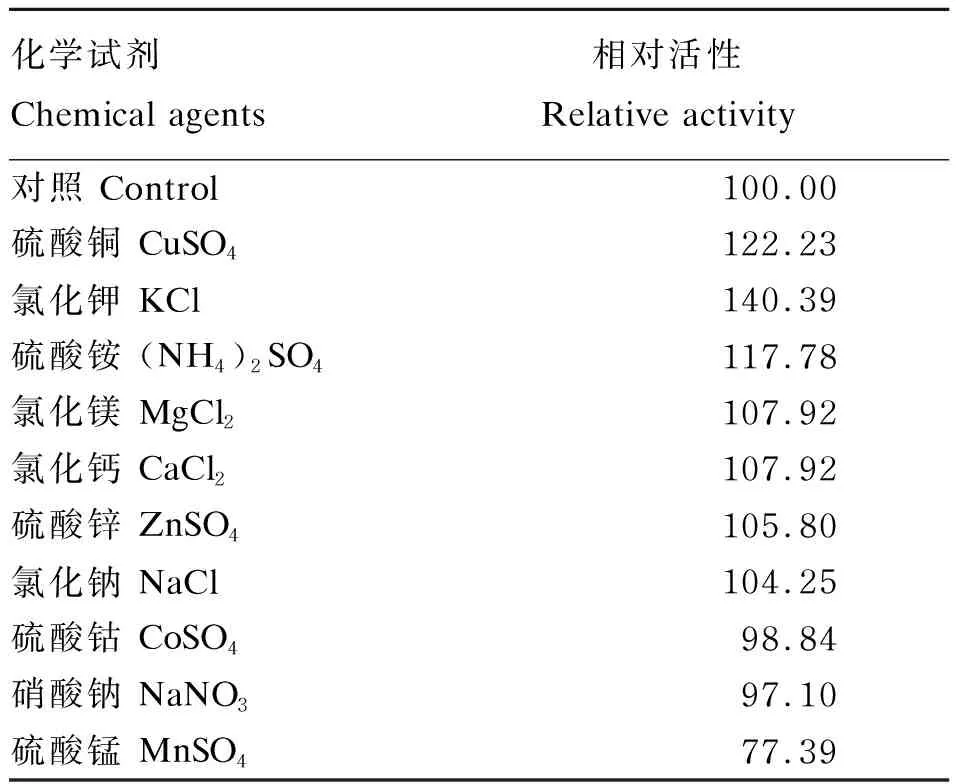
表2 金属离子对α-半乳糖苷酶活性的影响
2.4.4 酶动力学参数
以pNPG为底物,用Eadie-Hofstee作图法测定Km和Vmax,结果如图9所示。可知,该酶的Km为0.024 3 mol/L,Vmax为1.0×10-7mol/(L·s)。
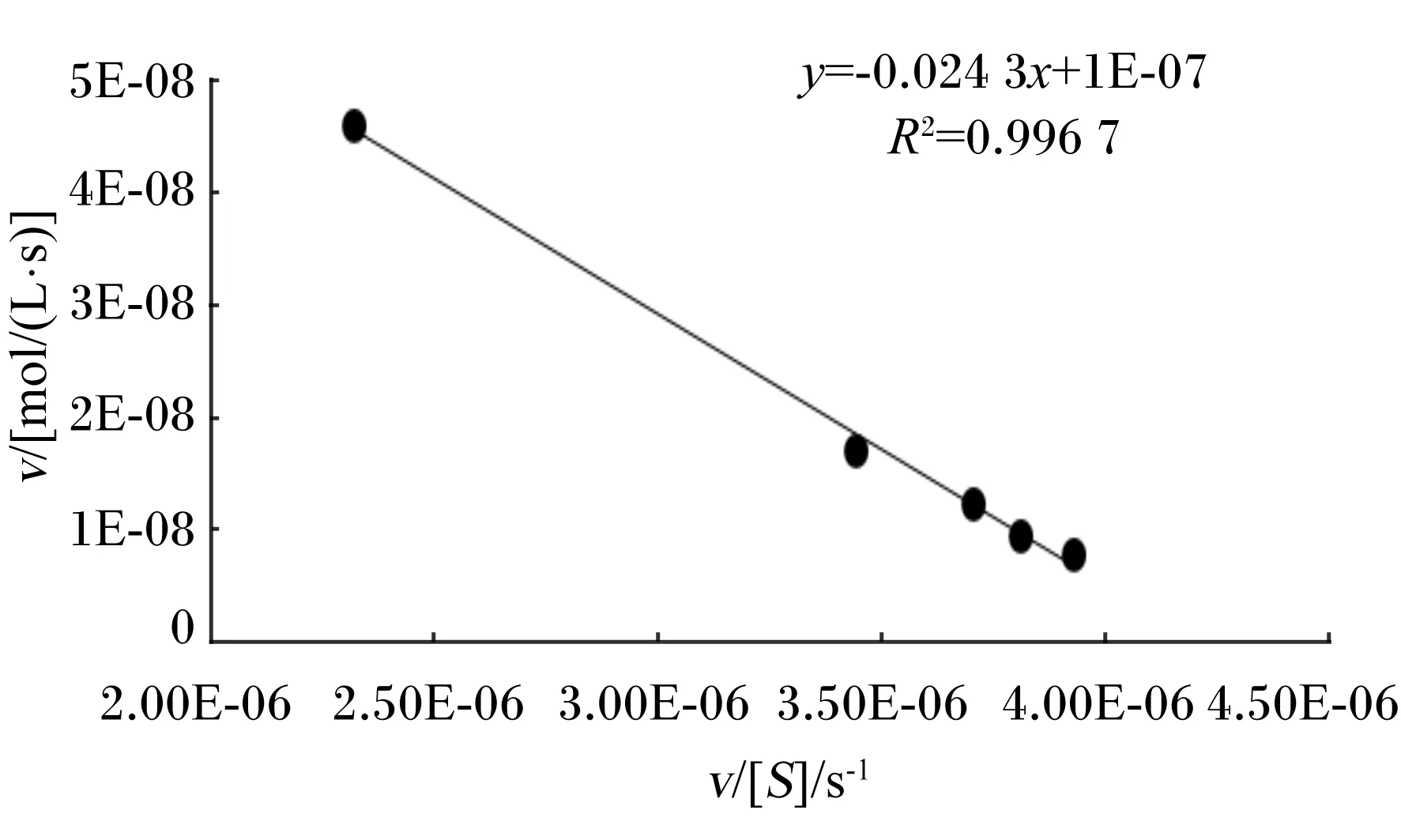
v:平均反应速率[mol/(L·s)];[S]:底物浓度(mol/L)。
2.5 α-半乳糖苷酶对豆浆中大豆寡糖的酶解效果
设置不同的温度和不同加酶量,验证α-半乳糖苷酶对豆浆中大豆寡糖的酶解效果。对酶解产物进行离子色谱分析,根据各组分的保留时间采用外标法对峰面积积分,得出各组分的含量。记录结果,分析并计算各处理条件下棉籽糖和水苏糖随酶解时间的增加其含量的变化。结果显示,在25 ℃条件下,3个加酶量处理下棉籽糖和水苏糖的含量均几乎不变,在45 ℃条件下,3个加酶量处理下中棉籽糖和水苏糖的含量有所减少,且加酶量大的处理减少的更多,反应12 h后,加酶量为1.2 U的处理棉籽糖降解率为4.8%,水苏糖降解率为8.0%,加酶量为2.4 U的处理棉籽糖降解率达到50.0%,水苏糖降解率达到31.9%。
3 讨 论
3.1 α-半乳糖苷酶基因序列的优化
毕赤酵母是一种常用的外源蛋白质表达系统,其对密码子具有偏好性,当序列中出现较多的稀有密码子时,表达效率可能表现出明显的降低,甚至导致翻译提前终止,蛋白质表达受阻。因此,研究中通常根据毕赤酵母使用密码子的偏好性,用常用的密码子替换稀有密码子,对基因序列进行优化,可以明显提高蛋白质的表达水平。Chang等[30]根据毕赤酵母密码子偏好性对皱落假丝酵母脂肪酶基因序列进行了优化,结果表明优化后的脂肪酶蛋白质表达量为152 mg/L,是野生型(33 mg/L)的4.6倍。在本试验中,根据毕赤酵母使用密码子的偏好性,以不改变氨基酸序列为前提,对去除信号肽的α-半乳糖苷酶基因序列进行优化,galA-wt与galA-opt核苷酸序列的一致性为76.68%。优化型和野生型α-半乳糖苷酶毕赤酵母工程菌株同时发酵120 h,在发酵过程中优化型工程菌株的α-半乳糖苷酶活性高于野生型工程菌株,在发酵结束时优化型工程菌株的α-半乳糖苷酶活性比野生型工程菌株提高了285%。
3.2 α-半乳糖苷酶的酶学性质分析
来源不同,α-半乳糖苷酶的酶学性质也各不相同。真菌来源的α-半乳糖苷酶最适pH通常在4~6,最适温度一般在40~70 ℃。Katrolia等[31]对米黑根毛霉α-半乳糖苷酶基因进行克隆并在大肠杆菌中表达,结果显示,其α-半乳糖苷酶基因开放阅读框为2 256 bp,编码751个氨基酸,最适pH和最适温度分别为4.5和60 ℃。Rezessy-Szabó等[29]对疏棉状嗜热丝孢菌CBS 396.62/b中的α-半乳糖苷酶进行研究,显示该酶的最适pH为5.0~5.5,最适温度为65 ℃。本试验中,米曲霉来源的α-半乳糖苷酶在pH 4.33和温度55 ℃条件下相对活性最大。在实际生产中,对酶的稳定性特别是温度稳定性要求较高,对酶热稳定性的研究也逐渐增多。Aulitto等[6]报道的产耐热性α-半乳糖苷酶的菌株嗜热细菌HB27的最适温度为90 ℃,在70 ℃下6 h后残余α-半乳糖苷酶相对活性高达90%,30 h后仍可达50%,在90 ℃下保持1 h后残余α-半乳糖苷酶相对活性约为50%。
本试验中研究的α-半乳糖苷酶具有较好的pH稳定性,在pH 3.00~8.00的条件下处理30 min活性几乎不变,在pH 2.00条件下处理30 min后,仍保持60%的相对活性。温度稳定性方面,该酶在温度低于55 ℃时稳定性较高,在55 ℃条件下50 min后残余α-半乳糖苷酶相对活性为50%,当温度为60 ℃时,10 min后α-半乳糖苷酶的活性损失接近1/2,70 ℃条件下5 min后α-半乳糖苷酶即完全失活。此外,本试验得到的α-半乳糖苷酶对试验中的大部分金属离子的抗性较好,而MnSO4对α-半乳糖苷酶的活性有较强的抑制作用,KCl、(NH4)2SO4和CuSO4则可提高α-半乳糖苷酶的活性。
3.3 α-半乳糖苷酶对豆浆中大豆寡糖的酶解效果
α-半乳糖苷酶酶解大豆寡糖属于消除大豆寡糖抗营养作用的生物学方法。Huang等[32]将巨大芽孢杆菌来源的α-半乳糖苷酶在大肠杆菌中进行表达,其最适温度为37 ℃,最适pH为6.8,向1 mL豆浆中加入1 U/mL该酶或者该酶与胰蛋白酶的混合物,37 ℃条件下进行酶解,可有效降解豆浆中的棉籽糖和水苏糖,且α-半乳糖苷酶与胰蛋白酶同时存在时更利于大豆寡糖的降解,4 h内即可完全降解豆浆中的棉籽糖和水苏糖。在本试验中,用发酵所得的粗酶液超滤掉金属离子后进行豆浆中大豆寡糖的酶解,设置2个温度(25和45 ℃)和3个加酶量(0.6、1.2和2.4 U),对10 mL豆浆(调节pH为5.00)进行酶解。较低温度(25 ℃)条件下豆浆中棉籽糖和水苏糖的含量几乎不变,较高温度(45 ℃)与最高加酶量(2.4 U)条件下酶解12 h,棉籽糖和水苏糖的降解率分别为50.0%和31.9%。与其他大豆寡糖降解试验的结果相比,本试验中棉籽糖和水苏糖的降解效率低且降解效果差,造成这一现象的原因可能有:1)豆浆的pH为6.30[33],本试验中α-半乳糖苷酶的最适pH为4.33,pH稳定性表明该酶在pH 3.00~8.00的条件下室温处理30 min后保持大约90%的相对活性,且pH为5.00时的稳定性好于pH为6.00时(相对活性分别为103%和99%),由于酶解反应持续时间长,为了让酶在反应过程中保持更好的稳定性,选择用pH 4.33的柠檬酸-磷酸氢二钠缓冲液调节豆浆pH为5.00后再加酶进行反应。已有的α-半乳糖苷酶酶解豆浆的研究中,或者选择酶的最适pH为反应条件[32],或者直接向豆浆中加入酶液[33-34],棉籽糖和水苏糖均被完全降解。本试验中选择的pH条件不合适,可能导致α-半乳糖苷酶的活性被抑制,无法发挥酶解作用。2)反应体系不合适。本试验中加酶量较低,需要降解的豆浆体系较多,反应过程中酶与底物接触不充分,导致酶解不充分。3)本试验中25 ℃条件下棉籽糖和水苏糖几乎没有被降解,这可能是低温下α-半乳糖苷酶活性受到抑制,也可能与大豆中其他抗营养因子的抑制作用有关。
4 结 论
① 本试验克隆出了米曲霉来源α-半乳糖苷酶galA基因序列,该基因全长1 605 bp,不含内含子,编码534个氨基酸,含有1个25个氨基酸长度的信号肽;构建了野生型和优化型α-半乳糖苷酶毕赤酵母工程菌株,摇瓶发酵120 h后α-半乳糖苷酶活性分别为0.507和1.952 U/mL,优化型工程菌株的α-半乳糖苷酶活性比野生型工程菌株提高了285%。
② 本试验中生产的α-半乳糖苷酶的最适pH为4.33,最适温度为55 ℃,有较好的金属离子抗性,以pNPG为底物进行酶动力学参数的测定,该酶的Km为0.024 3 mol/L,Vmax为1.0×10-7mol/(L·s)。
③ 用本试验中生产的α-半乳糖苷酶进行豆浆中大豆寡糖的体外酶解试验,当温度为45 ℃、加酶量为2.4 U时,反应12 h后棉籽糖的降解率为50.0%,水苏糖的降解率为31.9%,降解效果较好,该α-半乳糖苷酶对降解大豆寡糖具有潜力。
