益生菌对Toll样受体-核转录因子-κB信号通路调控作用的研究进展
2018-11-16张爱忠杨卓妮娜
聂 炼 张爱忠 姜 宁 杨卓妮娜
(黑龙江八一农垦大学动物科技学院,大庆 163319)
Toll样受体(Toll-like receptor,TLR)是重要的模式识别受体(pattern recognition receptors,PRRs),可以识别病原相关分子模式(pathogen-associated molecular patterns,PAMPs),进而引发下游通路,调控细胞因子、炎症因子等的转录表达[1]。核转录因子-κB(nuclear factor-κB,NF-κB)广泛存在动物体所有细胞中,是连接固有免疫和适应性免疫的桥梁[2]。未活化状态下NF-κB与NF-κB的抑制蛋白(inhibitor kappa B,IκB)结合处于休眠状态,当受到上游信号的刺激时会快速响应,进而启动免疫应答。大多数研究结果表明,在患有炎症疾病的人类和动物体内,NF-κB处于过度活化状态,使炎症反应加重危害健康。益生菌以其强大的益生作用广泛的应用于人和动物中,不仅可以增强机体免疫力、促进胃肠道消化和调节肠道菌群平衡,近年的研究结果表明益生菌还可以预防治疗溃疡性结肠炎、结肠癌等炎症疾病[3]。益生菌治疗炎症疾病涉及到的信号通路主要是TLR-NF-κB信号通路,通过下调TLR,抑制IκB的降解使NF-κB处于休眠状态达到减缓炎症反应的效果。因此,深入了解TLR-NF-κB信号通路的发生机理以及益生菌对其的调控机制对临床疾病的防治有着非常重要的指导意义。
1 TLR
1.1 结构与分类
TLR是一种可以特异性识别病原微生物的细胞表面模式识别受体,它的结构决定了其独特的功能。TLR属于横跨细胞膜的Ⅰ型跨膜蛋白,主要由胞外区、跨膜区和胞内区组成。其中胞内区是TLR的核心区域,它可以引起下游信号级联反应,激发其他信号通路的产生[4]。
TLR种类众多,其中人体中发现11种TLR(TLR1~TLR11),在鼠中发现13种TLR(TLR1~TLR13)。有报道称在鸡中也发现10种TLR,其中chTLR1LA、chTLR1LB和chTLR15是鸡特有的[5]。目前研究较为深入的有TLR2、TLR4、TLR5和TLR9。TLR在免疫系统中具有非常重要的作用,在树突状细胞、淋巴细胞、巨嗜细胞和上皮细胞均有表达。
1.2 TLR的配体
TLR可以特异性地识别病原微生物,通过其独特的跨膜结构,将信号传递到细胞中,引起其他级联反应,导致NF-κB等诱导因子的转化,从而启动固有免疫和获得性免疫。TLR可以识别很多配体,其中TLR1可以识别细菌、真菌细胞细胞壁部分;TLR2、TLR6可以识别损伤组织的双链RNA、脂蛋白、脂多糖、脂磷壁酸等;TLR3识别病毒双链RNA;TLR4可以识别脂多糖、防御素、纤维蛋白等;TLR5可以识别细菌鞭毛蛋白;TLR7可以识别单链RNA;TLR9可以识别DNA中非甲基化胞苷-磷酸盐-鸟苷(CpG)[6]。TLR可以识别的配体如图1所示。

图1 外来抗原微生物的不同细胞表面配体与TLR家族关系示意图
2 NF-κB
2.1 生物学特性
NF-κB是一种几乎存在于所有细胞中的反转录因子,一般情况下与NF-κB的抑制蛋白IκB结合处于休眠状态。在癌症和免疫学中,NF-κB扮演非常重要的角色,尤其是对免疫调节的作用。NF-κB家族有5个相关的转录因子,分别是p50、p52、p65、RelB和c-Rel,这些转录因子可以相互组合形成同源或者异源二聚体。NF-κB家族共同具有1个N-末端DNA结合域,也称Rel同源域(Rel homology domain,RHD),RHD可与多个靶基因结合来调节基因表达[7]。NF-κB可以调节包括白细胞介素(IL)-6、IL-8和肿瘤坏死因子(TNF)-α等400多种基因的表达,所以NF-κB经常被称为控制基因表达的开关。
2.2 在免疫系统中的作用
在免疫系统中,NF-κB可以影响免疫器官的形成,其中黏附分子、细胞因子、器官趋化因子都会受到NF-κB的调控。在敲除RelB的小鼠中,脾脏的发育受到影响产生缺陷,而在敲除RelB、p52的小鼠中,白髓区与红髓区之间的巨噬细胞也处于混乱状态[8]。NF-κB还可以参与造血细胞的增殖、分化和凋亡。有报道称,在缺失p50和p65的小鼠中出现了粒细胞增多症而影响细胞增殖;NF-κB在获得性免疫中扮演重要角色,在敲除p65的试验中,小鼠的B细胞、T细胞增殖、活化被抑制;此外,NF-κB会影响CD86和CD80的激活,CD8+T细胞的激活也会涉及到NF-κB的参与[9]。
2.3 介导的炎症反应
当机体正常生理功能受到威胁时会产生一种自我保护的方式,即炎症反应。炎症反应会对机体健康产生非常不利的影响,例如溃疡性结肠炎、癌症等,而大量研究表明,这些炎症反应均与NF-κB有关。NF-κB介导的炎症反应主要分为3个阶段,分别为潜伏阶段、诱导阶段和消退阶段。1)潜伏阶段:在受到NF-κB活化之前,与炎症刺激相关的细胞因子、与细胞增殖凋亡相关的基因和一些病毒基因表达量非常低,称为“基础水平”,这些处于潜伏阶段的基因在受到NF-κB诱导之后会迅速表达。在潜伏阶段,NF-κB家族中的Rel基因都会进行表达,p50会和p65形成异二聚体,并且与NF-κB的抑制物IκB相结合[10]。除此之外,p50自身形成二聚体p50—p50会游离在细胞中与其他调节因子作用保持下游基因的沉默,RelB和c-Rel也会有表达。但是由于这些家族基因都需要NF-κB的诱导,所以在潜伏期中表达量非常低[11]。2)诱导阶段:诱导NF-κB活化的诱导物主要有促炎因子、TNF和一些抗原,这些诱导物会与细胞表面或细胞内的识别受体相结合,引起级联反应,进而活化IκB激酶(IKK)复合物。IKKα、IKKβ和IKKγ是这类复合物的主要存在形式,其中IKKβ将IκB磷酸化,IκB进一步被蛋白酶降解。一般情况下IκB与p65—p50异二聚体相结合,在IκB被降解后,p65—p50异二聚体进入细胞核与下游基因上的特定位点结合并调控基因转录表达[12]。3)消退阶段:随着炎症反应的持续,促炎因子的浓度降低,IκB的降解也变得缓慢,NF-κB的表达会持续减少,进而降低炎症反应[13]。
3 益生菌对TLR-NF-κB信号通路的调节
3.1 TLR-NF-κB信号传导通路
TLR作为一种PRRs可以识别不同的外来微生物,进而启动非常复杂的细胞内信号转导通路。这些信号网络涉及到的接头蛋白和蛋白酶激酶主要包括p38丝裂原活化蛋白激酶、c-Jun氨基末端激酶、活化蛋白以及NF-κB[14]。由于对TLR2以及TLR4的研究深入,TLR-NF-κB信号通路也得到了较为充分的认识。目前大量研究证实NF-κB是TLR信号传递的主要通路,大量基因的表达都会受到TLR诱导的NF-κB通路的激活。在细胞中,NF-κB的RHD一般与其抑制因子IκB结合而处于休眠状态,当PAMPs刺激TLR的TIR区域,TLR产生反应并将信号传递到NF-κB通路,NF-κb与IκB迅速分开,NF-κB进入细胞核,在细胞核内与相关DNA序列结合,进而对下游细胞因子或靶基因进行调节。有趣的是,不同的TLR激活TLR-NF-κB信号通路的途径不同,目前普遍认为的2条途径分别是髓样分化因子88(myeloid differentiation factor 88,MyD88)依赖途径和MyD88非依赖途径[15]。TLR-NF-κB信号通路如图2所示。
MyD88依赖途径:在细胞间,脂多糖、IL-1和TNF等炎症因子与TLR4相结合,TLR4将信号传递到细胞内,TLR4的TIR区与MyD88的羧基端结合,并且MyD88的氨基端与IL-1受体相关激酶的氨基端结合,进而激活白细胞介素受体相关激酶(IRAK)自身的磷酸化,获得的IRAK1、IRAK2、IRAK4和IRAK6激活下游通路。其中IRAK1、IRAK2和IRAK4激活TNF受体,IRAK6激活IKK,IKK复合物使IκB磷酸化,IκB被泛素连接酶泛素化而降解,进而使原本与IκB相结合的NF-κB从休眠状态激活,NF-κB进入细胞核调控相关基因的转录表达。
MyD88非依赖途径:是指在信号传递过程中不经过MyD88作用,而通过信号传导中间体TLR衔接分子(Toll-like receptor adapter molecule,TICAM)1和TICAM2激活干扰素调控因子,干扰素调控因子经活化后进入细胞核内启动Ⅰ型干扰素基因的表达。Toll作用蛋白(Toll-interacting protein,TOLLIP)可以抑制TLR信号传递,阻止蛋白激酶的磷酸化,进而阻断MyD88依赖性信号传递途径[16]。Fu等[17]用脂多糖刺激奶牛子宫内膜上皮细胞,最后结果表明TLR4、转录因子和细胞因子mRNA水平显著上调,除此之外,TOLLIPmRNA水平也显著上调,说明脂多糖既激活了TLR4引导的MyD88依赖性途径,也激活了MyD88非依赖性途径。Hou等[18]研究表明脂多糖可以刺激敲除MyD88的细胞编码干扰素诱导基因的转录表达,直接通过干扰素调节因子3与NF-κB相结合来产生作用而不通过MyD88依赖途径。
3.2 益生菌对TLR-NF-κB信号通路的调节机制
益生菌作为饲料添加剂在畜牧业中有非常广泛的应用。在动物饲粮中添加益生菌可以实现有益菌在胃肠道中的定植、促进肠道黏膜和肠道免疫系统的发育、维护肠道黏膜结构的完整性、提高肠道菌群丰度,并且可通过多种方式维持肠道免疫平衡,对动物的健康生长、生产有非常积极的作用。除此之外,有大量研究表明益生菌可以通过抑制TLR-NF-κB信号通路的激活来改善肠道黏膜炎症,达到控制疾病的目的。
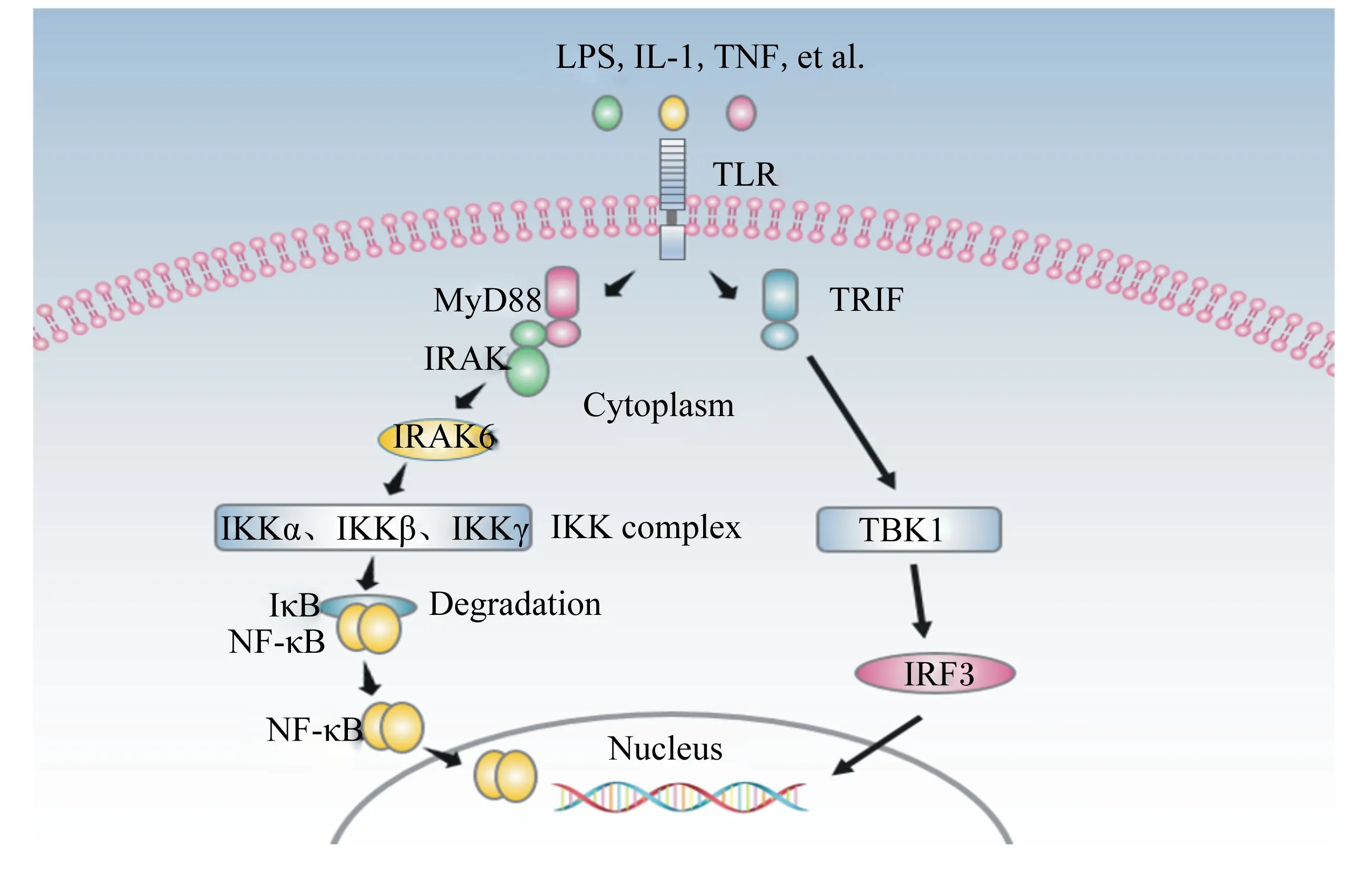
LPS:脂多糖 lipopolysaccharides;IL-1:白细胞介素-1 interleukin-1;TNF:肿瘤坏死因子 tumor necrosis factor:TLR:Toll样受体 Toll-like receptor;MyD88:髓样分化因子88 myeloid differentiation primary response protein 88;IRAK:白细胞介素受体相关激酶 interleukin receptor-associated kinase;IKK:核转录因子-κB抑制物激酶 inhibitor of nuclear factor-κB kinase;IκB:核转录因子-κB抑制蛋白 inhibitor of nuclear factor-κB;NF-κB:核转录因子-κB nuclear factor-κB;TRIF:β干扰素TIR结构域衔接蛋白 TIR-domain-containing adaptor inducing interferon-β;TBK1:箱式结合激酶1 tank-binding kinase 1;IRF3:干扰素调节因子-3 interferon regulatory factor-3;Cytoplasm:细胞质;IKK complex:IKK复合体;Degradation:降解;Nucleus:细胞核。
在无刺激条件下,细胞质中NF-κB与IκB结合在一起而处于休眠状态,当炎性因子刺激TLR,进而通过MyD88依赖途径激活NF-κB信号途径,IκB会被激酶磷酸化,经过泛素化而降解。当NF-κB与IκB分开后,会迅速进入细胞核内,与核内特定DNA特殊位点相结合,来启动与炎性反应相关基因的转录,最终产生炎症反应,危害动物体健康。研究发现,一些益生菌活菌体、死菌体及其胞外代谢物对动物体炎症反应有一定的改善作用[19]。当摄入益生菌时,益生菌可以对TLR-NF-κB信号通路进行干预,抑制TLR的表达,调控IκB的磷酸化和泛素化,抑制IκB的降解,阻止NF-κB进入细胞核,进而阻止NF-κB对下游因子的调控。益生菌也可以通过过氧化物酶体增殖物激活受体γ(PPARγ)依赖的信号通路将NF-κB亚基p65从细胞核中输导出来从而限制NF-κB通路,有效阻止肠炎的产生,改善胃肠道免疫环境[20]。目前关于益生菌对TLR-NF-κB信号通路的具体调控机制不甚清晰,进一步研究其调控机理对于益生菌在人和动物中的应用有非常重要的意义。
4 益生菌对不同细胞TLR-NF-κB信号通路的影响
4.1 对巨噬细胞TLR-NF-κB信号通路的影响
巨噬细胞是抗原呈递细胞中的一种,在机体免疫调节中起着非常重要的作用。一些益生菌分泌的可溶性因子可以通过调节巨噬细胞的TLR-NF-κB信号通路来调节炎症反应,避免机体组织损伤。Jang等[21]用脂多糖诱导巨噬细胞,通过乳酸杆菌G-101处理后可以降低巨噬细胞TNF-α、IL-6以及IL-1β的分泌量,进而减缓炎症反应。Matsumoto等[22]研究发现干酪乳酸杆菌可以下调了NF-κB的活性,抑制处于炎症状态的巨噬细胞对IL-6的分泌。除此之外,还有研究表明一些益生菌可以刺激巨噬细胞产生炎症反应,例如屎肠球菌可以刺激巨噬细胞产生IL-6和IL-10,而干酪乳酸杆菌可以诱导巨噬细胞产生IL-12[23]。
4.2 对上皮细胞TLR-NF-κB信号通路的影响
TLR-NF-κB信号通路是益生菌与不同上皮细胞作用的中枢,益生菌或其分泌物可以通过降低NF-κB的活性或者抑制IκB的降解来调控上皮细胞的炎症反应。Wang等[24]报道,植物乳杆菌可以抑制IκB的降解来减轻TNF引发的炎症反应。Sokol等[25]研究发现,普拉梭菌DSM17677能够抑制IL-1β引起的NF-κB活性,唾液链球菌也可抑制TLR-NF-κB信号通路的发生,下调IL-8的分泌来防止炎症反应。刘明超[26]研究发现用大肠杆菌感染奶牛子宫内膜上皮细胞会上调NF-κB2和p65的总蛋白表达,而通过鼠李糖乳杆菌GR-1预处理细胞抑制了这2类蛋白的表达,说明鼠李糖乳杆菌GR-1能够通过衰减MyD88依赖性和非依赖性信号传递途径的信号传导,加强NOD样受体(NLR)和TLR之间的相互作用,进而减少炎症细胞因子IL-1、IL-18、TNF-ɑ和IL-6等的释放,从而抑制大肠杆菌诱导的奶牛子宫内膜上皮细胞炎症反应。Mihai等[27]用乳酸杆菌处理猪肠上皮细胞,最后发现用乳酸杆菌处理的猪肠上皮细胞比未用乳酸杆菌处理的IL-6、IL-8表达量低,而IL-6、IL-8是由TLR4介导经TLR-NF-κB信号通路产生的炎性因子,说明乳酸杆菌可以抑制TLR-NF-κB信号通路的传递。徐敏等[28]通过建立结肠炎小鼠模型,观察小鼠各种免疫指标来研究3株益生菌对溃疡性结肠炎小鼠的影响,试验结果发现人工模型结肠炎小鼠肠组织中的NF-κB p65蛋白表达量相对较高,说明已经引起小鼠结肠炎症状。而通过益生菌治疗以后NF-κB p65蛋白表达量显著降低,IκB表达量显著升高,进一步说明益生菌可以通过抑制TLR-NF-κB信号通路来降低小鼠机体炎症。Zhang等[29]在研究鼠李糖乳杆菌LGG时发现乳酸菌可以通过降低IκB的降解速率来抑制TLR-NF-κB信号通路,使NF-κB进入细胞核减少从而导致IL-8表达水平下降。Lee等[30]用葡萄糖硫酸钠(DSS)来刺激小鼠使小鼠产生炎症反应,经过检测植物乳杆菌HY115和短乳杆菌HY7401可以起到抗炎症的作用。在小鼠体内DSS可以刺激IKK复合物,使IκB降解与NF-κB分开,这时NF-κB迅速进入细胞核调控炎性因子mRNA的表达,使小鼠产生炎症反应。而试验证明植物乳杆菌HY115和短乳杆菌HY7401可以通过抑制IκB的磷酸化来降低NF-κB的活化,进而抑制IL-1β、TNF-α等mRNA的表达,降低炎症反应。然而,并不是所有的益生菌都能够抑制NF-κB活化,Matsuguchi等[31]研究发现存在一些益生菌如乳酸杆菌YIT9029和发酵乳杆菌YIT0159不但不能够抑制NF-κB的活化,反而对NF-κB有刺激作用,进而分泌TNF-α加重炎症反应。
5 小 结
近年来关于TLR、NF-κB以及TLR-NF-κB信号通路的研究已经非常深入,TLR-NF-κB信号通路对动物机体炎症的产生有非常重要的作用,对于TLR-NF-κB信号通路的阻断策略也引起生命科学以及医学界研究人员的高度重视。市面上已经有许多NF-κB的抑制剂,但是一般会伴有不明的副作用,特异性差,无法对疾病进行有效的治疗。益生菌作为饲料添加剂已经有非常多的应用,除了其增加肠道菌群丰度、改善肠道健康和提高免疫力的作用外,有大量研究表明特定的益生菌可以作为TLR-NF-κB信号通路的抑制剂,有效治疗炎症疾病。但是益生菌对TLR-NF-κB信号通路具体的抑制机制还不甚明确,而且益生菌对TLR-NF-κB信号通路抑制存在特异性。在以后的研究工作中,可以着重研究益生菌对TLR-NF-κB信号通路的抑制机理,以及不同益生菌对TLR-NF-κB信号通路抑制效果。
