不同品种葡萄叶片光合特性对干旱胁迫的响应及旱后恢复过程*
2018-11-15朱雨晴杨再强
朱雨晴,杨再强
不同品种葡萄叶片光合特性对干旱胁迫的响应及旱后恢复过程*
朱雨晴,杨再强**
(南京信息工程大学气象灾害预报预警与评估协同创新中心,南京 210044)
以设施葡萄品种“巨峰”和“夏黑”为试材,设置5个不同的干旱胁迫组:T1(干旱胁迫3d),T2(干旱胁迫6d),T3(干旱胁迫9d),T4(干旱胁迫12d)和T5(干旱胁迫15d),以正常水分处理组为CK(土壤相对含水率70%~80%),研究干旱胁迫下葡萄叶片的光合荧光参数变化,以及不同程度干旱胁迫后水分恢复处理下的叶片恢复情况。结果表明:干旱可降低葡萄叶片的光合参数和荧光参数,且巨峰的变化幅度大于夏黑。在15d的干旱胁迫中,巨峰的光合参数下降70%~90%,夏黑下降60%~80%;葡萄叶片的荧光参数中,F0随着干旱胁迫的加剧而显著上升,而qP、Fv/Fm、ETR和ΦPSⅡ则随着干旱胁迫加剧而降低。其中巨峰叶片的ΦPSⅡ、qP和ETR在15d的干旱胁迫中分别下降40.63%、43.24%和57.71%,F0上升48.27%。夏黑叶片的ΦPSⅡ、qP和ETR在15d的干旱胁迫中分别下降26.38%、40.00%和59.69%,F0则上升50.19%。葡萄叶片的旱后恢复过程,在胁迫程度较轻时(T1-T4),夏黑叶片的光合参数恢复能力大于巨峰,胁迫程度较重(T5)时则相反;两个葡萄品种荧光参数的恢复程度差异不显著。
干旱胁迫;净光合速率;气孔导度;蒸腾速率;荧光参数
葡萄是最古老的栽培作物之一,许多国家的经济均依靠葡萄的出口和葡萄酒的酿造。据联合国粮农组织(FAO)统计,2014年全球葡萄总栽培面积为755.4万hm2,产量27520万t,2014年中国葡萄种植面积和产量分别达到76.72万hm2和1254.6万t,分别占世界葡萄栽培总面积和产量的10.6%和4.6%。非生物胁迫是影响作物生长和产量的主要因素,而干旱则是主要的非生物制约因素之一,会对作物的生长和产量产生不利影响[1]。据估计,全球约有30%的地区干旱缺水,因此,干旱已成为限制农业生产的主要问题之一。
国外有学者研究了干旱对植物的影响机理。Parsons等发现耐旱植物可以利用多种机制来适应水分亏缺的环境,这些措施包括增加叶片气孔的抵抗力以减少水分散失,或将根系不断延伸,以提高水分吸收能力[2]。在细胞水平上,植物可以在一定程度上调节渗透压,进而减少渗透势(P)以应对干旱胁迫[3]。许多研究表明,叶片组织的水分亏缺会造成叶片渗透势(P)下降,但各种溶质对渗透调节的作用尚不清楚[4−5]。葡萄作为一种耐旱作物,其抗旱能力可能取决于溶质中促进渗透的有机和无机化合物比例的变化[6−7]。葡萄藤在生长初期对干旱十分敏感,水分的亏缺会造成发育减缓,叶片与根系的生长受到抑制,节间芽数量减少,还会使其藤蔓木质部的平均直径减小[8]。Hardie等发现,干旱胁迫会影响葡萄的生长发育和产量品质,葡萄花芽分化后的前三周出现水分亏缺会影响葡萄的开花坐果,因此,花后干旱对葡萄园损失最大[9],而果期水分亏缺会使葡萄果实低糖、低酸[10]。葡萄植株中的主要化合物水平受植株含水量的影响,其旱后恢复能力在中度胁迫时达到最高,持续的干旱胁迫则会降低葡萄的恢复能力[10]。
目前,关于干旱对作物生理性状以及产量的研究报道较多,但国内外文献对水分胁迫的研究主要集中于大田作物[1−14],且对干旱后作物的恢复过程少有研究报道。因此,本试验采用盆栽种植方式,精确控制土壤含水量,并通过人工控制试验环境,研究不同品种葡萄在干旱胁迫下光合荧光参数的变化以及干旱胁迫后的恢复情况,以期比较葡萄品种间的抗旱性和恢复性,为葡萄种植业的气象灾害防御提供参考。
1 材料与方法
1.1 试验设计
试验于2017年4−6月在南京信息工程大学农业气象试验站的智能温室内进行,温室长30m,宽10m,高5.0m,南北走向。以1a生设施葡萄“巨峰”和“夏黑”植株为试材,采用盆栽方式。盆内口直径25.4cm,高度19.7cm,每盆种一株,土壤为黑壤土。葡萄幼苗于2017年3月2日定植,40d后80%以上的葡萄苗进入伸蔓期。试验于2017年4月20日正式开始,选取生长良好且发育状况相近(15片叶左右)的葡萄植株,每个品种选18盆,利用人工气候箱控制试验环境。人工气候箱内设定昼温25±5℃,夜温18±5℃,空气相对湿度60%±5个百分点。利用HOBO气象站的土壤水分传感器监测土壤水分,两个葡萄品种分别置于2个HOBO气象站内。参考惠竹梅等[15−17]试验方案,将所有葡萄充分灌溉使土壤水分保持一致,利用HOBO土壤水分传感器监测每日土壤含水量变化,待土壤相对含水率降至70%~80%时开始水分胁迫。试验分两组,CK对照组采用称量法补充盆中每日消耗的水分;胁迫组在试验开始后停止灌溉,每隔2d设置一个胁迫梯度,并用600D型便携式植物水势压力室测量叶片水势,一共设置5个梯度。试验从4月25日开始停止供水,第3天土壤相对含水率降至60%~70%,叶片水势达到−0.3~−0.2MPa,植株达到轻微胁迫水平,定义为T1处理;停水6、9、12、15d后,分别达到轻、中、重、极重的干旱胁迫水平,分别用T2、T3、T4、T5表示,试验以土壤水分70%~80%为对照(CK),具体见表1。每个处理设3盆重复,共用1个土壤水分传感器探头,故试验共配备12个探头。
每个胁迫组结束后,于当日10:00−12:00标记叶片,同时观测该处理组和CK的叶片光合荧光参数,观测完成后采用称重法补充水分,使胁迫处理组恢复正常供水,即达到土壤相对含水率70%~80%,并保持该水平15d,作为恢复组。5个胁迫组分别对应5个恢复组,分别用T1H、T2H、T3H、T4H和T5H表示。在恢复期间,每隔2d,即分别在恢复的第3、6、9、12、15天10:00−12:00同时测量该组与CK对照组的叶片光合荧光参数。
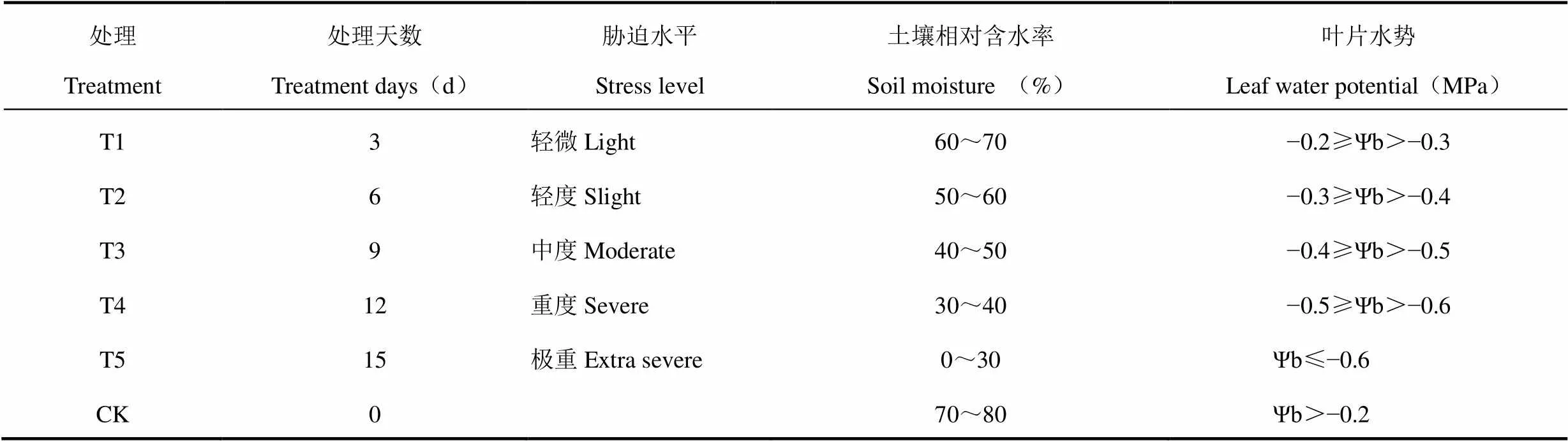
表1 干旱胁迫处理设置
1.2 葡萄叶片光合、荧光参数测定
试验于4月25日开始,对CK对照组、胁迫组及恢复组进行光合荧光参数的测量。在观测日10:00−12:00,选取葡萄植株中部第7−8片健康、成熟的叶片进行标记,用脱脂棉拭去叶片表面的灰尘,利用便携式光合测定系统(LI-6400,LI-COR Biosciences,USA)的LED红蓝光源,设置光量子通量密度由低到高依次为0、200、400、600、800、1000、1200、1300、1500、1800和2000μmol·m−2·s−1的11个点,测量前将叶片在1200μmol·m−2·s−1的光强下光诱导120s,并在测量期间将叶室内空气温度保持在20±3℃,CO2浓度保持在350±10μmol·mol−1范围内。测量叶片在不同光强下的净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr),同一处理取3次重复平均值。
在当日同一时刻,利用FMS-2脉冲调制式荧光测定系统测量叶片的荧光参数,包括初始荧光(F0)、PSⅡ最大量子产量(Fv/Fm)、实际光化学量子产量(ΦPSⅡ)、光化学猝灭(qP)和电子相对传递速率(ETR)。
1.3 数据处理
通过DPS数据处理系统进行统计分析,利用Duncan新复极差法进行方差分析,利用Excel对葡萄叶片的旱后恢复数据进行处理。
2 结果与分析
2.1 干旱胁迫下不同品种叶片光合特性的变化
2.1.1 光合参数
选取光饱和点(当光量子通量密度升到某一数值后,净光合速率不再随之升高时的光量子通量密度值)处的光合参数进行统计。由表2可见,正常供水条件下(CK),两个葡萄品种叶片的净光合速率、气孔导度和蒸腾速率均最大,与其它处理间差异显著;经过不同程度干旱胁迫处理后,两个葡萄品种叶片的净光合速率、气孔导度和蒸腾速率均呈显著下降趋势(P<0.05),且胁迫越重减幅越大,干旱持续时间最长(15d)即T5处理中葡萄叶片的光合参数均最小。
从两个品种的具体数值来看,同样条件下叶片的光合参数间有一定差异。正常供水条件下(CK),夏黑的光合参数大于巨峰。其净光合速率为16.57μmol·m−2·s−1,比巨峰(10.16μmol·m−2·s−1)高63.1%,叶片的气孔导度和蒸腾速率具有同样特点,夏黑分别比巨峰高289.06%和106.94%。干旱胁迫条件下,巨峰和夏黑的叶片光合参数均随着胁迫程度的增加而不断下降,T5(胁迫15d)处理降幅最大。巨峰的净光合速率、气孔导度和蒸腾速率,分别在15d的胁迫中下降了88.3%、70.3%和84.7%。而夏黑品种分别下降65.6%、69.8%和76.8%。可见,叶片光合参数对干旱胁迫的响应,巨峰要明显大于夏黑。
表2 不同程度干旱胁迫结束后两个葡萄品种叶片光合参数的变化
Table 2 The change of photosynthetic parameters of two grape varieties at the end of different drought stresses

注:小写字母表示处理间在0.05水平上的差异显著性,数据为平均值±标准差。下同。
Note:Lowercase indicates the difference significance among treatments at 0.05 level. Data are average±standard deviation. The same as below.
2.1.2 荧光参数
F0为初始荧光,代表叶绿体类囊体膜上的电荷密度,F0增加表示植物叶片类囊体膜的损伤增加。Fv/Fm比值是PSⅡ的最大量子产量,称为原始光能转化效率,表征了植物所具有的潜在最大光合能力(光合效率)。ΦPSⅡ又称Yield或Fv’/Fm’,为实际光化学量子产量,它反映PSⅡ反应中心在部分关闭情况下的实际原初光能捕获效率。qP为叶绿素荧光的光化学猝灭,表征了植物光合作用活性的大小。ETR表示光合电子的相对传递速率,其大小与植物的光合速率有关。
由表3可知,葡萄叶片经过干旱胁迫后,其ΦPSⅡ、qP、ETR出现了显著下降趋势(P<0.05),F0则出现显著上升趋势(P<0.05),随着干旱胁迫程度的增加,PSⅡ、qP、ETR与F0的变化幅度增加,在T5处理中显著性差异达到最大。而Fv/Fm在胁迫过程中则无显著变化(P<0.05)。
表3 不同程度干旱胁迫结束后两个葡萄品种叶片荧光参数的变化
Table 3 The change of fluorescence parameters of two grape varieties at the end of different drought stresses
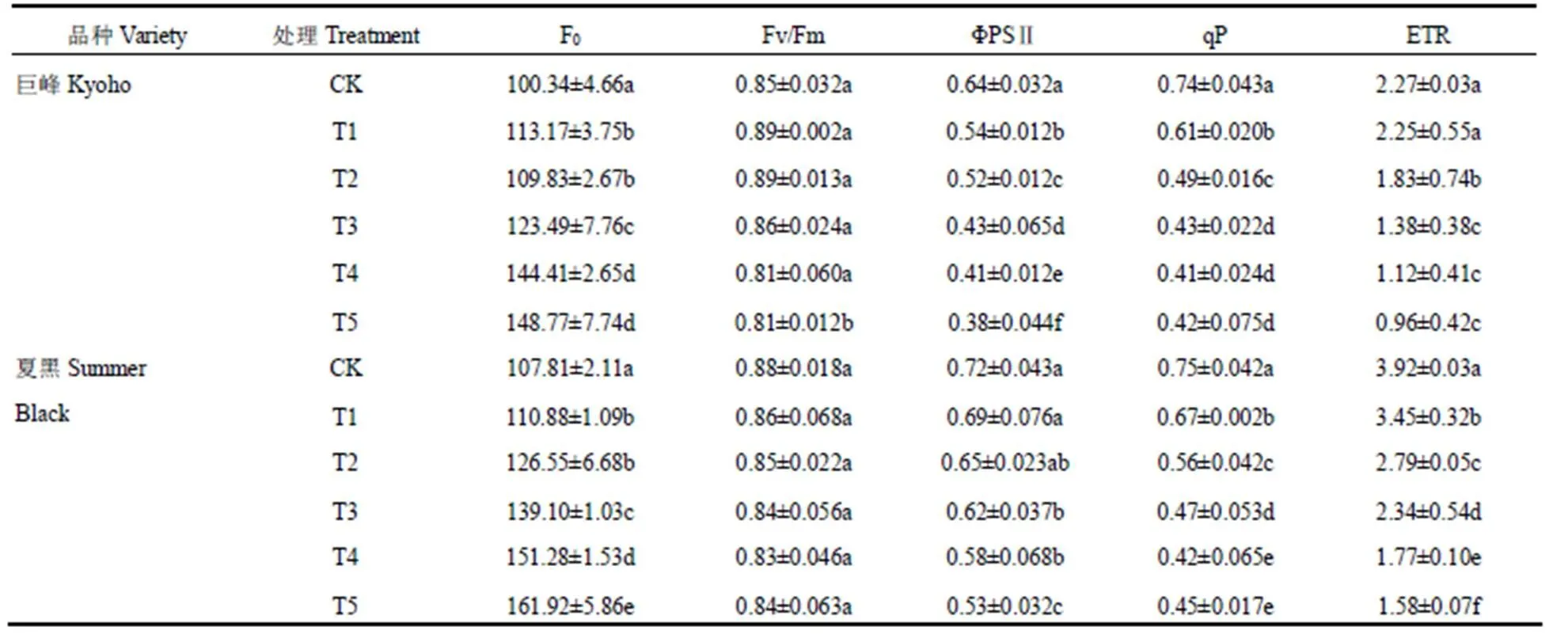
对比两个品种的差异可知,正常供水(CK)条件下,夏黑的荧光参数大于巨峰,其F0、Fv/Fm、ΦPSⅡ、qP和ETR比巨峰分别高出7.44%、3.53%、12.50%、1.35%和72.69%。在干旱胁迫过程中,两个品种的叶片荧光参数均在T5处理即胁迫15d时变化最显著。巨峰的ΦPSⅡ、qP和ETR在15d的干旱胁迫中分别下降40.63%、43.24%和57.71%,F0上升了48.27%。夏黑叶片的ΦPSⅡ、qP和ETR则在15d的干旱胁迫中分别下降26.38%、40.00%和59.69%,F0则上升了50.19%。由此可见,ΦPSⅡ、qP的变化幅度,巨峰大于夏黑,而ETR和F0的变化幅度则表现为夏黑略大于巨峰。
2.2 复水后不同品种叶片光合特性响应曲线的变化
2.2.1 光合速率响应曲线
葡萄叶片净光合速率在干旱胁迫后的恢复过程如图1所示。由图可知,两个葡萄品种,巨峰与夏黑的光饱和点均出现在光量子通量密度为1000μmol·m−2·s−1,此时,葡萄叶片的净光合速率达到最大。在恢复过程中,巨峰与夏黑的叶片净光合速率随恢复时间的增加而上升,其中T1处理的恢复程度最好,T5处理的恢复程度最差。
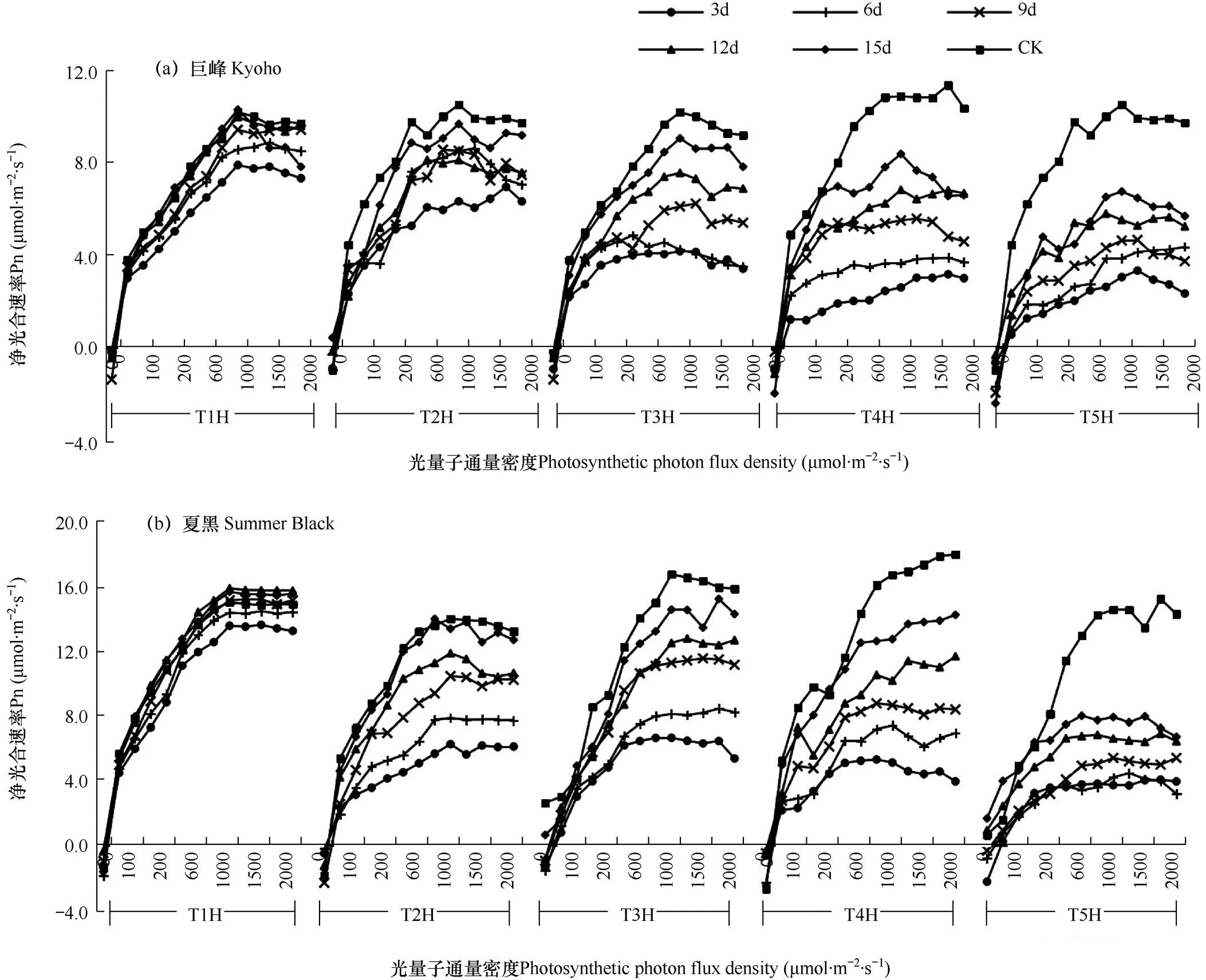
图1 葡萄叶片净光合速率的恢复过程
注:T1H、T2H、T3H、T4H和T5H分别表示5个胁迫处理的恢复组,3d、6d、9d、12d、15d为每个恢复组的恢复过程。下同。
Note: T1H, T2H, T3H, T4H and T5H represent the restoration groups of 5 stress treatments,and 3d, 6d, 9d, 12d, 15d represent the recovery procedure in each treatment. The same as below.
巨峰的恢复过程中,T1在12d内恢复正常水平,T2、T3、T4和T5的叶片净光合速率则分别在15d的恢复期内恢复到正常供水状态下的92.1%、89.1%、77.1%和64.4%。夏黑的恢复过程中,T1和T2的叶片净光合速率分别在9d 和15d时恢复至正常供水时的状态,而T3、T4和T5则在15d的恢复过程中,分别恢复了86.9%、76.1%和54.3%。对比两个品种的具体数值可见,T1−T4恢复组中夏黑叶片净光合速率的恢复能力高于巨峰,T5恢复组则相反。
2.2.2 叶片气孔导度响应曲线
葡萄叶片气孔导度经过干旱胁迫后的恢复过程如图2所示,由图可知,正常环境下的葡萄叶片气孔导度随着光量子通量密度的增加而增加,当光量子通量密度达到光饱和点后基本不再增加。而干旱胁迫后的叶片气孔导度,则在达到光饱和点后随着光量子通量密度的增加而减少。在恢复过程中,两个品种葡萄的叶片气孔导度随着恢复时间的增加而上升,恢复程度随着胁迫程度的增加而降低。
巨峰的恢复过程中,T1的叶片气孔导度在9d时恢复至正常供水的水平,T2、T3、T4和T5在15d的恢复中,叶片气孔导度分别恢复了93.6%、87.4%、78.3%和61.9%。夏黑的恢复过程中,T1和T2的叶片气孔导度,分别在3d和12d时恢复至正常水平,T3、T4和T5的气孔导度则在15d内分别恢复了92.8%、78.0%和58.2%。比较两个葡萄品种气孔导度的恢复过程发现,两个品种气孔导度恢复过程的规律与净光合速率类似,在T1、T2和T3组中,夏黑的恢复能力大于巨峰,T4组中两个品种恢复能力近似,T5恢复组中,巨峰的恢复能力大于夏黑。

图2 葡萄叶片气孔导度的恢复过程
2.2.3 蒸腾速率响应曲线
葡萄叶片蒸腾速率在干旱胁迫后的恢复过程如图3所示,由图可见,在干旱胁迫后的恢复过程中蒸腾速率的变化规律与气孔导度类似,正常环境下的葡萄叶片,其蒸腾速率随着光照强度的增加而增加,达到光饱和点后增加速率减缓;而干旱胁迫后的葡萄叶片,在恢复过程中,其叶片蒸腾速率会在光照强度达到光饱和点后,随着光照强度的增加而减小。
巨峰的恢复过程中,T1的叶片蒸腾速率在12d内恢复至正常水平,T2、T3、T4和T5的叶片蒸腾速率在15d内分别恢复了95.1%、87.7%、76.9%和62.9%。而在夏黑的恢复过程中,T1和T2的叶片气孔导度分别在3d和12d内恢复至初始状态,T3、T4和T5则在15d的恢复过程中分别恢复了91.8%、67.4%和62.3%。比较两个品种叶片蒸腾速率的恢复能力可发现,T1、T2和T3组叶片蒸腾速率的恢复能力,夏黑大于巨峰,而T4和T5则相反。
2.3 复水后不同品种叶片荧光参数的变化
2.3.1 巨峰
巨峰叶片荧光参数的恢复过程如图4所示。由图可见,叶片F0随着恢复时间的增加而减少,ΦPSⅡ、qP和ETR则随着恢复时间的增加而增加,叶片Fv/Fm随着恢复时间的不断增加略有上升,但该变化并不显著。巨峰叶片荧光参数在T1、T2组中能基本恢复至正常水平。而T3、T4和T5组中的叶片,其荧光参数在恢复完成后较难达到正常水平,说明干旱胁迫的加剧可造成巨峰叶片荧光参数降低的同时,也会降低其叶片恢复力。在15d的恢复过程中,T4恢复组巨峰叶片的F0、Fv/Fm、ΦPSⅡ、qP和ETR分别恢复到正常供水状态的89.60%、98.88%、82.09%、74.68%和70.97%;T5分别恢复至83.58%、98.33%、73.13%、68.35%和62.67%。

图3 葡萄叶片蒸腾速率的恢复过程
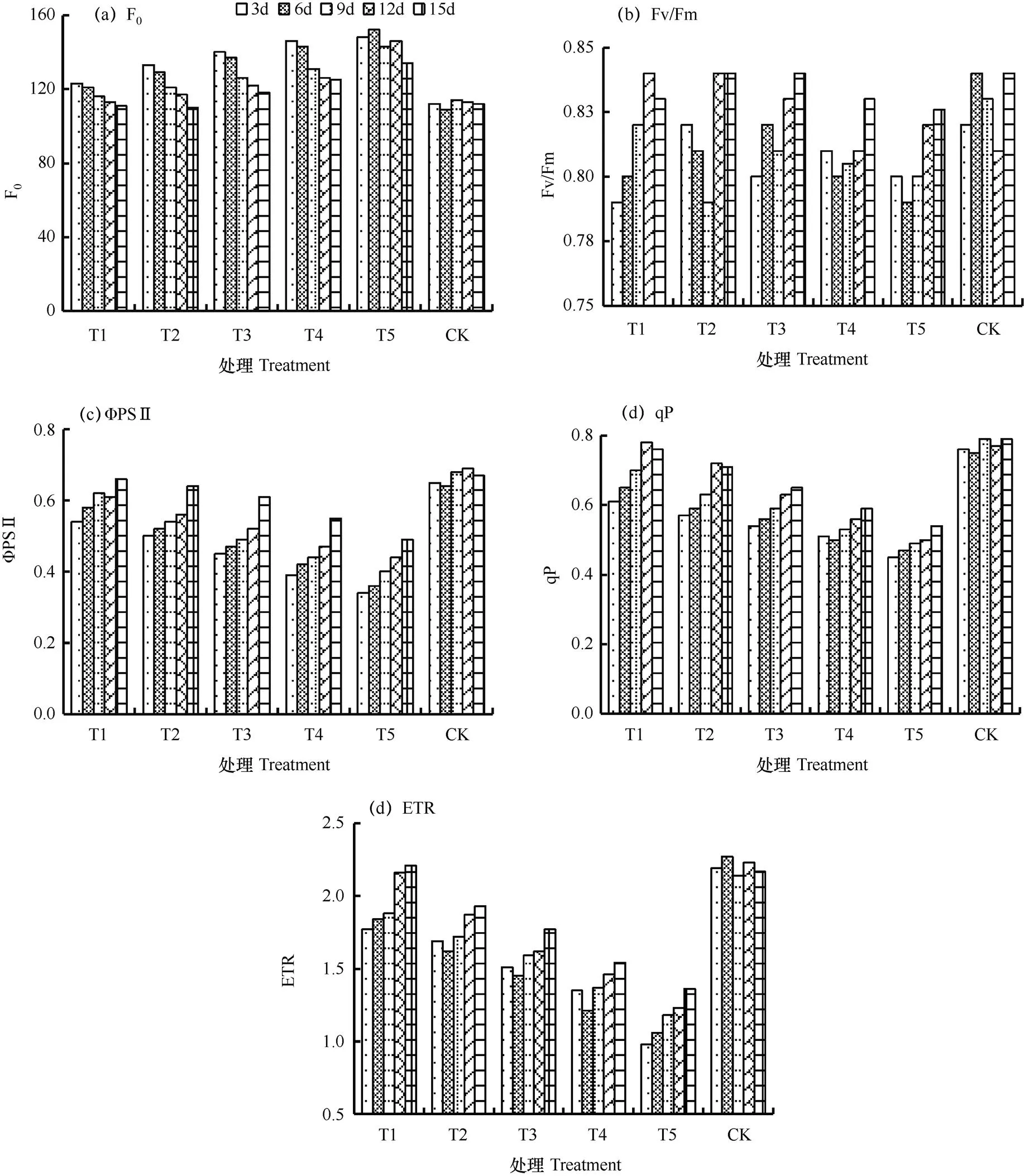
图4 巨峰葡萄叶片荧光参数的恢复过程
2.3.2 夏黑
夏黑叶片荧光参数的恢复过程如图5所示,由图可知,与巨峰的恢复过程类似,夏黑叶片F0随着恢复时间的增加而降低,Fv/Fm、ΦPSⅡ、qP和ETR则随着恢复时间的增加而增加,其中Fv/Fm的增加并不显著。在T1、T2组中,夏黑叶片的荧光参数能基本恢复至正常水平,而T3、T4和T5组中的叶片荧光参数在恢复完成后较难达到正常水平。在15d的恢复过程中,T4恢复组夏黑叶片的F0、Fv/Fm、ΦPSⅡ、qP和ETR分别恢复到正常供水状态的84.67%、98.83%、90.78%、73.42%和78.99%;T5分别恢复至73.42%、96.51%、82.89%、69.62%和70.21%。

图5 夏黑葡萄叶片荧光参数的恢复过程
3 结论与讨论
土壤干旱会影响作物的生长发育及产量品质,作物的生理特征与作物细胞内的渗透调节和水分利用效率有关,在缺水条件下,作物可以通过调节气孔导度、叶片水势、叶片渗透势和相对含水量来抵御干旱胁迫[18]。但是,长期的水分亏缺会使植物叶片受到不可逆转的伤害,甚至萎蔫死亡,这是因为缺水导致植物水分输送系统动力不足,长时间便会损伤木质部中的导管,进而对叶片气孔导度的控制力降低[19]。因此,在本研究的干旱恢复过程中,两个葡萄品种,在胁迫程度较轻时(T1−T3),复水后15d内的光合荧光参数可基本恢复到正常供水状态,而胁迫程度较重(T4、T5)的组,其叶片的恢复能力则开始下降,在复水过程中无法恢复至初始水平,叶片处于持续萎蔫状态,这与韦继光等[20]研究结果基本一致。干旱胁迫也会使叶片细胞内的活性氧升高,但光合能力并没有随之升高,导致其不能被有效耗散掉,因而导致活性氧的代谢失调,光合作用能力受到影响[21]。严重的水分亏缺会破坏植物叶片中的膜系统,损伤细胞原生质,使膜脂过氧化加剧,进而导致叶绿体结构发生变化,PSⅡ反应中心失活[22]。本研究发现,干旱胁迫会降低葡萄叶片的光合荧光参数,并对其蒸腾速率与气孔导度随光照强度的变化规律产生影响[16,23]。与王晶晶等[24]的研究结果类似,葡萄叶片的气孔导度在正常水分环境中,随着光照强度的增加而增加,直至达到光饱和点,达到光饱和点后则不再随之变化;而遭受干旱胁迫后的叶片,气孔导度则会在光照强度达到光饱和点后,随着光照强度的增大而不断减小,甚至使光饱和点减小。前人发现,植物叶片通过控制气孔开闭来控制气孔导度,进而控制蒸腾速率[25],葡萄叶片的气孔导度与蒸腾速率呈正相关关系[26],本研究发现葡萄叶片的蒸腾速率也呈现与气孔导度相似的变化规律,这与肯吉古丽等[27]的研究结果类似。
在干旱胁迫下,植物的生理性状变化反应了植物的抗旱能力,抗旱性强的品种,其生理变化速率比抗旱性弱的品种缓慢,以维持植物的正常生长发育[28−31]。本研究发现,“巨峰”和“夏黑”两个葡萄品种,在干旱胁迫中,巨峰叶片的光合荧光参数降幅大于夏黑;而在旱后恢复过程中,胁迫程度较轻时(T1−T4),夏黑叶片的光合参数恢复能力大于巨峰,胁迫程度较重(T5)时则相反;两个葡萄品种荧光参数的恢复程度差异不显著。综合两个葡萄品种的光合荧光参数分析,夏黑品种的抗旱性要大于巨峰。
[1] Blum A.Plant breeding for water-limited environments[J].农业科学与技术(Agricultural Science & Technology),2011,3(12):44-50.
[2] Parsons L R,Howe T K.Effects of water stress on the water relations of Phaseolus vulgaris,and the drought resistant Phaseolus acutifolius[J].Physiologia Plantarum,1984,60(2):197-202.
[3] Bartels D,Nelson D.Approaches to improve stress tolerance using molecular genetics[J].Plant Cell & Environment,1994,17(5):659-667.
[4] Ebtedaie M,Shekafandeh A.Antioxidant and carbohydrate changes of two pomegranate cultivars under deficit irrigation stress[J].Spanish Journal of Agricultural Research,2016,14(4):e0809.
[5] During H.Evidence for osmotic adjustment to drought in grapevines (L.)[J].Vitis,2016,23(1):1-10.
[6] Rodrigues M L,Chaves M M,Wendler R,et al.Osmotic adjustment in water stressed grapevine leaves in relation to carbon assimilation[J].Functional Plant Biology,1993,20(3):309-321.
[7] Patakas A,Nikolaou N,Zioziou E,et al.The role of organic solute and ion accumulation in osmotic adjustment in drought-stressed grapevines[J].Plant Science,2002,163(2):361-367.
[8] Sara T,Cornelis van L.Impact of soil texture and water availability on the hydraulic control of plant and grape-berry development[J].Plant and Soil,2013,(1-2):215-230.
[9] Hardie W J,Considine J A.Response of grapes to water-deficit stress in particular stages of development[J].American Journal of Enology & Viticulture,1976,27(2):55-61.
[10] Gachons C P D,Leeuwen C V,Tominaga T,et al.Influence of water and nitrogen deficit on fruit ripening and aroma potential ofL cvin field conditions[J].Journal of the Science of Food & Agriculture,2005,85(1):73-85.
[11] Maatallah S,Nasri N,Hajlaoui H,et al.Evaluation changing of essential oil of laurel (L.) under water deficit stress conditions[J].Industrial Crops & Products,2016,91:170-178.
[12] Patakas A,Nortsakis B.Mechanisms involved in diurnal changes of osmotic potential in grapevines under drought conditions[J].Journal of Plant Physiology,1999,154(5-6):767-774.
[13] Delphine L,Julie P,Jan T.Source-sink relations in fruits:effect of nitrogen on fruit growth and composition in sour cherry[J].European Cytokine Network,2006,17(3):211-9.
[14] Gachons C P D,Leeuwen C V,Tominaga T,et al.Influence of water and nitrogen deficit on fruit ripening and aroma potential ofL cvin field conditions[J].Journal of the Science of Food & Agriculture,2005,85(1):73-85.
[15] 惠竹梅,房玉林,郭玉枝,等.水分胁迫对葡萄幼苗4种主要生理指标的影响[J].干旱地区农业研究,2007,25(3):146-149. Hui Z M,Fang Y L,Guo Y Z,et al.The effect of water stress on main physiological indexes of wine grape leaf[J].Agricultural Research in the Arid Areas,2007,25(3):146-149.(in Chinese)
[16] 张曼义,杨再强,侯梦媛.水分胁迫下黄瓜叶片光响应过程的模拟[J].中国农业气象,2017,38(10):644-654.Zhang M Y,Yang Z Q,Hou M Y.Simulation of light response of photosynthesis ofL. leaves under water stress[J].Chinese Journal of Agrometeorology,2017,38(10):644-654.(in Chinese)
[17] 张曼义,杨再强,侯梦媛.土壤水分胁迫对设施黄瓜叶片光合及抗氧化酶系统的影响[J].中国农业气象,2017,38(1):21-30.Zhang M Y,Yang Z Q,Hou M Y.Effects of soil water stress on photosynthetic characteristics and antioxidant enzyme system of cucumber leaves in greenhouse[J].Chinese Journal of Agrometeorology,2017,38(1):21-30. (in Chinese)
[18] Franco J A,Martínezsánchez J J,Fernández J A,et al.Select- ion and nursery production of ornamental plants for lands- caping and xerogardening in semi-arid environments[J].Journal of Horticultural Science & Biotechnology,2006,81(1):3-17.
[19] Zhang J,Jia W,Yang J,et al.Role of ABA in integrating plant responses to drought and salt stresses[J].Field Crops Research,2006,97(1):111-119.
[20] 韦继光,曾其龙,姜燕琴,等.水分胁迫及恢复正常水分供应后兔眼蓝浆果生长及光合特性的变化[J].植物资源与环境学报,2015,24(3):77-84.Wei J G,Zeng Q L, Jiang Y Q,et al.Changes in growth and photosynthetic characteristics of rabbiteye blueberry(-Reade) during water stress and recovering normal water supplying[J].Journal of Plant Resources & Environment,2015,24(3):77-84.(in Chinese)
[21] Valladares F,Pearcy R W.Drought can be more critical in the shade than in the sun:a field study of carbon gain and photo-inhibition in a Californian shrub during a dry El Niño year[J].Plant Cell & Environment,2002, 25(6):749-759.
[22] Ann G D F,Sharkey T D.Stomatal conductance and photos- ynthesis[J].Annual Reviews of Plant Physiology,2003,33(33):317-345.
[23] 田琳,谢晓金,包云轩,等.不同生育期水分胁迫对夏玉米叶片光合生理特性的影响[J].中国农业气象,2013,34(6):655-660.Tian L,Xie X J,Bao Y X,et al.Effects of moisture stress on photosynthetic characteristics of summer maize leaf during growth stages[J].Chinese Journal of Agrometeorology,2013,34(6):655-660.(in Chinese)
[24] 王晶晶,莫伟平,贾文锁,等.干旱条件下葡萄叶片气孔导度和水势与节位变化的关系[J].中国农业科学,2013,46(10):2151-2158.Wang J J,Mo W P,Jia W S,et al.The relationship of grape leaf stomatal conductance and water potential with leaf position under drought conditions[J].Scientia Agricultura Sinica,2013,46(10):2151-2158.(in Chinese)
[25] 王玉国,荆家海,王韶唐.水分胁迫条件下高粱叶片的渗透调节及其对气孔导度和蒸腾速率的影响[J].华北农学报,1991,6(1):68-73.Wang Y G,Jing J H,Wang S T.The effect of osmotic adjustment in sorghum leaves on stomatal conductance and transpiration rate under water stress[J].Acta Agriculturae Boreali-Sinica(Acta Agric Boreali Sin).,1991, 6(1):68-73.(in Chinese)
[26] 朱雨晴,杨再强.高温高湿对设施葡萄叶片气孔和光合特性的影响[J].北方园艺,2017,(23):94-101.Zhu Y Q,Yang Z Q.Effects of high temperature and high humidity on stomatal and photosynthesis characteristics of grape lea- ves in greenhouse[J].Northern Horticulture,2017,(23):94-101.(in Chinese)
[27] 肯吉古丽·苏力旦,齐曼·尤努斯,马娟,等.干旱胁迫条件下两个葡萄品种光合荧光特性的研究[J].新疆农业大学学报,2014,(3):191-196.Kengjiguli S,Yunus Q,Ma J,et al.Photosynthetic fluores- cence characteristic parameters of two grape cultivars under different drought stress[J].Journal of Xinjiang Agricultural University,2014,(3):191-196.(in Chinese)
[28] Marshall J G,Rutledge R G,Blumwald E,et al.Reduction in turgid water volume in jack pine,white spruce and black spruce in response to drought and paclobutrazol[J].Tree Physiology,2000,20(10):701-707.
[29] Álvarez S,Navarro A,Nicolás E,et al.Transpiration,photos- ynthetic responses,tissue water relations and dry mass partitioning in Callistemon,plants during drought conditions[J].Scientia Horticulturae,2011,129(2):306-312.
[30] Dorji K,Behboudian M H,Zegbe-Domínguez J A.Water relations,growth,yield,and fruit quality of hot pepper under deficit irrigation and partial rootzone drying[J].Scientia Hor- ticulturae,2005,104(2):137-149.
[31] Ebtedaie M,Shekafandeh A.Antioxidant and carbohydrate changes of two pomegranate cultivars under deficit irriga- tion stress[J].Spanish Journal of Agricultural Research,2016,14(4):e0809.
Photosynthetic Responses of Different Grape Cultivars to Drought Stress and Their Recovery after Drought
ZHU Yu-qing, YANG Zai-qiang
(Collaborative Innovation Center on Forecast and Evaluation of Meteorological Disasters, Nanjing University of Information Science & Technology, Nanjing 210044, China)
In order to clarify the change of photosynthesis fluorescent parameters of grape leaves under drought stress, and their recovery under water treatment processing after different degree of drought stresses, taking the facility grape varieties “Kyoho” and “Summer Black” as test materials, authors conducted 5 different drought stress groups: T1 (drought stress 3d), T2 (drought stress 6d), T3 (drought stress 9d), T4 (drought stress 12d) and T5 (drought stress 15d), and taking the normal water treatment group as CK (relative moisture content of soil 70%− 80%). The results showed that the drought stress reduced photosynthetic parameters and fluorescence of grape leaf blades, and the amplitude of variation of Kyoho was larger than that of Summer Black. With 15d drought stress, photosynthetic parameter of Kyoho declined by 70%−90%, and Summer Black declined by 60%−80%. As for the fluorescence parameters in grape leaf blades, F0increased significantly as the aggravation of drought stress, while qP, Fv/Fm, ETR, ΦPSⅡ decreased. Wherein, the ΦPSⅡ, qP, and ETR of Kyoho declined by 40.63%, 43.24%, and 57.71% respectively, while F0increased by 48.27% under 15d drought stress. The ΦPSⅡ, qP and ETR of Summer Black declined by 26.38%, 40.00% and 59.69% respectively, while F0increased by 50.19% under 15d drought stress. In terms of the recovery procedure after drought stress, the photosynthetic parameter recovery capability of Summer Black was greater than that of Kyoho under the comparatively low degree of stress (T1-T4), and the situation was opposite when the stress degree was high (T5). The difference of recovery level of fluorescence parameter in the two varieties was not significant.
Drought stress; Net photosynthetic rate; Stomatal conductance; Transpiration rate; Fluorescence parameters
2018−04−08
。E-mail:yzq@nuist.edu.cn
江苏省科技支撑计划(BE2015693)
朱雨晴(1993−)女,硕士生,研究方向为设施农业气象。E-mail:2806217750@qq.com
10.3969/j.issn.1000-6362.2018.11.005
朱雨晴,杨再强.不同品种葡萄叶片光合特性对干旱胁迫的响应及旱后恢复过程[J].中国农业气象,2018,39(11):739-750
