酵母静息细胞耦合原位分离技术连续转化2-苯乙醇
2018-11-14黄筱萍刘兰熊大维金丹凤黄国昌顾斌涛李鹏
黄筱萍, 刘兰,熊大维,金丹凤,黄国昌,顾斌涛,李鹏
(江西省科学院 微生物研究所,江西 南昌,330029)
2-苯乙醇(2-phenylethanol,简称2-PE)是一种具有玫瑰气味的芳香醇,广泛应用于日化、食品和医药领域中。2-PE和乙醇对酵母的毒性是生物转化法生产2-PE中产物浓度不高的主要原因[1-4]。通过原位产物分离(in situ product removal, ISPR)技术从发酵液中萃取和吸附产物2-PE,维持产物浓度在较低水平,避免产物抑制,是提高2-PE产量的一种主要方法[5-6]。采用有机溶剂两相萃取技术原位转移2-PE可一定程度解决产物抑制效应, 有机溶剂黏度大,产品分离复杂,在实际生产应用中必然会增加发酵工艺的复杂性和成本[7-8]。ESCHMANN等在酵母细胞培养过程中用聚丙二醇1200作为萃取剂,有机相和水相中的2-PE产量分别达到26.5 g/L和0.3 g/L[9]。在发酵培养基中添加大孔树脂进行产物吸附可有效提高2-PE的产量[10]。关昂等采用大孔树脂FD0816为吸附介质,2-PE终浓度达到12.8 g/L[11],WANG等以FD0816树脂作为萃取剂对S.cerevisiaeGivR-UV3进行半连续培养,通过控制葡萄糖流量和更换发酵液中的树脂,2-PE总产量达32.5 g/L[12],在发酵液中加入树脂进行ISPR生物转化,虽然取得了较高的产量,但树脂需要灭菌和经常更换,菌体与树脂难分离,且发酵液易污染杂菌,难以实现真正的连续转化培养。本研究采用酵母静息细胞作为酶的载体,进行静息细胞生物转化-微滤膜分离菌体-大孔吸附树脂吸附产物的ISPR技术合成转化2-PE,可有效解决生长细胞转化液组分复杂副产物多、易污染、树脂难分离、操作复杂、以及有机废水排放量大等问题,大幅提高2-PE的产量[13]。产物吸附在树脂柱中,树脂无需分离和灭菌,ISPR运行不需要在无菌条件下进行,细胞可多批次重复使用,可进行连续转化合成2-PE,具有潜在的应用价值。
1 材料与方法
1.1 试验材料与设备
菌种SaccharomycescerevisiaeH003由本实验室筛选获得,现保存于江西省科学院微生物研究所。
1.1.1 主要试剂
L-苯丙氨酸购自河北冀海生物科技有限公司,纯度99.5%;2-PE标准品(Sigma公司);甲醇为色谱纯,其他试剂均为国产分析纯,HZ-816大孔树脂(上海华震科技有限公司)。
1.1.2 主要设备
2695高效液相色谱仪,美国Waters公司;HC-C18反相色谱柱(250 mm×4.6 mm,5 μm),美国Agilent公司;7890B气相色谱仪(FID检测器),美国Agilent公司,DB-WAX毛细管柱(30 m×0.53 mm×1.0 μm),美国Agilent公司; H2500R-2高速冷冻离心机,湖南湘仪;5 L发酵罐,上海保兴生物技术公司;平板式微滤装置,Pellicon2 Mini Cassette微滤膜(孔径0.45 μm),美国KOCH公司。
1.2 实验方法
1.2.1 培养基和细胞培养
斜面培养基(麦芽汁琼脂培养基值g/L):葡萄糖 30,蛋白胨 5,酵母粉 3,麦芽汁 3,pH自然;
细胞增殖培养基(g/L):葡萄糖 30,蛋白胨 5,酵母粉 3,麦芽汁 3,pH值为5.8~6.2;
从斜面挑取1~2环菌苔至30 mL种子液中,于28 ℃、180 r/min摇瓶培养24 h,接种至150 mL种子液中于相同条件进行扩大培养20 h后,接入装有3 L种子液的发酵罐中进行增殖培养20 h,培养条件28 ℃、转速300 r/min、通气量0.25 vvm。
1.2.2 静息细胞制备
细胞培养液于8 000 r/min离心5 min,收集细胞,用0.1 mol/L(pH 5.1)的K3PO4缓冲液洗涤细胞2次,将菌体重悬于缓冲液中,4 ℃冰箱保存备用。
1.2.3 5 L罐静息细胞转化条件
用0.1 mol/L(pH 5.1)的K3PO4缓冲液配制不同浓度的静息细胞液,加入底物L-苯丙氨酸(L-Phe)和辅助底物乙醇,于28 ℃、200~400 r/min、通气量0.2~0.5 vvm进行转化24 h。
1.2.4 5 L生物反应器-微滤膜系统-树脂柱产物吸附串联ISPR连续转化试验
取一定量的树脂预处理后用 0.1 mol/L(pH 5.1)的K3PO4缓冲液分装两根树脂柱,连接5 L生物反应器-超滤膜系统-树脂柱吸附装置。将2.5~3.0 L 0.8 g/L静息细胞液置于5 L生物反应器中,加入L-Phe10 g/L和乙醇16 g/L,于优化的条件下进行转化。当转化液中产物浓度高于2.8 g/L时,启动超滤膜系统和树脂柱装置进行产物原位分离,超滤膜浓液返回反应器中,清液进入树脂柱进行产物吸附,通过树脂柱的清液再经在线过滤器后泵回反应器中,当反应器中转化液的2-PE浓度低于0.5 g/L结束料液循环。当转化液中产物浓度再次高于2.8 g/L时,再进行新的循环吸附。如此连续转化至转化速率低于0.15 g/(L·h)时,终止转化。细胞离心分离或微滤膜分离后悬浮于缓冲液中,用于下一批次的转化。由于静息细胞在转化过程中仍有少量的出芽生殖,需对细胞浓度进行监控,当细胞浓度高于1.1 g/L时,适量分流一部分细胞至罐外或移至另一反应器中,同时补入适量的缓冲液和底物进行转化,如此2个反应罐切换操作,实现连续转化吸附的生产过程。
1.2.5 静息细胞重复利用活性比较
每次转化结束后,将静息细胞离心或用微滤膜过滤收集菌体细胞,重新悬浮于缓冲液中,置4 ℃冰箱保存。待下一批次转化时使用。采用多次使用的细胞与新制备的细胞在相同转化条件下进行ISPR的试验,测定转化速率的变化和催化稳定性。
1.2.6 产物的洗脱和收集
吸附在树脂柱中的2-PE用1.5~2.5倍树脂柱体积的乙醇洗脱,洗脱流速为3.0~4.5 m3/[m3(柱容)·h],得至约2.0倍树脂体积的2-PE粗品。
1.2.7 反相高效液相色谱法测定L-PHE含量
样品经10 000 r/min离心5 min,取上清液,稀释,于HPLC分析。流动相为V(甲醇)∶V(水)=50%∶50%,流速为1.0 mL/min,检测波长260 nm,柱温30 ℃,进样量10 μL。
1.2.8 气相色谱法测定2-PE和乙醇含量条件[14]
样品经10 000 r/min离心5 min,取上清液,稀释,用0.22 μm聚醚有机滤膜过滤。分析条件:载气(N2)、氢气、空气流速分别为5、30、300 mL/min;进样器和检测器温度均为250 ℃,升温程序:80 ℃(2 min) →升温速率(20 ℃/min)→220 ℃(3 min);进样方式:分流进样,分流比:10∶1;检测器:FID;进样量:1 μL。
2 结果和分析
2.1 细胞浓度对转化合成2-PE的影响
利用酵母细胞静息细胞转化合成2-PE,细胞作为艾氏途径催化反应酶的载体,细胞浓度直接影响参与反应的酶量,进而影响其催化转化的反应速率和转化率。用0.1 mol/L(pH 5.1)的K3PO4缓冲液配制不同的细胞浓度,加入L-Phe 8 g/L、乙醇16 g/L,于28 ℃、200 r/min,0.3 vvm条件下转化24 h,结果见图1。
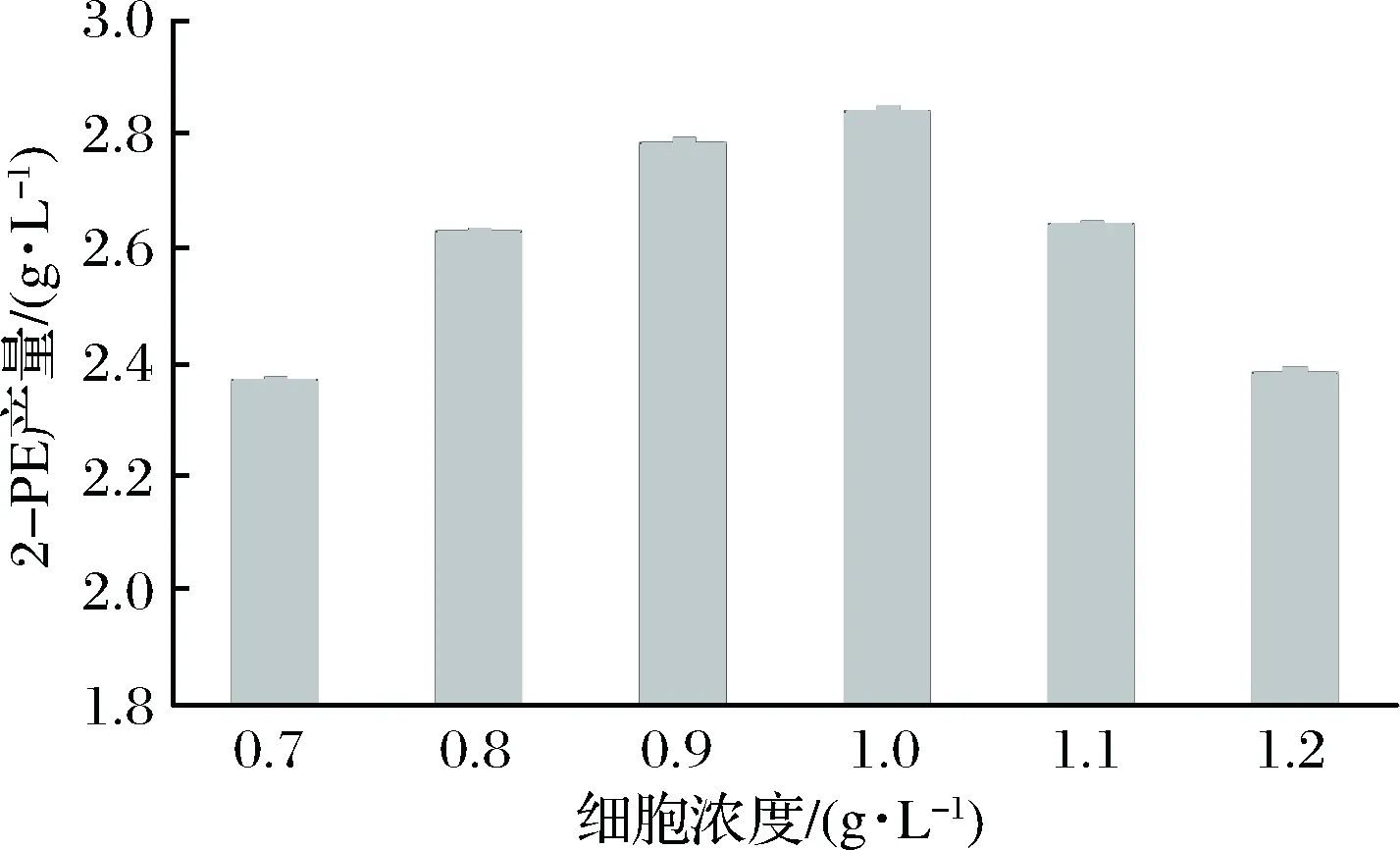
图1 细胞浓度对转化合成2-PE合成的影响Fig.1 Effect of cell concentration on 2-PE production bybioconversion
结果表明,细胞浓度低于0.8 g/L时,2-PE产量较低,当初始细胞浓度为1.0 g/L时,2-PE产量达到最高,继续提高细胞浓度不能增加2-PE的产量,这可能是由于过多的菌体导致溶氧供应不足,同时影响溶液的传质效率,不利于转化进行,因此细胞量控制在0.8~1.1 g/L比较合适。
2.2 搅拌速率和通气量对转化合成2-PE的影响
在静息细胞的转化过程中需要一定的氧的参与,搅拌速率对底物与产物的传质有一定的影响,分别考察了在不同的通气量和搅拌速率下对产物生成的影响。图2为静息细胞浓度为1.0 g/L,L-Phe8 g/L,乙醇16.5 g/L,于28℃、300 r/min、不同通气量条件下转化24 h的2-PE产量。图3为在相同条件下,静通气量为0.3 vvm,不同搅拌速率转化合成2-PE产量。

图2 通气量对2-PE产量的影响Fig.2 The effect of ventilate volume on 2-PE bioconversion
当通气量达0.2 vvm,2-PE产量明显提高,通气量达到0.3 vvm时,2-PE产量达到最高,继续提高通气量,产量没有提高。当搅拌速率为300 r/min时产量明显增加,继续增加搅拌速率,产量变化不大,优化的通气量和搅拌速率为0.3 vvm和300 r/min。

图3 搅拌速率对2-PE产量的影响Fig.3 The effect of stir speed on 2-PE bioconversion
2.3 单罐产物原位转移转化试验
在5 L反应罐中加入0.8 g/L静息细胞悬浮液3.0 L,加入底物和辅助底物,在优化的转化条件下进行转化反应。用缓冲液装填2支树脂柱,每柱装有大孔树脂550 g,柱体积为744.5 mL。每20~24 h开启ISPR装置进行原位产物分离,定时取样测定底物、辅助底物及产物浓度,根据浓度的变化适当补加底物和辅助底物,使底物和辅助底物浓度分别控制在3~10 g/L和5~16 g/L之间,同时监控细胞浓度,当罐内细胞浓度高于 11 g/L时,将适当的细胞移出罐外,同时补入适当的缓冲液以控制细胞浓度在7~11 g/L之间。转化结束后离心收集细胞,置4 ℃冰箱保存。用约1.5倍树脂柱体积的纯水置换树脂柱中的转化液,再用约1.5~2.0倍树脂柱体积的乙醇洗脱产物。表1为分别连续运行不同时间的底物添加量、产量、摩尔转化率和平均转化速率。

表1 静息细胞单罐运行ISPR转化合成2-PE试验结果Table 1 The result of ISPR continuous bioconversion of 2-PE by resting cell in single bioreactor
随着转化时间的延长,2-PE产量亦显著增加,连续运行145 h后,2-PE总产量达72.18 g,折算产量达24.06 g/L,摩尔转化率为79.34%。平均转化速率随着转化时间的延长略有下降,这可能是因为随着转化时间的延长,罐内细胞浓度增加,在66 h后细胞浓度可达到11 g/L以上,在ISPR运行过程中,需将细胞浓液分流一部分体积的细胞至罐外,再另补加相同体积的缓冲液以维持罐内较适的细胞浓度,转化时间越长, 移出罐外的细胞越多,而移出罐外的细胞液中含有较高浓度的L-Phe,这对摩尔转化率和平均转化速率会有一定的影响,为提高ISPR的运行稳定性和细胞的利用率,可以采用双罐同时运行的方式进行连续ISPR运行。
2.4 双罐产物原位转移转化试验
在单罐运行ISPR装置中增加1个转化罐, ISPR运行68 h将约1 L左右静息细胞浓液转移至第2罐中,在2个罐中分别补入适量的缓冲液和底物等在相同的条件下进行转化反应用,之后每20~24 h转入少量的细胞至第2罐中,至体积达到3 L左右结束转化,结果见表2。
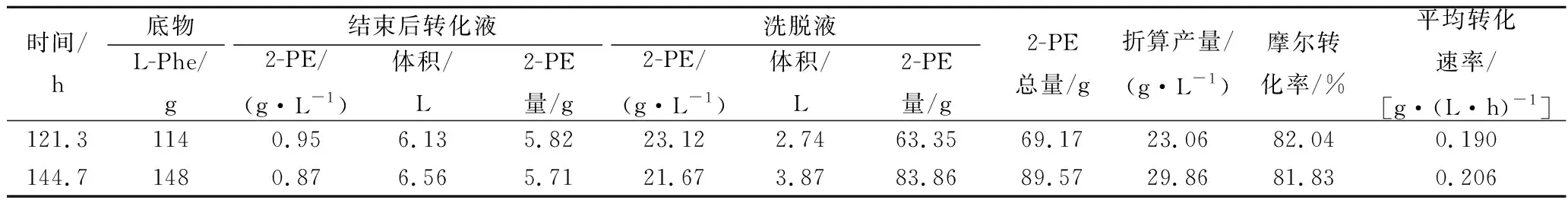
表2 静息细胞双罐运行ISPR转化合成2-PE试验结果Table 2 The result of ISPR continus bioconversion of 2-PE by resting cell in double bioreactors
双罐ISPR分别运行了121.3 h和144.7 h,在相同时间内产量比单罐有显著提高,产量分别增加12.75%和24.10%,随着转化时间增加,产量有可能得到更大幅度的提高。摩尔转化率和平均转化速率也明显提高,摩尔转化率均达80%以上,平均转化速率达0.2 g/(L·h)。
2.5 静息细胞重复利用活性比较
取上述试验置冰箱保存的重复使用10批次的静息细胞液(浓度8 g/L)2.5 L,新制备静息细胞液(浓度8 g/L)2.5 L分别加入5 L罐中进行ISPR转化试验,在相同的条件下进行单罐转化96 h,运行期间细胞未移出罐外,运行52 h和80 h后,在2罐中分别加入缓冲液约400 mL和300 mL,表3为2罐的细胞转化合成2-PE的产量和转化速率。

表3 不同使用批次的静息细胞连续转化2-PE结果Table 3 The result of ISPR bioconversion of 2-PE by different batch resting cell
注:*试验罐1为新制静息细胞液,试验罐2为重复使用10批次的静息细胞液。
重复利用10次的静息细胞液与新制备的静息细胞液在单罐中连续运行96 h,最终2-PE产量分别达16.67 g/L和16.53 g/g,平均转化速率亦未明显下降,这表明静息细胞在进行重复利用,生物活性没有明显下降,在实际生产中可大大降低细胞培养和静息细胞制备的次数。
3 小结
通过在5 L发酵罐中转化条件的优化,确定了酵母静息细胞优化的转化条件为:细胞浓度8~11 g/L,通气量0.3 vvm,搅拌速率300 r/min 。在优化的条件下进行ISPR连续生物转化2-PE,单罐分别连续运行72、96、120、145 h,随着转化时间的增加,2-PE产量逐渐增加,最高罐产量达24 g/L,摩尔转化率均在80%左右,平均转化速率在0.165~0.18 g/(L·h)之间。双罐运行144 h,2-PE在产量达29.86 g/L,摩尔转化率和平均转化速率上比单罐运行均有所提高,静息细胞重复使用10批次,产量和平均转化速率没有明显下降。
由于静息细胞生物转化的优势,目前在天然化合物的生物合成、药物前体化合物转化等领域已展开了静息细胞生物转化合成的研究[15-16],而生物转化合成2-PE还主要集中在采用生长细胞培养转化[10-12]。生长细胞在发酵液中加入树脂进行ISPR生物转化合成2-PE,虽然可获得较高的产量,但树脂需要灭菌,反复的高温灭菌会影响树脂的吸附效率,树脂难以回收;且培养液中含大量糖、酵母粉等有机物,易污染杂菌,有机废水排放量大,导致生长细胞在实际生产过程中进行ISPR技术难以实现。采用酵母静息细胞转化合成2-PE的优势在于转化液组分非常简单(只含底物、乙醇和少量无机盐)、副产物少、产品易于分离纯化;细胞可以重复利用,不用频繁培养和制备细胞,大大减少了发酵有机废水排放,是一种清洁的生产工艺。尤其是静息细胞可长时间保持生物活性,无需在无菌条件下运行,操作简单,这是实现ISPR连续运行的关键,在未来工业上的应用具有明显的优势。
