模拟表位型EB病毒感染诊断抗原的制备
2018-11-14苏秋东郭敏卓邱丰贾志远范雪亭孟庆玲田瑞光毕胜利伊瑶杨俊梅
苏秋东 郭敏卓 邱丰 贾志远 范雪亭 孟庆玲 田瑞光 毕胜利 伊瑶 杨俊梅
102206北京,中国疾病预防控制中心病毒病预防控制所(苏秋东、邱丰、贾志远、范雪亭、孟庆玲、田瑞光、毕胜利、伊瑶);100026北京出入境检验检疫局技术中心(郭敏卓);450053,郑州大学附属儿童医院(杨俊梅)
EB病毒(epstein-Barr virus,EBV)广泛存在于自然界,是一种世界性感染病原体,影响超过90%人群,可引起传染性单核细胞增多症、淋巴瘤、鼻咽癌以及移植后淋巴增生性疾病[1]。EBV又称人类疱疹病毒4型,为双链DNA病毒,分为A、B两型,亚洲主要以A型为主。EBV感染急性期血清学诊断主要通过检测针对病毒衣壳抗原(VCA)的IgM抗体来确定[2]。ELISA是诊断EBV感染最灵敏的方法,目前应用最为广泛的是利用EBV培养液获取的天然抗原来捕获患者血清中的IgM或IgG[3]。有些ELISA方法利用了重组EBV核蛋白及重组早期蛋白D抗原[4]。然而EBV很多重要抗原都是由两个到六个蛋白组成的复杂蛋白,常高度糖基化,这些严重阻碍了重组抗原在商业诊断试剂中的应用。用一个代表抗体结合位点的多肽来替代整个蛋白,将是EBV诊断抗原研发的一个新方向。
多肽表位在诊断抗原上的应用允许表位的筛选可以只关心与目标抗体结合位点有关的表位,尽量避免与诊断无关表位的掺入。多肽,不像重组抗原那么复杂,同样可以模拟碳水化合物表位[5]。很多研究曾筛选出很多病原体的多肽表位,但主要是连续性表位或者是线性抗体结合位点。因为大多数功能性血清抗体都只能与构象型或非连续表位反应,因此这种多肽的筛选通过简单的重叠多肽表位筛选法很难获取。Casey等[2]利用噬菌体表面展示技术筛选出了与EBV免疫显性抗原表位关联的多肽,并通过实验证实了这些多肽在诊断上完全可以替代复杂蛋白质抗原的想法。并将此多肽命名为模拟表位(mimotopes),意指可以模拟表位的必要特征(主要是与相应抗体结合的特征)而不必要与真实表位序列相同。
本研究基于模拟表位的发现,将四个模拟表位串联起来,利用原核表达系统和层析纯化技术获得EBV感染的诊断抗原,并以此建立EBV-IgM抗体捕获法ELISA,来鉴定EBV的急性感染。
1 材料与方法
1.1 主要材料与试剂 E.coli BL21(DE3)感受态细胞为本科室现存和Trx融合表达载体M48为本科室构建(图1)。限制酶Nco I和Xho I以及T4 DNA连接酶购自美国NEB公司,STREAMLINE Chelating亲和层析介质及DEAE Sepharose Fast Flow购自美国GE公司,鼠抗Trx单克隆抗体、羊抗鼠IgG-HRP和羊抗人IgM-HRP均购自美国Merck Millipore公司。EBV急性期血清50份,阴性血清50份来源于临床和实验室确诊人群。
1.2 表达质粒的构建 将EBV模拟表位GP125、F1、A2及 A3C2多肽序列(表1)用短肽连接臂(SAPGTPSR)进行串联,优化密码子后全基因合成。用限制酶Nco I和Xho I处理携带目的片段的pMD-19T,切胶回收并定量目的片段。将其连接到相同酶切处理的M48载体上,转化E.coli DH5α感受态细胞,进行蓝白斑筛选。次日挑取白色单菌落培养后提取质粒,送公司测序并同时进行双酶切鉴定。测序和双酶切鉴定正确的质粒命名为H58质粒。
1.3 目的蛋白的表达和纯化 将H58质粒转化E.coli BL21(DE3),构建表达工程菌。挑取单菌落接种于含氨苄霉素(50μg/ml)的LB培养基(10 g/L蛋白胨,5 g/L酵母提取液,10 g/L NaCl)中,37℃振荡培养4 h后加入终浓度1 mmol/L的IPTG诱导2 h,离心(6 000×g,5 min,4℃)收集菌体沉淀。用超纯水重悬后加入等倍体积2×loading buffer后SDS-PAGE即为目的蛋白的小量表达[6]。将表达工程菌1∶1000接种,37℃培养10 h后,加入终浓度1 mmol/L的IPTG诱导5 h后离心收菌(3 000×g,10 min,4℃)即为目的蛋白的大量表达。用溶液I(10 mmol/L Tris-HCl, 0.5%Triton X-100, pH 8.0)重悬菌体沉淀后超声破碎(300~20 s~20 s~30次),离心(174 000×g,10 min,4℃)收集包涵体沉淀。包涵体沉淀用溶液Ⅰ洗2次后,用5 ml超纯水进行重悬。将重悬液加入到45 ml溶液Ⅱ(10 mmol/L Tris-HCl,7 M盐酸胍,pH 8.0)中混匀并室温静止10 min。离心(174 000×g,10 min,4℃)收集上清。将其上样于溶液Ⅱ平衡的亲和层析介质中。并分别用0 mmol/L,30 mmol/L,60 mmol/L 咪唑(溶于溶液Ⅱ中)进行梯度洗脱。其后用溶液Ⅲ(10 mmol/L Tris-HCl,8 mol/L尿素,pH 8.0)再次平衡层析体系。待平衡后,用60 mmol/L,300 mmol/L咪唑(溶于溶液Ⅲ中)进行梯度洗脱。分别取样进行SDS-PAGE电泳,观察目的蛋白的含量以及分布情况。将目的蛋白含量(浓度)最高,目的蛋白百分占比(纯度)最高的洗脱液于于0% ~100% 溶液IV(10 mmol/L Tris-HCl,pH 8.0)中彻底透析。
DEAE阴离子交换介质用基液IV平衡后将透析液上样,分别用 0 mmol/L,100 mmol/L,200 mmol/L,400 mmol/L NaCl(溶于基液IV中)进行梯度洗脱并收集相应洗脱液。取样进行SDS-PAGE电泳,观察目的蛋白的含量以及分布情况。
1.4 目的蛋白的鉴定 利用基于非变性PAGE的Western blot技术对H58蛋白抗原性进行鉴定[6]。简言之,10μl H58蛋白进行13.5% 非变性PAGE电泳(恒流45 mA,45 min),而后转膜至硝酸纤维素膜(NC)(恒压15 V,30 min)上。其后NC膜用封闭液(含5%脱脂奶粉的PBST)封闭过夜。次日分别加入鼠抗 Trx 单克隆抗体(1∶5000;Merck Millipore)、EBVIgM 阳性血清(1∶10)、EBV-IgM 阴性血清(1∶10)。检测抗体对应为羊抗鼠IgG-HRP(1∶4 000;Merck Millipore)和羊抗人 IgM-HRP(1∶4 000;Merck Millipore)。最后DAB显色,清水终止显色。
1.5 H58-HRP偶联反应 为了检测血清中的IgM抗体,我们建立了捕获法ELISA。检测抗原需要偶联HRP,便于显色。H58-HRP偶联反应按照说明书操作(KPL,MD,USA)[6]。简言之,透析处理H58,而后调整蛋白浓度为2.0 mg/ml。然后逐滴加入预活化的HRP(HRP:H58≈3∶1)。4℃孵育过夜后加入10μl Reducing Agent(NaCNBH3),室温孵育15 min终止反应。最终加入等体积2×HRP Storage Buffer,室温孵育15 min后,4℃保存备用。利用直接法ELISA滴定鼠抗Trx单克隆抗体和H58-HRP来评价偶联反应效率[6]。简言之,用碳酸盐包被缓冲液(CB)二倍系列稀释鼠抗Trx单克隆抗体(1∶250~1∶16000)后包被微孔,封闭处理后待用。加入用PBS二倍系列稀释的H58-HRP(1∶250~1∶16000)孵育。 洗涤后加入50μl TMB(MP,CA,USA)孵育 10 min。 加入 50μl H2SO4(1 mol/L)终止反应。参考基线波长为620 nm,监测波长为450 nm用酶标仪测定每个孔的吸收度值(OD值)。
1.6 目的蛋白诊断效能的评价 利用H58-HRP建立血清EBV-IgM抗体捕获法ELISA试剂盒,并对临床和实验室确诊的血清样本进行检测,以此评价试剂盒对阴阳性血清标本的鉴别能力[6]。简言之,用抗μ-二抗(1∶500于CB中)包被微孔,封闭后待用;分别加入待测血清后37℃孵育40 min(1:20稀释,每个样本设置两个复孔);洗涤后加入H58-HRP偶联物(1∶2000稀释),置37℃孵育30 min;洗涤后加入 TMB显色,用酶标仪测定 OD值。临界值(cutoff值)定义为阴性样本OD值平均数的2.1倍。
2 结果
2.1 目的蛋白的构建与表达纯化 H58在M48载体多克隆位点上的结构如图1,H58蛋白自氨基端到羧基端顺序为:Trx前导肽,GP125、F1、A2及A3C2模拟表位(表1),及HisTag,各个结构域之间添加了短肽连接臂(SAPGTPSR)以及特点酶切位点(图1)。
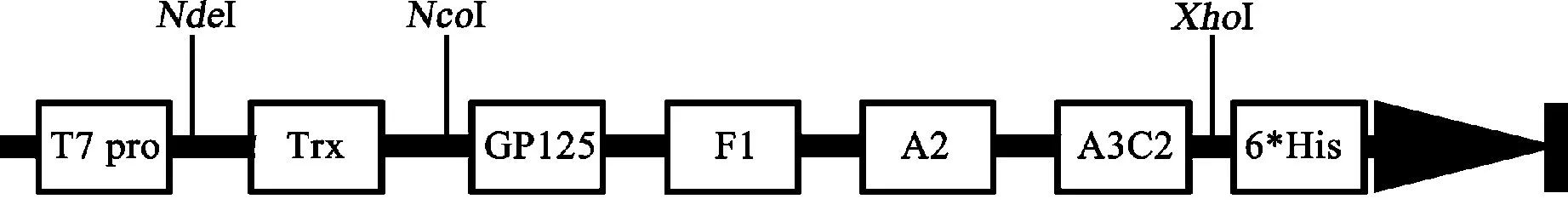
图1 H58表达质粒示意图Fig.1 Schematic diagram of H58 expression plasmids
Trx表达载体经双酶切处理(Nco I和Xho I)后获得一条长5 849 bp的线性化载体。H58F-pMD-19T经双酶切处理(Nco I和Xho I)后获得一条长350 bp的线性化片段。载体和片段用连接酶进行连接,之后转化E.coli DH5α感受态细胞后进行培养,提取质粒测序并进行双酶切鉴定。测序及双酶切鉴定结果证实成功插入的质粒,命名为H58质粒。
H58蛋白小量表达SDS-PAGE电泳结果发现,,在约26×103处有明显条带(图2.A),与预测蛋白大小(26.3×103)一致。H58蛋白大量表达后,目的蛋白主要以包涵体形式存在于菌体超声液的沉淀中(图2.B),且目的蛋白占菌体总蛋白的含量达到36.01%。第一步亲和层析结果发现,H58蛋白在300 mmol/L咪唑洗脱液中的浓度和纯度最好(图2.B),其中浓度为3.6 mg/ml,纯度为98.33%。将此洗脱液经过完全透析复性。第二步阴离子交换层析结果发现H58蛋白在200 mmol/L NaCl洗脱液中浓度和纯化最好,分别为浓度 2.8 mg/ml,纯度99.01%(图2.B)。
2.2 目的蛋白的鉴定 为了评价H58蛋白的完整性及抗原性,我们用抗Trx单克隆抗体以及EBV感染阳性血清作为捕获抗体。Western blot结果发现,捕获抗体为鼠抗Trx标签抗体(图3.A)以及EBVIgM阳性血清(图3.B),在NC膜上约26×103处(与预测大小一致)都出现了条带;而捕获抗体为EBV-IgM阴性血清,在NC膜上无任何条带。证明了H58蛋白的完整性以及抗原性。
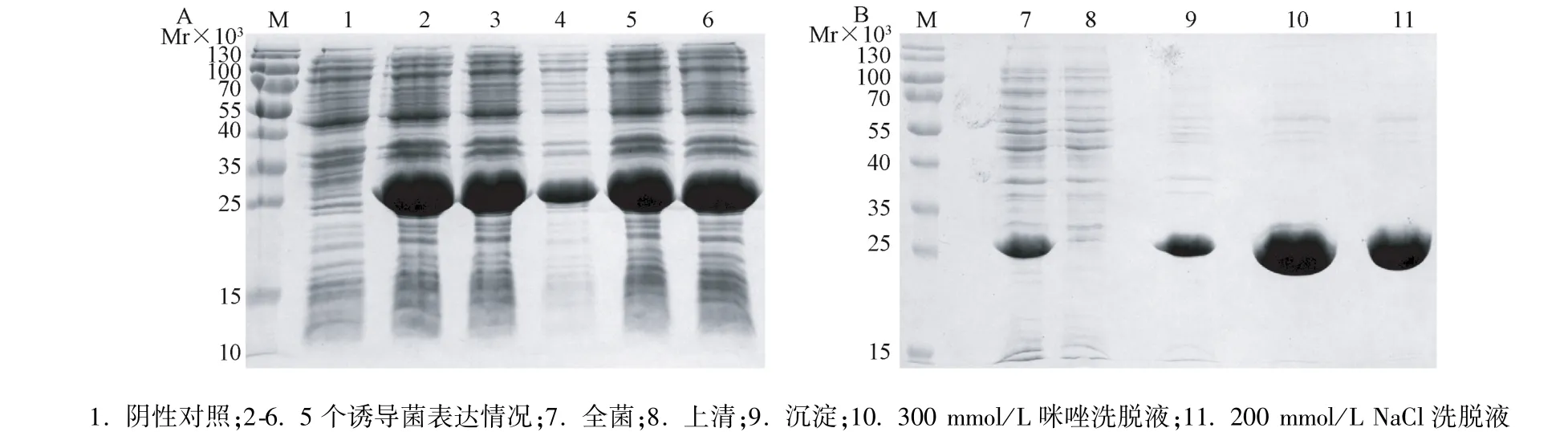
图2 H58蛋白小量表达(A),亲和层析及阴离子交换层析纯化结果(B)Lane 1, negative control; lane2-6, expression of 6 single-colonies; lane 7, total bacterial proteins after sonication; lane 8, soluble fraction of the homogenate; lane9, insoluble fraction of the homogenate; lane10, elute washed with 300 mmol/Limidazole; lane11, elutes washed with 200 mmol/L NaClFig.2 The small-scale prokaryotic expression(A)and purification of H58 protein by affinity and DEAE chromatography(B)
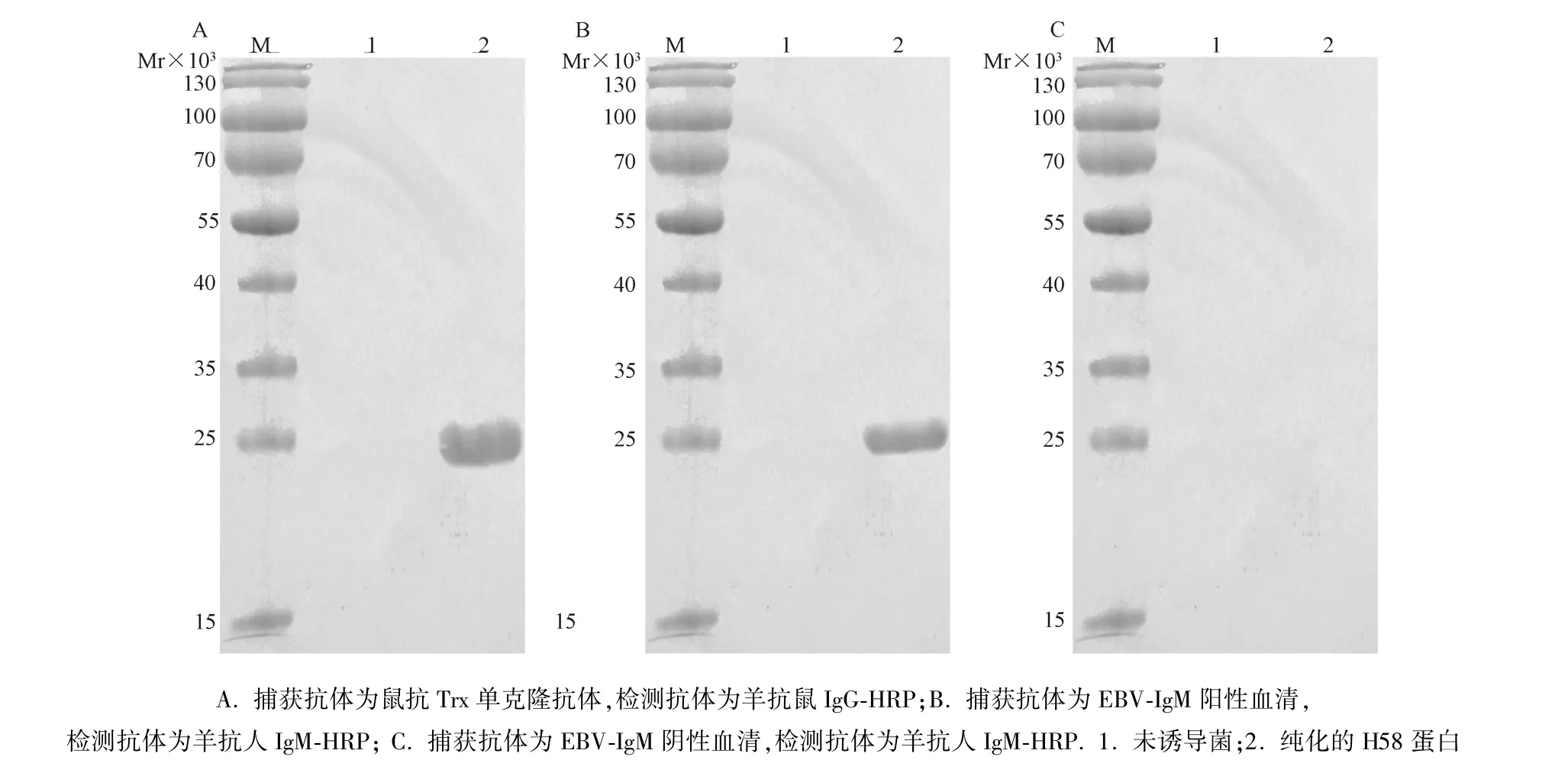
图3 H58的Western blot分析A.Mouse anti-Trx monoclonal antibody as capture antibody, Goat anti-Mouse IgG-HRP conjugate as detection antibody; B.EBV-IgM positive serum as capture antibody, Goat anti-human IgM-HRPconjugate as detection antibody; C.EBV-IgM negative serum as capture antibody, Goat anti-human IgM-HRP conjugate as detection antibody.1.Non-induced bacteria;2.Purified H58 proteinFig.3 Western blot analysis of H58 protein
2.3 目的蛋白诊断效能的评价 基于H58-HRP偶联蛋白我们建立了EBV-IgM抗体检测ELISA试剂盒,对50份EBV-IgM阳性血清和50份EBV-IgM阴性血清样本进行检测。结果发现,阳性血清样本与阴性血清样本OD值分布分别为1.352(95%CI:1.233~1.489)和0.135(95%CI:0.113~0.159),统计分析发现两者之间差异具有统计学意义(P<0.05)。近而粗略估计试剂盒的临界值为0.284。按照此临界值确定阴阳性结果,得出表2结果,以此数据得出灵敏度为98.0%,特异性为96.0%。统计分析发现χ2=0.00,P>0.05,尚不能说明两种诊断方法差异具有统计学意义。ROC分析曲线下面积为0.991(95%CI:0.981~1.022),一致性检验kappa值为0.940,表明两种检测方法一致性优异。由此得出,基于H58抗原的EBV-IgM抗体诊断捕获法ELISA试剂盒可以很好地鉴别EBV感染阴阳性血清样本。
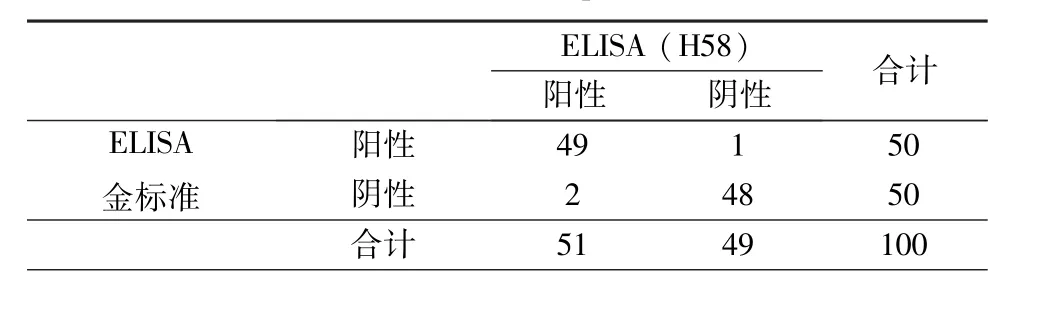
表2 捕获法ELISA检测结果Tab.2 The results of capture ELISA kit
3 讨论
模拟表位打破了传统表位的概念,并不局限于目标抗体结合蛋白的氨基酸序列,仅仅要求其可以与目标抗体反应即可。利用模拟表位作为诊断试剂的概念基于抗体靶向一个病原体许多免疫显性表位的可能性[2]。事实上,早就有在原因目标抗原未知的情况下利用噬菌体表面展示技术来鉴定多肽的报道[6]。而且利用噬菌体表面展示技术鉴定的多肽已经被作为抗原探针,成功应用于乙型肝炎病毒和丙型肝炎病毒的免疫学诊断中[8-9]。这种方法的成功依赖于多肽可以模拟天然抗原免疫显性表位的能力。在Casey的研究中已经证实,本研究所选用的这四个模拟表位(GP125、F1、A2及A3C2)独自存在时的诊断价值。本研究旨在希望通过串联表达四个模拟表位来提高诊断试剂的灵敏度和特异性,以及降低诊断抗原制备的时间和成本。
考虑到四个模拟表位短小,构建时将其融合了Trx标签。实验证实了目的蛋白可以很好地在大肠杆菌中进行表达,而且通过亲和层析、逐级复性以及离子交换层析可以获取水溶性良好的目的蛋白。基于非变性PAGE的Western blot实验证实了H58蛋白可以与EBV-IgM阳性血清中的相应抗体发生反应,有力支持了H58蛋白作为诊断抗原的潜能。H58与HRP的偶联,Trx前导肽还有吸引HRP偶联位点的担当,有效避免了HRP偶联带来的抗原效价降低或失活,为成品试剂盒的研发鉴定了基础。
总之,我们将EBV四个模拟表位进行串联表达,利用亲和层析和离子交换层析成功获取了带有Trx前导肽和His后缀标签的诊断抗原,并将其成功应用于EB病毒新近感染和急性感染的诊断,为成品试剂盒的研发奠定了基础。
利益冲突 无
