四嗪二甲酰胺抑制胰腺癌细胞AsPC-1增殖及其机制研究
2018-11-12陈素峰吕亚萍周永列
陈素峰,吕亚萍,夏 骏,徐 柯,周永列
(1. 浙江省人民医院检验中心,浙江 杭州 310014;2. 杭州医学院附属人民医院检验中心,浙江 杭州 310053;3. 浙江工业大学药学院,浙江 杭州 310014)
胰腺癌是恶性程度极高的消化道恶性肿瘤,在美国占癌症死亡的第4位,其年发病率约为1/10 000[1],在中国,2015年胰腺癌的发病率上升至第6位,死亡率上升至第9位。胰腺癌具有诊断较晚、局部侵袭力高、早期广泛转移、病死率极高、预后极差、长期生存率极低等特点,5年生存率<5%,有“癌中之王”之称[2]。
四嗪是一类四氮杂苯化合物,具有良好的生物活性,目前作为药品上市的替莫唑胺(temozolomide)就是一种咪唑四嗪类口服抗肿瘤药物,对白血病、淋巴瘤及实体肿瘤都有较好的疗效。本研究使用的四嗪二甲酰胺(ZGDHu-1)是根据药物构效学设计并合成的一种具有原创性和自主知识产权的,并经体外抗肿瘤活性筛选的新四嗪类化合物[3-4]。目前尚未有研究表明ZGDHu-1在胰腺癌AsPC-1细胞中的抗肿瘤效应。为此,本文观察了ZGDHu-1对胰腺癌细胞AsPC-1的增殖抑制、诱导凋亡及细胞周期阻滞的作用,并探讨其主要作用机制。
1 材料与方法
1.1材料
1.1.1 细胞株 人胰腺癌细胞株AsPC-1购自中科院上海生命科学研究院细胞资源中心。
1.1.2 试剂 ZGDHu-1由浙江工业大学药学院制药工程研究所提供,以乙醛、乙醇和水合肼为原料,合成中间体3,6-二甲基-1,6二氢-1,2,4,5-四嗪,并以此为先导化合物,经药物分子设计,合成一类全新结构的S-四嗪类化合物:3,6-二取代基-1,4二氢-1,2,4,5-四嗪二甲酰胺,其相对分子质量为398,结构式见Fig 1。ZGDHu-1储存液(10 g·L-1)用二甲基亚砜(DMSO)溶解,应用液用含10%胎牛血清的DMEM配制。DMSO、MTT、Hoechst 33258试剂,均购自美国Sigma公司;瑞氏染液购自珠海贝索公司;Annexin V/PI试剂盒购自美国Invitrogen公司;DNA分析试剂盒(DNA Prep Kit)购自美国Beckman Coulter公司;蛋白提取试剂盒、BCA法蛋白定量试剂盒购自北京鼎国生物有限公司;一抗caspase-3(8G10) 、Bax、β-actin,购自美国Cell Signaling公司。
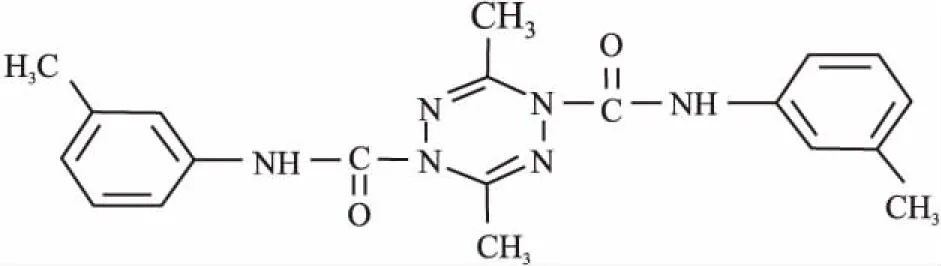
Fig 1 Chemical structure of ZGDHu-1
1.1.3 仪器 细胞培养箱(Heal Force公司);荧光显微镜(尼康公司);酶标仪(Bio-Rad公司);流式细胞仪(Beckman Coulter公司)。
1.2方法
1.2.1 细胞培养 细胞株培养于含10%胎牛血清的DMEM高糖培养基中,含100 kU·L-1青霉素、100 mg·L-1链霉素,置37 ℃、5% CO2饱和湿度的培养箱中培养。每2~3 d以1 ∶3~1 ∶5传代。
1.2.2 胰腺癌细胞的生长抑制实验 采用MTT法检测胰腺癌细胞的增殖情况。取对数生长期的AsPC-1细胞,调整细胞密度至4×107·L-1,接种于96孔板中,每孔200 μL,置37 ℃培养16~24 h(过夜)。加入ZGDHu-1(0、0.025、0.125、0.25、0.5、1.25、2.5、12.5 μmol·L-1),每个浓度设6个复孔,同时设空白对照和阴性对照,置37 ℃、5% CO2培养箱中分别培养24、48、72 h后,吸弃孔内培养上清液,每孔分别加入浓度为5 g·L-1的MTT 20 μL和新鲜DMEM高糖培养基200 μL,继续培养4 h,吸弃上清液,向每孔中加入150 μL DMSO,震荡10 min至结晶全部溶解,酶标仪490 nm波长处读取各孔的光吸收值(OD值)。按如下公式计算ZGDHu-1对细胞增殖的影响:细胞增殖率=[(OD实验-OD空白)/(OD对照-OD空白)]×100%。
1.2.3 细胞形态观察 采用瑞氏染色和Hoechst 33258荧光染色观察细胞形态变化。预先在6孔板中加入无菌盖玻片,以每孔5×105个细胞接种于6孔板中,37 ℃培养过夜。按浓度梯度加入ZGDHu-1培养24、48 h。用于Hoechst 33258观察的细胞用固定液(甲醇 ∶冰醋酸=3 ∶1)4 ℃固定5 min,PBS冲洗后,用Hoechst 33258(5 mg·L-1)染色15 min,在荧光显微镜下观察细胞形态及凋亡小体。用于瑞氏染色观察的细胞,加瑞氏染液A液和B液,混匀后染色10 min,在普通光学显微镜下观察细胞形态。
1.2.4 Annexin V/PI检测细胞早期凋亡情况 取对数生长期的细胞,以每孔5×105个细胞接种于6孔板中,37 ℃培养过夜。按梯度浓度加入ZGDHu-1培养24、48 h后,收集孔内培养上清液中和0.25%胰酶消化的单层细胞,用预冷的PBS溶液洗涤1遍。向洗涤好的细胞中加入100 μL 1×结合缓冲液,重悬成单个细胞后,加入5 μL的Annexin V试剂和1 μL的PI工作试剂(100 mg·L-1),室温避光孵育15 min,加入400 μL 1×的结合缓冲液轻轻混匀,使用流式细胞仪分析。以Annexin V的荧光强度为横坐标,以PI荧光强度为纵坐标,绘制散点图,记录Annexin V单阳性区的细胞占所有分析细胞的百分比。
1.2.5 流式细胞术分析AsPC-1细胞周期 收集处理后的AsPC-1细胞,加入DNA-Prepkit透膜液(内含Triton和RNase)50 μL,放置1 min,加PI染液250 μL,作用5 min,流式细胞仪检测分析:以PI荧光强度为横坐标,以细胞数量为纵坐标,绘制曲线图,调整G0/1期、S期和G2/M期细胞位置,排除黏连细胞后,计数至少10 000个细胞,分析细胞周期及DNA表达情况。使用Wincycle32-Shortcut软件分析,并计算胰腺癌细胞亚二倍体峰、G0/1期、S期和G2/M期的百分率。
1.2.6 Western blot法分析细胞相关蛋白表达变化 取对数生长期的细胞,以2.5×106个/皿的密度接种于75 cm2平皿中,37 ℃培养过夜后,以梯度浓度的ZGDHu-1作用24、48 h,采用 Western blot 检测相关蛋白表达水平,β-actin为内参蛋白,步骤如下:收集处理后的细胞,PBS洗1遍,加入RIPA裂解液冰上裂解30 min,4 ℃、14 000 r·min-1离心15 min后,取上清,用12%的聚丙烯酰胺凝胶电泳分离蛋白,上样蛋白总量为每孔50 μg,电泳结束后,将蛋白从聚丙烯酰胺凝胶转移到PVDF膜上,10%脱脂奶粉中封闭2 h,一抗Bax、caspase-3或β-actin(1 ∶1 000)4 ℃孵育过夜,TBST洗涤3次,加二抗(1 ∶10 000)室温孵育1 h,然后用ECL发光,X线胶片曝光成像,ImageJ软件进行图像分析。
2 结果
2.1ZGDHu-1抑制胰腺癌细胞的增殖Fig 2的MTT结果显示,胰腺癌细胞株AsPC-1经梯度浓度ZGDHu-1分别孵育24、48、72 h后,ZGDHu-1能明显抑制AsPC-1细胞的增殖,且呈浓度-时间依赖效应。
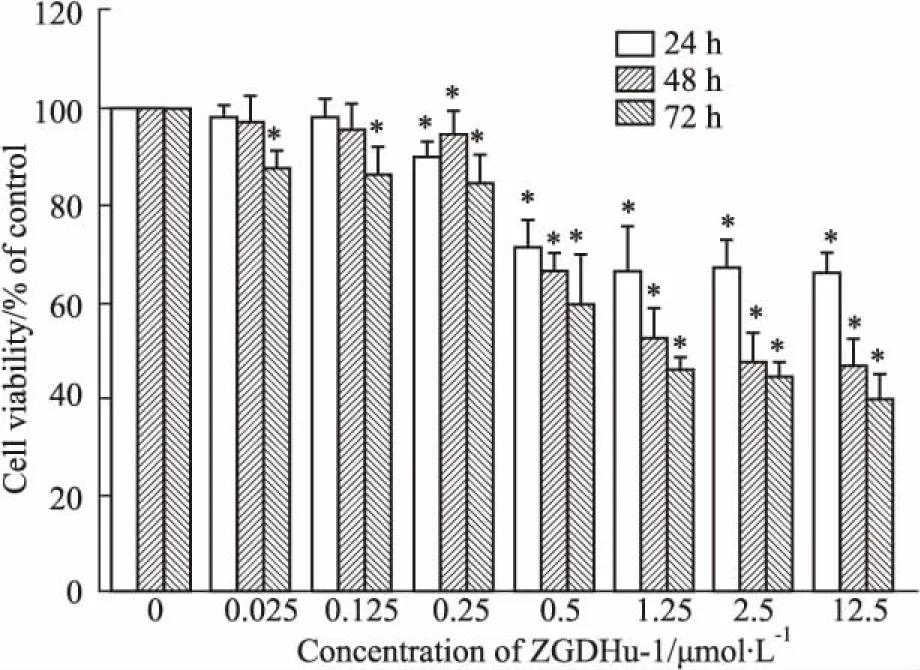
Fig 2 Viability rate of AsPC-1 cells after treatment with different concentrations of ZGDHu-1 determined by n=3)
*P<0.05vscontrol
通过浓度效应曲线计算后显示,ZGDHu-1作用AsPC-1细胞48 h的IC50为3 μmol·L-1,而由于AsPC-1细胞对高于1.25 μmol·L-1的ZGDHu-1几乎进入平台期,下列实验设置的ZGDHu-1浓度为0、0.25、0.5、1.25 μmol·L-1。
2.2ZGDHu-1诱导胰腺癌细胞凋亡
2.2.1 ZGDHu-1作用胰腺癌细胞后的形态学变化 Fig 3瑞氏染色结果显示,与对照组相比,实验组的胰腺癌细胞间连接消失,核质深染,细胞体积缩小,细胞核固缩、碎裂;细胞膜皱缩内陷,细胞内形成数个大小不等的凋亡小体。且随着ZGDHu-1浓度的增加,凋亡细胞和凋亡小体比例明显增多。
Fig 4的Hoechst 33258荧光染色的结果显示,对照组的胰腺癌细胞大小一致,细胞核呈弥散均匀的蓝色荧光;ZGDHu-1作用后的胰腺癌细胞大小不一,细胞核或细胞质内可见浓染致密的颗粒块状荧光,在细胞内能明显观察到高蓝色荧光强度的凋亡小体。
2.2.2 ZGDHu-1诱导胰腺癌细胞的早期凋亡 Fig 5的Annexin V/PI染色结果显示,AsPC-1细胞与不同浓度的ZGDHu-1(0、0.25、0.5、1.25 μmol·L-1)作用48 h后,早期凋亡的AsPC-1细胞比率(Annexin V+/PI-)分别为(0.4±0.3)%、(1.6±0.2)%、(12.0±2.3)%、(20.6±3.6)%。研究结果表明,随着ZGDHu-1浓度增高,细胞早期凋亡比例逐渐增高(P<0.05),提示ZGDHu-1能诱导胰腺癌细胞凋亡,且呈浓度依赖效应。

Fig 3 AsPC-1 cells dyed with Wright’s staining and observed under a light microscope after cultured with various concentrations of ZGDHu-1 (×1 000)
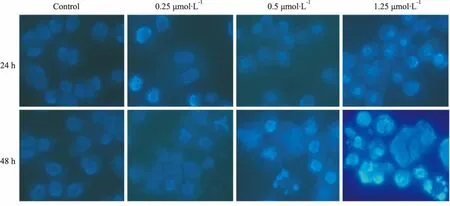
Fig 4 AsPC-1 cells dyed with Hoechst 33258 staining and observed under a fluorescence microscope after cultured with various concentrations of ZGDHu-1 (×400)
2.3ZGDHu-1阻滞胰腺癌细胞AsPC-1于G2/M期为了检测细胞周期改变是否参与ZGDHu-1诱导细胞凋亡的过程,采用流式细胞术分析胰腺癌细胞周期分布变化。Fig 6和Tab 1结果表明,AsPC-1细胞与不同浓度的ZGDHu-1共同培养24、48 h后,胰腺癌细胞被明显阻滞于G2/M期,且随着ZGDHu-1浓度的增高,阻滞于G2/M期的胰腺癌细胞比例也逐渐增加,当ZGDHu-1浓度达到1.25 μmol·L-1时,处于G2/M期的AsPC-1细胞达到(69.6±0.4)%(P<0.05)。

Fig 5 Apoptosis of AsPC-1 cells treatment with ZGDHu-1 for 48 h n=3)
Annexin V+/PI-represented early apoptosis and Annexin V+represented total apoptosis (include early and late apoptosis) as shown in the histogram.*P<0.05vscontrol.
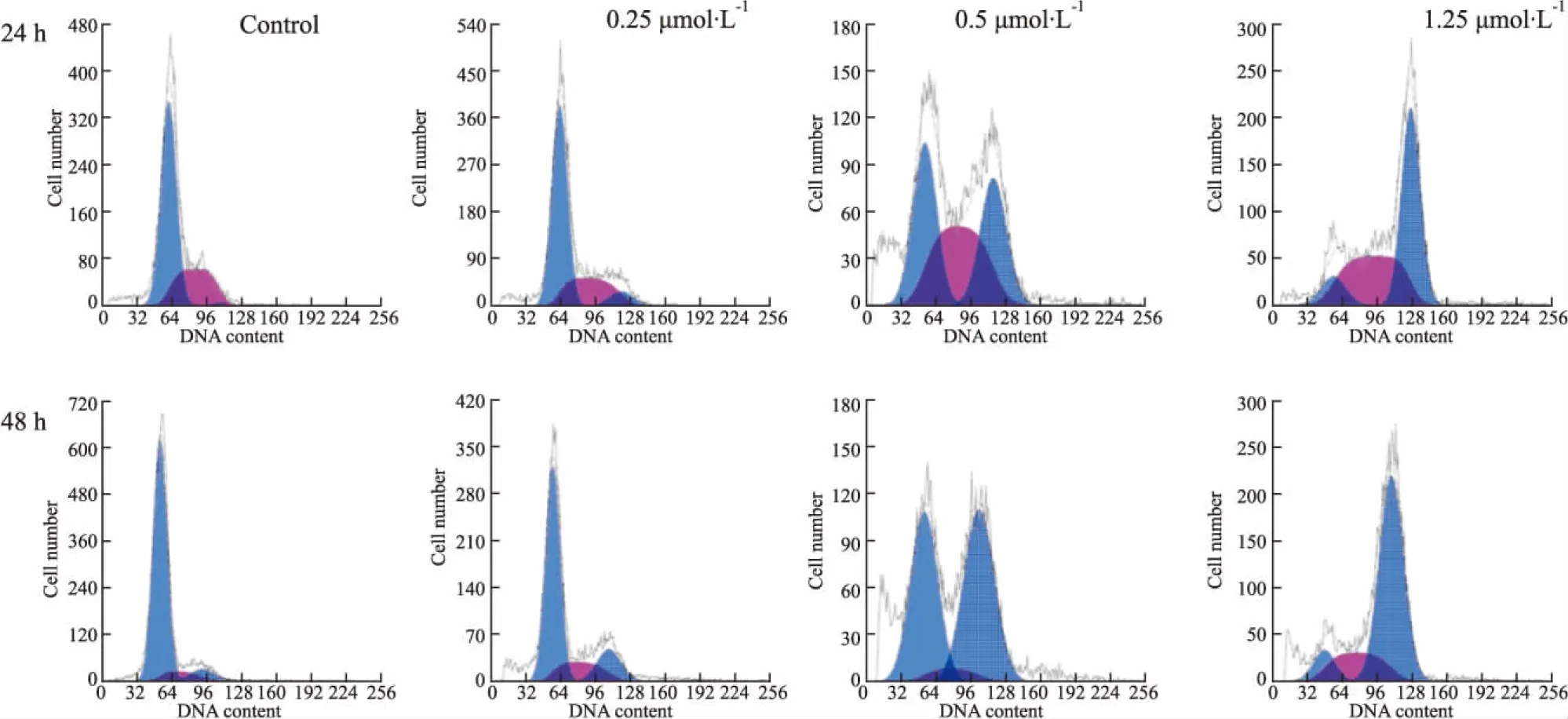
Fig 6 ZGDHu-1 induced G2/M cell cycle arrest on AsPC-1 cells

CellcycleConcentration of ZGDHu-1/μmol·L-124 h00.250.51.2548 h00.250.51.25G0/G1/%67.9±2.164.3±1.4∗33.7±0.2∗9.8±0.3∗84.6±2.366.6±0.6∗44.1±1.5∗9.5±0.3∗S/%31.0±0.728.0±0.637.4±1.540.2±1.28.3±1.117.6±1.16.0±0.820.9±0.9G2/M/%1.1±0.47.6±0.4∗28.9±1.7∗50.0±1.7∗7.1±0.515.8±0.5∗49.9±2.2∗69.6±0.4∗
*P<0.05vscontrol
2.4ZGDHu-1通过激活caspase-3信号通路诱导胰腺癌AsPC-1细胞凋亡Fig 7的Western blot结果显示,与对照组相比,ZGDHu-1作用后,Bax蛋白表达上调,尤以48 h变化更为明显。且随着ZGDHu-1浓度和作用时间的增加,AsPC-1细胞的caspase-3蛋白表达明显降低。结果表明,ZGDHu-1诱导胰腺癌细胞株AsPC-1凋亡可通过上调促凋亡蛋白Bax和激活caspase-3信号通路实现。

Fig 7 AsPC-1 cells cultured with ZGDHu-1 for 24 and 48 h and expression of Bax and caspase-3 protein
*P<0.05vscontrol
3 讨论
胰腺癌是先天性的耐药肿瘤之一,肿瘤细胞对化疗药物的抵抗成为胰腺癌治疗失败的主要原因[5]。因此,设计新的能克服抗药性和提高胰腺癌临床转归的靶向治疗策略迫在眉睫。
前期研究结果已证实,ZGDHu-1能在体外明显抑制白血病细胞和肺癌细胞的增殖,而且在这些肿瘤中的促凋亡效应是独立于其抗增殖行为[6-7]。本实验将不同浓度的ZGDHu-1与胰腺癌细胞株AsPC-1共同培养24、48、72 h后,研究结果表明,ZGDHu-1能在体外明显抑制胰腺癌细胞的增殖,且呈现浓度和时间的依赖效应。
观察细胞形态变化是了解ZGDHu-1能否诱导细胞凋亡最直观的方式。本研究中,通过瑞氏染色发现,随着ZGDHu-1浓度的增高,胰腺癌细胞间细胞连接消失,核质深染,细胞体积缩小,细胞核固缩、边缘化、核碎裂,细胞内形成数个大小不等的凋亡小体;经Hoechst 33258荧光染色后,显示ZGDHu-1作用后的胰腺癌细胞大小不一,细胞核或细胞质内可见浓染致密的颗粒块状荧光,在细胞内可明显观察到高蓝色荧光强度的凋亡小体。表明ZGDHu-1作用后,胰腺癌细胞出现了明显的凋亡,而且随着ZGDHu-1浓度的增加,凋亡细胞和凋亡小体比例明显增多,提示ZGDHu-1作用后,胰腺癌细胞出现了明显的凋亡现象。
在细胞凋亡早期,细胞膜上的磷脂酰丝氨酸由膜内侧外翻至细胞膜外侧,Annexin V能与膜外的磷脂酰丝氨酸特异性结合,而碘化丙啶(PI)不能透过完整的细胞膜[8],表明Annexin V阳性和PI阴性的细胞为早期凋亡细胞。通过流式细胞术检测ZGDHu-1作用胰腺癌细胞中Annexin V和PI的荧光强度,可以判断胰腺癌细胞是否发生早期凋亡。本实验结果显示,ZGDHu-1作用于AsPC-1细胞48 h后,Annexin V+/PI-比率逐渐增高,最高比例为20.6%,提示ZGDHu-1能诱导细胞早期凋亡。
迄今为止,关于ZGDHu-1诱导肿瘤细胞凋亡的分子机制有了广泛的研究。此前的研究表明,NF-κB信号通路可能在ZGDHu-1诱导髓系白血病细胞凋亡中发挥关键作用[9],而另一项研究结果表明ZGDHu-1可能通过上调促凋亡蛋白的表达水平,如Bax和p53,从而抑制肺癌细胞的增殖[6]。但目前关于ZGDHu-1对胰腺癌的抗肿瘤效应和相关的分子机制尚未阐明。
细胞周期是保证细胞增殖的一个错综复杂的过程,其可以分为4个阶段:DNA合成前期(G1期)、DNA合成期(S期)、DNA合成后期(G2期)以及细胞分裂期(M期)。本研究中,通过流式细胞术分析胰腺癌细胞的细胞周期,显示当1.25 μmol·L-1ZGDHu-1作用AsPC-1细胞48 h后,胰腺癌细胞基本停滞于G2/M期,显示ZGDHu-1将胰腺癌细胞周期明显阻滞于G2/M期,且呈浓度依赖关系。
目前主要研究的凋亡途径有两个:内源性途径(线粒体途径)和外源性途径(死亡受体途径)[10]。线粒体途径是被无数的压力信号激活,如DNA损伤,导致线粒体外膜通透性增加和凋亡蛋白的释放,如细胞色素C和线粒体源性半胱氨酸天冬氨酸蛋白酶激活物由线粒体进入细胞质中。线粒体途径中,Bcl-2能抑制细胞色素C的释放,而Bad、Bax则能促进细胞色素C的释放[11-13]。然而,死亡受体途径是通过死亡配体与细胞表面受体(TNF受体超家族)结合后激活,通过一系列复杂的信号转导过程,将凋亡信号向细胞内部传递,进一步激活凋亡的启动者caspase-8和后续的执行者caspases[14]。caspase-3是一个执行者半胱氨酸天冬氨酸蛋白水解酶,是线粒体途径和死亡受体途径共同通路中的下游激活者[15]。在本研究中,与对照组相比,ZGDHu-1作用后的Bax蛋白表达水平增加。此外,本研究显示,随着ZGDHu-1浓度和作用时间的增加,caspase-3前体的表达水平明显下降,提示ZGDHu-1主要通过激活caspase-3,诱导体外胰腺癌细胞凋亡。
综上所述,目前的研究表明,ZGDHu-1抑制胰腺癌细胞增殖的作用主要通过诱导细胞凋亡和阻滞细胞周期于G2/M期来实现。ZGDHu-1诱导细胞凋亡的分子机制主要通过促凋亡蛋白Bax的上调及caspase-3的活化。后期,我们也会探索更多ZGDHu-1抑制胰腺癌增殖的分子机制。
(致谢:本实验在浙江省人民医院检验中心完成,感谢各位老师和同学对实验的指导与帮助!)
