二氢杨梅素对高脂喂养ApoE-/-小鼠体内胆固醇逆向转运的影响
2018-11-12朱景平卫欣妤许晓乐
朱景平,卫欣妤,许晓乐
(1. 南阳医学高等专科学校第一附属医院临床药学科,河南 南阳 473000;2. 南通大学药学院药理系,江苏 南通 226001)
胆固醇逆向转运(reverse cholesterol transport,RCT) 通过促进胆固醇排泄,能明显降低血浆中胆固醇水平,减少胆固醇在血管壁聚积,从而有效防止动脉粥样硬化相关疾病的发生发展。RCT包含胆汁途径和非胆汁途径两种。胆汁途径 RCT使巨噬细胞内及外周组织的胆固醇通过血液循环转运到肝脏,转化为胆汁酸排出体外。非胆汁途径RCT则主要是脂蛋白将巨噬细胞及外周组织内胆固醇运输到小肠,经小肠分泌到肠腔后排出体外的过程[1-2]。二氢杨梅素(dihydromyricetin,DMY) 是一种黄酮类化合物,存在于多种植物中,其中藤茶类植物中含量较大。DMY已被证实具有抗炎、抗氧化、解酒保肝、抗菌、抗癌、抗糖尿病等多种药理作用[3]。此外,DMY改善高脂饮食动物的血脂,降低血中胆固醇含量已被证实[4-5]。我们近期的实验表明,DMY明显抑制低密度脂蛋白受体基因敲除小鼠(low-density lipoprotein receptor knockout mice,LDLr-/-)和载脂蛋白E基因敲除小鼠(apolipoprotein E knockout mice,ApoE-/-)动脉粥样硬化斑块的形成,改善动脉粥样硬化小鼠血脂水平[6-7]。但DMY抗动脉粥样硬化的机制还未完全阐明。鉴于RCT在血中胆固醇平衡中的重要作用,本研究旨在高脂喂养ApoE-/-小鼠模型上,观察DMY对小鼠体内RCT的影响及相关机制。
1 材料与方法
1.1材料
1.1.1 实验动物 6周龄♂C57BL/6J背景的ApoE-/-小鼠和野生型(wild-type,WT) C57BL/6J小鼠,购自北京大学医学部(实验动物科学部),许可证号:SCXK(京) 2011-2012。
1.1.2 药物与试剂 DMY购自西安天丰生物科技有限公司,批号NF-20151110;高脂饲料含脂肪21%、胆固醇0.21% (型号D12079B),购自常州开源饲料有限公司;Amplex Red细胞胆固醇检测试剂盒,购自Invitrogen公司;油红O染色试剂盒购自南京建成生物科技有限公司;总胆固醇(total cholesterol, TC)和甘油三酯(triglyceride, TG)测试试剂盒,购自中生北控生物科技有限公司;三磷酸腺苷结合盒转动体(ATP binding cassette transporter, ABC)A1小鼠单克隆抗体、ABCG1兔单克隆抗体、ABCG5兔多克隆抗体、ABCG8兔多克隆抗体、胆固醇7α-羟化酶(cholesterol 7-alpha hydroxylase,CYP7A1)兔多克隆抗体,均购于美国Abcam公司;GAPDH小鼠单克隆抗体,购自上海康成生物有限公司;总RNA 提取试剂盒购自北京天根生化科技有限公司;SYBR Green荧光定量试剂盒购自TaKaRa公司;胎牛血清购自Hyclone公司;其他试剂均为国产分析纯。
1.1.3 仪器 冰冻切片机(美国Beckman Coulter公司);ABI 7500荧光定量PCR仪(美国Applied Biosystem公司);全套Bio-Rad电泳及转膜系统(美国Bio-Rad公司);Olympus DP72显微镜(日本Olympus公司);全功能微孔板检测仪(美国Bio-Tek公司)。
1.2方法
1.2.1 动物模型的建立 ApoE-/-小鼠分成3组:模型组,给予高脂饮食8周;DMY低、高剂量组,ApoE-/-小鼠高脂饮食同时,给予DMY 250、500 mg·kg-1;与ApoE-/-小鼠相同背景的WT C57BL/6J小鼠作为阴性对照组,高脂饮食8周。每组8只小鼠。DMY溶于0.5%羧甲基纤维素钠中,灌胃给药。模型组和阴性对照组小鼠高脂饮食同时,灌胃0.5%羧甲基纤维素钠。
1.2.2 实验取材 造模结束前,实验动物禁食12 h,给予充足的水。取材前,小鼠称重。腹腔注入5 mL预冷的磷酸盐缓冲液(phosphate buffered saline,PBS),抽取腹腔渗出液,4 ℃下1 500 r·min-1离心5 min。细胞重悬于含10%胎牛血清的培养基中备用。打开小鼠胸腔暴露心脏,剪破右心耳,以小号头皮针从心尖位置插入,灌注预冷生理盐水5 min,直至血水变清,肝脏变白。灌注完毕取出肝脏、小肠,肝脏称重。将部分肝脏、小肠在生理盐水中洗涤,液氮速冻后保存备用。部分肝脏放入4%的多聚甲醛中固定,待切片染色。
1.2.3 肝脏组织油红O染色 染色前冰冻切片,4%多聚甲醛固定30 min。染色缸中双蒸水洗5 min,10%异丙醇浸洗5 min,油红O工作液染色30 min,60%异丙醇调色,随时放入清水中,调色结束后立即水洗,双蒸水洗2遍,苏木精复染核2 min,显微镜下观察。流水冲洗约1 min。放入1%盐酸乙醇分化5 s。流水冲洗约10 min,直至细胞核呈现深蓝色。擦拭干净组织周边水分,将切片擦干,甘油明胶封片,拍照。
1.2.4 巨噬细胞油红O染色及脂滴密度测定 将细胞用4%多聚甲醛固定30 min。PBS洗5 min,10%异丙醇浸洗5 min。用0.5%油红O染液染色30 min。苏木精复染核2 min,放入1%盐酸乙醇分化5 s。细胞内脂质呈红色,细胞核呈蓝色,细胞内脂质含量密度采用在540 nm波长处测定吸光度。
1.2.5 巨噬细胞内胆固醇含量测定 细胞接种于6孔板,每孔加入50 μL反应液,再加入50 μL工作液,避光,37 ℃孵育30 min;检测荧光强度,吸收波长530 nm,发射波长590 nm。细胞蛋白含量采用BCA蛋白定量试剂盒检测。
1.2.6 肝脏生化指标测定 肝脏中TC和TG检测按照试剂盒说明书进行。
1.2.7 Real time PCR检测 按试剂盒说明提取RNA,然后通过逆转录反应制备cDNA,以cDNA作为模板,使用SYBR Green进行定量PCR。PCR循环参数设为:50 ℃ 2 min;95 ℃ 5 min;95 ℃ 15 s,55 ℃ 30 s,35个循环;72 ℃ 5 min;4 ℃保存。以18S RNA为内参,引物序列见Tab 1。

Tab 1 Gene and primer for real-time PCR
1.2.8 Western blot检测 组织液氮研磨后,加入裂解液,置冰上裂解30 min;移入1.5 mL离心管中,12 000 r·min-1、4 ℃离心15 min;将上清吸入离心管中,BCA法蛋白定量。将蛋白样品配平后加入5×上样缓冲液,混匀,95 ℃ 5 min灭活,备用。按需要配制凝胶,加样后,接通电源,80 V电泳至Marker分离,换100 V电泳直至溴酚兰抵达分离胶底部。用硝酸纤维素膜进行转膜。将转好的膜放入封闭液中,4 ℃封闭过夜。漂洗后,一抗4 ℃孵育过夜。二抗室温避光孵育2 h。漂洗后,ODYSEEY扫描仪扫膜显影,并用图像分析系统进行灰度分析,以GAPDH为内参。
2 结果
2.1DMY对ApoE-/-小鼠腹腔巨噬细胞脂质沉积和RCT相关蛋白表达影响如Fig 1A~1C所示,与WT组相比,ApoE-/-小鼠高脂饮食8周后,腹腔巨噬细胞油红O染色显示脂滴明显增加,细胞内胆固醇含量也明显增加。而DMY低、高剂量组能明显减少小鼠腹腔巨噬细胞脂质的沉积和胆固醇含量。Fig 1D的Western blot结果显示,与模型组相比,DMY能增强RCT蛋白ABCA1和ABCG1的蛋白表达。
2.2DMY抑制ApoE-/-小鼠肝脏脂肪变性肝脏组织冰冻切片行油红O染色的结果显示,与WT组相比,ApoE-/-小鼠高脂喂养8周,油红O染色面积及颜色深度均增加,表明出现严重的脂质蓄积。而DMY低、高剂量干预组与模型组相比,染色面积及颜色深度均下降(Fig 2A)。此外,与WT组相比,模型组ApoE-/-小鼠高脂喂养后肝脏重量明显增加,DMY低、高剂量干预组与模型组相比,肝脏重量有下降趋势,但差异无统计学意义(Fig 2B)。肝脏中TC和TG含量检测结果表明,DMY低、高剂量干预组与模型组相比,均能明显降低肝脏中TC和TG含量(Fig 2C、2D)。
2.3DMY对ApoE-/-小鼠肝脏RCT相关蛋白表达的影响Real time PCR检测小鼠肝脏RCT相关蛋白mRNA表达结果显示(Tab 2),与模型组相比,DMY低、高剂量组能明显增加ABCG5、ABCG8、CYP7A1 mRNA表达,对B族I型清道夫受体(scavenger receptor class B type I,SR-BI)、ABCB4、ABCB11 mRNA的表达无明显影响。Fig 3的Western blot结果证实,DMY低、高剂量组能明显增加肝脏ABCG5、ABCG8、CYP7A1的蛋白表达。

Fig 1 Effect of DMY on macrophage foam cell formation in ApoE-/- mice
A:Representative images of Oil Red O staining of mice peritoneal macrophages; B:The density of the lipid content (n=8);C:Cholesterol content in mice peritoneal macrophages(n=8); D:Protein expression of ABCA1 and ABCG1 in peritoneal macrophages(n=4).#P<0.05vsWT group;*P<0.05vsApoE-/-group.
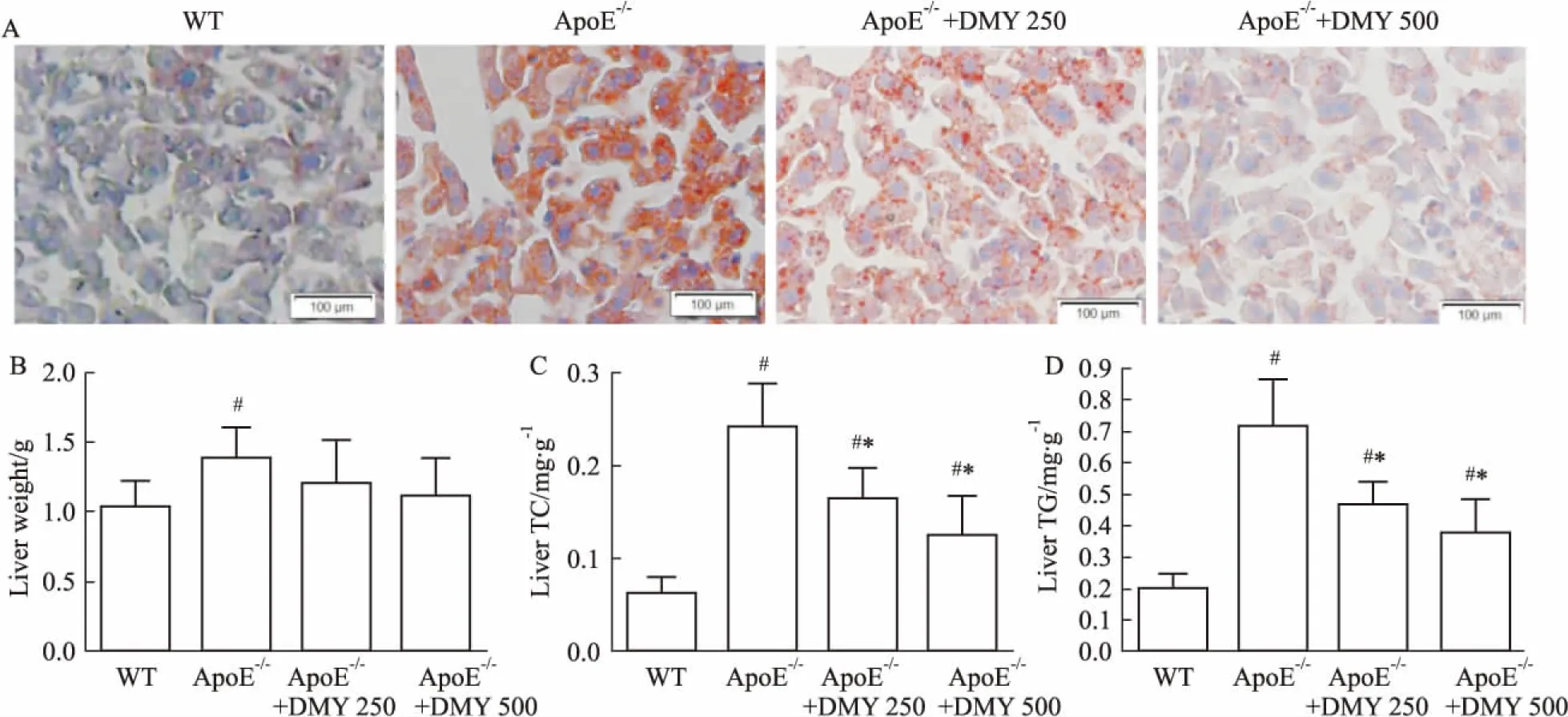
Fig 2 Effects of DMY on hepatic lipid accumulation and steatosis in ApoE-/-
A:Representative images of liver sections stained with Oil Red O; B:Liver weight; C:Liver TC content; D:Liver TG content.#P<0.05vsWT group;*P<0.05vsApoE-/-group.

Tab 2 Effects of DMY on mRNA expression of SR-BI, ABCG5, ABCG8, ABCB4, ABCB11 and CYP7A1 in liver of ApoE-/-
#P<0.05vsWT group;*P<0.05vsApoE-/-group

Fig 3 Effects of DMY on protein expression of ABCG5, ABCG8 and CYP7A1 in liver of ApoE-/-
*P<0.05vsApoE-/-group
2.4DMY对ApoE-/-小鼠小肠RCT相关蛋白表达的影响Fig 4的Western blot结果显示,与模型组相比,DMY低、高剂量组能明显增加小肠ABCG5和ABCG8的蛋白表达。

Fig 4 Effects of DMY on protein expression of ABCG5 and ABCG8 in intestine of ApoE-/-
*P<0.05vsApoE-/-group
3 讨论
调脂研究近年来得到了新的发展,与以往单纯关注血脂水平高低的不同,新的调脂研究深入到分子水平,尤其对细胞内胆固醇稳态的相关机制进行了研究,提出了RCT过程[1]。DMY抗动脉粥样硬化作用和改善血脂作用虽然已被证实,但其机制还未阐明。我们利用体外培养巨噬细胞证实,DMY能促进巨噬细胞胆固醇流出,减轻巨噬细胞脂质蓄积[7]。为了全面分析DMY对RCT的影响,本实验利用高脂喂养的ApoE-/-小鼠,重点观察DMY对在体RCT的影响及相关机制。
目前,以C57BL/6小鼠为背景的载脂蛋白E(apolipoprotein E,ApoE)基因敲除小鼠被广泛用于动脉粥样硬化的研究中[8]。我们已在高脂喂养的ApoE-/-小鼠上观察到DMY能明显减少斑块面积,并明显降低血中TC、TG和低密度脂蛋白-胆固醇的水平,增加血中高密度脂蛋白-胆固醇水平[7]。巨噬细胞源性的泡沫细胞在动脉粥样硬化早期脂纹期到后期粥样斑块形成期,都发挥关键作用。侵入血管内膜层的巨噬细胞通过表面的清道夫受体,对修饰型低密度脂蛋白进行吞噬,同时也通过细胞上的胆固醇转运体蛋白,将细胞内过多的胆固醇排出,当细胞内胆固醇排出水平低于摄取水平,巨噬细胞将转变为脂质超载的泡沫细胞,这一转变与细胞内胆固醇稳态失衡密切相关[9]。主动脉斑块处巨噬细胞通常用腹腔巨噬细胞进行替代[10]。本研究结果显示,DMY能明显减少腹腔巨噬细胞内脂质和胆固醇含量,提示此作用有助于减少斑块的形成。进一步研究表明,DMY能明显增强腹腔巨噬细胞上ABCA1和ABCG1蛋白的表达。ABCA1和ABCG1为膜蛋白,属于三磷酸结合盒转运体超家族,通过水解ATP供能,实现对胆固醇等底物的跨膜转运功能。ABCA1主要介导细胞内胆固醇流向载脂蛋白,而ABCG1则促进细胞内胆固醇流向高密度脂蛋白[11]。因此,ABCA1和ABCG1被认为是抗动脉粥样硬化的重要靶点。ABCA1与ABCG1均缺陷的巨噬细胞被注入小鼠体内,则明显损害其体内巨噬细胞依赖性的胆固醇转运[12]。我们的结果提示,DMY可能通过增强ABCA1和ABCG1胆固醇转运体蛋白的表达,促进细胞内胆固醇排出,从而减少巨噬细胞内胆固醇蓄积,抑制泡沫细胞形成。
肝脏是体内胆固醇代谢的重要器官。在RCT方面,肝脏上的SR-BI介导细胞选择性摄取高密度脂蛋白中游离胆固醇和胆固醇酯[13]。在肝脏内,肝细胞可通过ABCG5/G8和ABCB11、ABCB4等,分别介导游离胆固醇、胆汁酸、磷脂等分泌到毛细胆管中,最终随粪便排出体外[14]。CYP7A1是胆汁酸合成经典途径的限速酶,催化胆固醇在肝脏分解为胆汁酸排出体外,在维持胆固醇稳态及胆汁酸合成中发挥重要作用[15]。我们的结果显示,DMY能明显降低肝脏中脂质、胆固醇和甘油三酯含量。DMY对肝脏SR-BI、ABCB4、ABCB11的基因表达无影响,但明显增强了ABCG5、ABCG8、CYP7A1的mRNA和蛋白表达。以上结果提示,DMY可通过增强肝脏CYP7A1、ABCG5和ABCG8表达,分别增加肝脏内胆固醇的分解和促进其排出。
肠转运胆固醇排出即代表非胆汁途径 RCT。目前,对于非胆汁途径 RCT的研究尚处于起步阶段。ABCG5/G8可促进胆固醇从肠上皮细胞的顶端膜分泌到肠腔,在肠转运胆固醇排出中起到一定作用[2]。本实验结果表明,DMY能增加小肠ABCG5和ABCG8的蛋白表达,提示DMY可通过增强非胆汁途径 RCT,有助于促进胆固醇的排出。
综上所述,本研究表明DMY能促进高脂喂养ApoE-/-小鼠体内RCT,即DMY通过上调胆固醇逆向转运体蛋白ABCA1和ABCG1,促进巨噬细胞胆固醇外流,通过增强肝脏ABCG5、ABCG8和CYP7A1表达,增加肝脏内胆固醇的分解和促进其排出,同时增强小肠ABCG5和ABCG8的蛋白表达,提高非胆汁途径 RCT。这一作用有助于DMY抗动脉粥样硬化和调节血脂,为DMY在心血管疾病方面的应用提供了新的理论基础。
(致谢:本实验在南通大学药学院药理系完成,感谢对实验给予帮助的老师和同学。)
