内耳畸形CT分类在人工耳蜗植入手术中的应用
2018-11-07黄宏明周正根葛润梅王晓茜吴佩娜
黄宏明周正根葛润梅王晓茜吴佩娜
1广东省人民医院(广东省医学科学院)耳鼻咽喉科(广州 510080)2广东省人民医院(广东省医学科学院)放射科(广州510080)
内耳畸形是先天性感音神经性聋的重要原因之一,临床上约20%的先天性感音神经性聋是由内耳畸形导致。Jackler于1987年依据胚胎学和多轨迹体层摄影的研究结果提出了经典的内耳畸形分类方法[1]。Sennaroglu根据高分辨率颞骨CT的扫描结果,对Jackler的内耳畸形分类方法进行了改进,并在临床上得到广泛的应用[2]。人工耳蜗植入是治疗双侧重度-极重度感音神经性聋的有效手段,随着人工耳蜗植入手术适应症的扩展,内耳畸形患者接受人工耳蜗植入的比例逐渐增加。内耳畸形患者实施人工耳蜗植入手术的难度大,发生手术并发症的风险也增加,是当前人工耳蜗植入手术的难点之一。本研究拟对在我院实施人工耳蜗植入手术的内耳畸形病例进行回顾性分析,探讨内耳畸形CT分类方法在人工耳蜗植入手术中的应用价值,报道如下。
1 资料与方法
1.1 临床资料
2011年4 月至2016年9月,广东省人民医院实施人工耳蜗植入手术共628例,根据术前的高分辨率颞骨CT扫描结果,收集到资料完整的内耳畸形患者共76例(150耳),其中男性54例,女性22例;年龄1~43岁,平均(6.3±7.9)岁。76例患者均为双侧重度-极重度感音神经性聋,其中语前聋68例,语后聋8例。
1.2 颞骨CT扫描方法
颞骨CT扫描使用GE VCT 64层螺旋CT机,采用螺旋扫描,听眶上线为基线,扫描范围上缘达岩锥弓上隆起、下缘达乳突尖;管电压300~350mA,管电流120KV;扫描层厚为0.625mm,重建层厚为0.625mm,重建间隔为0.3mm。CT扫描图像传送至GE AW4.1工作站,行多平面重建。
1.3 内耳畸形的CT分类方法
由同一位高年资的放射科医师对所有病例的颞骨CT进行评估,并参照Sennaroglu(2010年)内耳畸形的分类方法进行分类,依次分为:米歇尔畸形、耳蜗未发育、共同腔畸形、耳蜗发育不良I型、耳蜗发育不良II型、耳蜗发育不良III型、不完全分隔I型(IP-I)、不完全分隔II型(IP-II)、不完全分隔III型(IP-III)、前庭及半规管畸形、大前庭导水管综合征、内听道狭窄[3]。
1.4 人工耳蜗植入方法
所有患者的人工耳蜗植入手术均由同一位经验丰富的耳科医师实施,采取耳后切口,乳突切开,无耳蜗结构的内耳畸形经乳突迷路开窗植入电极,有耳蜗结构的内耳畸形经面隐窝入路鼓阶开窗或圆窗植入电极。术中根据内耳畸形的类型和程度,选择合适的电极类型和长度。术中脑脊液“井喷”的内耳畸形患者,采用颞肌筋膜封堵内耳开窗口。植入电极后进行电极阻抗和神经反应遥测检测。术前CT显示内听道底部骨质缺损的患者,植入电极后行X线检查(C臂机),了解电极位置。
2 结果
2.1 内耳畸形的CT分类情况
内耳畸形患者共76例(150耳),71例为双侧对称的内耳畸形,5例为双侧不对称的内耳畸形。5例双侧不对称的内耳畸形中,2例为单侧内耳畸形,另一侧内耳结构正常;3例为一侧共同腔畸形,另一侧IP-I。内耳畸形的150耳中,米歇尔畸形0耳(0%),耳蜗未发育2耳(1.3%),共同腔畸形7耳(4.7%)、耳蜗发育不良I型3耳(2.0%),耳蜗发育不良II型2耳(1.3%),耳蜗发育不良III型 11耳(7.3%),IP-I 13耳(8.7%),IP-II 70耳(46.7%),IP-III 4耳(2.7%),前庭及半规管畸形11耳(7.3%),大前庭导水管综合征22耳(14.7%),内听道狭窄5耳(3.3%)。
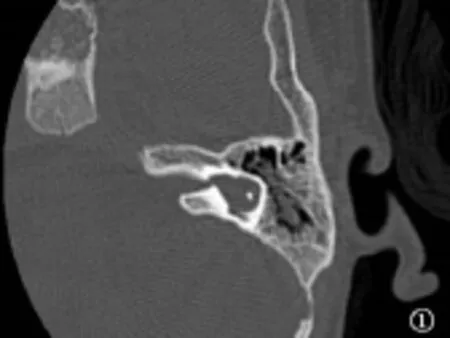
图1 耳蜗未发育Fig.1 Cochlear aplasia
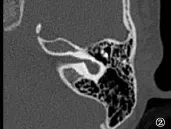
图2 共同腔畸形Fig.2 Common cavity
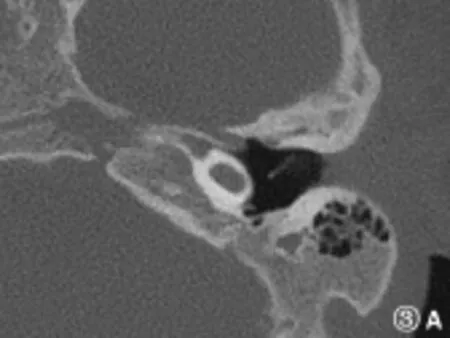
图3 A耳蜗发育不良I型(耳蜗层面)Fig.3 A Cochlear hypoplasia type I(cochlear section)
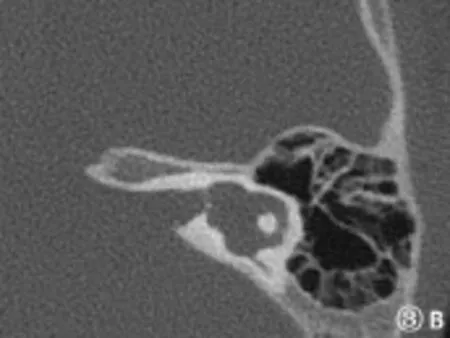
图3 B耳蜗发育不良I型(内听道层面)Fig.3B Cochlear hypoplasia type I(internal auditory canal section)
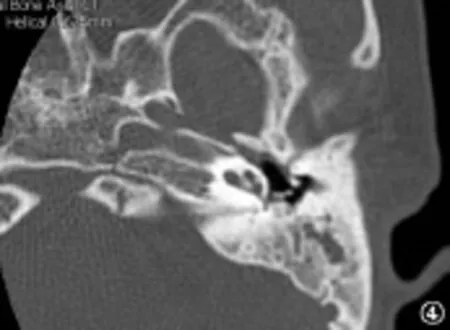
图4 耳蜗发育不良II型Fig.4 Cochlear hypoplasia type II
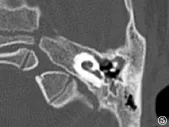
图5 耳蜗发育不良III型Fig.5 Cochlear hypoplasia typeⅢ
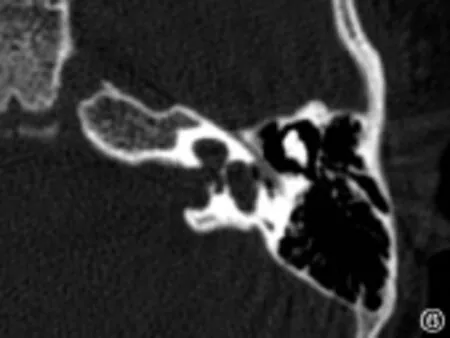
图6 不完全分隔I型Fig.6 Incomplete partition type I
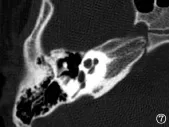
图7 不完全分隔II型Fig.7 Incomplete partition typeⅡ
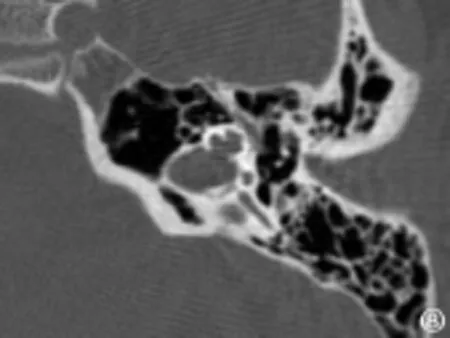
图8 不完全分隔III型Fig.8 Incomplete partition type III

图9 内听道狭窄Fig.9 Narrow internal auditory canal
2.2 内耳畸形的人工耳蜗植入情况
实施人工耳蜗植入手术的内耳畸形患者共有76例(80耳),双侧植入4例,左侧植入12例,右侧植入60例。植入人工耳蜗的80耳中,内耳结构正常2耳(2.5%),耳蜗未发育1耳(1.3%),共同腔畸形3耳(3.8%),耳蜗发育不良I型2耳(2.5%),耳蜗发育不良II型1耳(1.3%),耳蜗发育不良III型5耳(6.3%),IP-I 8耳(10.0%),IP-II 38耳(47.5%),IP-III 2耳(2.5%),前庭及半规管畸形5耳(6.3%),大前庭导水管综合征11耳(13.8%),内听道狭窄2耳(2.5%)。
5例双侧不对称的内耳畸形患者中,2例为单侧内耳畸形均选择内耳结构正常那一侧植入人工耳蜗;3例为一侧共同腔畸形,另一侧IP-I,均选择IP-I那一侧植入人工耳蜗。经乳突迷路开窗植入人工耳蜗电极4耳(耳蜗未发育1耳,共同腔畸形3耳),紧贴囊腔骨壁植入电极,电极的末端置于开窗处,呈环形植入,在腔内填塞肌粒固定电极及封堵窗口;经面隐窝入路鼓阶开窗或圆窗植入人工耳蜗电极76耳。植入耳为耳蜗未发育畸形、共同腔畸形的患者,根据囊腔大小选择相应长度的直电极(MED-EL Compressed电极或MED-EL Medium电极);植入耳为耳蜗发育不良I型、耳蜗发育不良II型、耳蜗发育不良III型、IP-I和IP-III的患者均选择植入短的直电极(MED-EL Compressed电极或Cochear ST电极)。植入耳为IP-II、前庭及半规管畸形、大前庭导水管综合征及内听道狭窄的患者选择植入标准电极(MED-EL Standard电极或Cochear CA电极)。
共有5例(6耳)IP-I患者及2例(2耳)IP-III患者术前CT显示内听道底部骨质缺损,术中均出现脑脊液“井喷”。1例IP-I患者,同期双侧植入,术后左侧出现脑脊液耳漏,二次手术封堵后痊愈。1例IP-III患者,术中X线检查提示电极进入内听道内,取出电极,经调整后顺利植入。所有患者的工作电极均完全植入,术后的神经反应遥测除1例IP-I患者无反应外其余患者均可引出,其中有1例共同腔畸形、4例IP-I和2例内听道狭窄患者的反应波形不典型,术后均无面瘫、皮瓣坏死及感染。所有患者术后开机正常,并进行听觉言语康复。
图10 耳蜗未发育病例,人工耳蜗植入术后神经反应遥测波形良好。A.第1号电极;B.第7号电极Fig.10 The case of cochlear aplasia presents clear wavsforms of neural responses telemetry after cochlear implantation.A.Electrode No.1;B.Electrode No.7
3 讨论
内耳畸形主要是内耳在发育过程中受到各种因素的影响,导致胚胎发育停滞所致。内耳的胚胎发育在不同阶段出现停滞,会出现不同类型的内耳畸形,在第3周出现米歇尔畸形,第3周晚期出现耳蜗未发育,第4周出现共同腔畸形,第5周出现IP-I,第6周出现耳蜗发育不全,第7周出现IP-II,第8周后耳蜗形态正常[4]。Jackler于1987年依据胚胎学和多轨迹体层摄影的研究结果提出了经典的内耳畸形分类方法,包括米歇尔畸形、耳蜗未发育、耳蜗发育不全、不完全分隔、共同腔畸形、前庭及半规管畸形和大前庭导水管综合征等类型[1]。随着高分辨率颞骨CT的出现,能更清晰的显示颞骨骨性结构,已成为颞骨影像学检查的主要手段。Sennaroglu根据颞骨CT的检查结果,在Jackler分类的基础上,进一步将耳蜗发育不全和不完全分隔各分为三个亚型,分别是耳蜗发育不良I型、耳蜗发育不良II型、耳蜗发育不良 III型,以及 IP-I、IP-II、IP-III。米歇尔畸形为耳蜗和前庭均缺如;耳蜗未发育为耳蜗缺如,前庭发育;共同腔畸形为耳蜗和前庭融合成一囊腔;耳蜗发育不良为耳蜗小于正常(高度小于4mm),并根据耳蜗外形、耳蜗轴和分隔的发育情况分为三个亚型;不完全分隔的耳蜗大小正常但耳蜗轴和分隔异常,IP-I为耳蜗轴和分隔均缺如,IP-II为顶部的耳蜗轴和分隔缺如,IP-III为耳蜗轴缺如但分隔正常;前庭和半规管畸形为耳蜗正常,前庭和或半规管发育异常;大前庭导水管综合征为单纯的前庭导水管扩大(中点宽度大于1.5mm);内听道狭窄为内听道中点的宽度小于2.5 mm[2,3]。本组资料涵盖除了米歇尔畸形外的其它所有类型,其中IP-II及大前庭导水管的比例分别为46.7%及14.7%,分列前两位。内耳畸形患者的高分辨率颞骨CT评估极为重要,可以帮助了解内耳畸形的类型和程度,为进一步制定人工耳蜗植入方案提供重要依据。
具有可供电极植入的耳蜗结构以及完整的听神经传导通路是实施人工耳蜗植入手术的两个基本条件。米歇尔畸形由于内耳结构及听神经均缺如,是人工耳蜗植入的绝对禁忌症。耳蜗未发育畸形的耳蜗结构缺如,仅有前庭结构,属人工耳蜗植入的相对禁忌症。Jeong和Kim在2012年报道了2例耳蜗未发育患者的人工耳蜗植入案例,植入耳术前可引出听性稳态反应以及内耳MR检查显示听神经存在,术后的助听听阈及言语感知能力均明显改善[5]。本组资料有1例耳蜗未发育畸形患者实施了人工耳蜗植入手术,采取经乳突外半规管开窗,将电极植入前庭中,术后的助听听阈及言语感知能力显著提高。因此,对于听神经存在并可在术前引出听觉诱发反应的耳蜗未发育畸形患者,在前庭中植入人工耳蜗,仍可使患者获益。对于共同腔畸形、耳蜗发育不良、耳蜗不完全分隔、大前庭导水管综合征、前庭及半规管畸形及内听道狭窄等内耳畸形患者均属人工耳蜗植入适应症,术后可获得良好的听觉及言语效果[6]。
内耳畸形患者大部分都是双侧对称畸形,小部分为不对称畸形。本组资料76例患者中,71例为双侧内耳对称畸形,5例为双侧内耳不对称畸形。内耳畸形患者人工耳蜗植入的效果和内耳畸形的程度有关,内耳畸形的程度越严重,人工耳蜗植入的效果就越差[7]。因此,对于双侧不对称的内耳畸形患者,我们选择畸形程度较轻的一侧进行人工耳蜗植入,以获得更好的术后效果,并减少手术并发症的风险。不同类型的内耳畸形,其耳蜗大小以及内部结构存在差别,需要根据不同的内耳畸形类型来选择合适的人工耳蜗电极。耳蜗未发育及共同腔畸形患者,内耳呈囊腔状,听神经纤维沿囊壁分布,采取经迷路开窗植入直电极,使电极贴壁盘转,直接刺激囊壁上的神经纤维[8]。耳蜗发育不良畸形患者,由于耳蜗尺寸比正常耳蜗小,同时伴有耳蜗轴及耳蜗分隔发育不良,宜选择短的直电极。不完全分隔畸形中,P-I和IP-III患者虽然耳蜗大小正常,但无耳蜗轴,适合使用短的直电极,选择直电极为了使电极紧贴着耳蜗壁盘转,选择短电极可避免电极末端反转进入内听道;IP-II患者的耳蜗大小正常,有部分耳蜗轴,可选择标准电极[9,10]。对于单纯的前庭及半规管畸形、大前庭导水管及内耳道狭窄患者,其耳蜗结构均正常,可选择标准电极。本组资料所有病例,均根据术前的CT分类结果选择电极,所有患者的工作电极均完全植入。
本组资料中所有P-III病例和及大部分IP-I患者术前CT检查发现内听道底部骨质缺损,在人工耳蜗植入时出现脑脊液“井喷”现象。内听道底部骨质缺损是人工耳蜗植入术中脑脊液“井喷”的主要原因,由于耳蜗底转与内听道相通,脑脊液经耳蜗开窗处漏出,增加了电极植入的难度以及术后脑脊液漏的风险[11,12]。此类患者术中需要扩大电极植入窗口,待脑脊液充分漏出,耳蜗内压力降低后再植入电极,并使用颞肌筋膜在电极周围封堵窗口,防止术后脑脊液漏。合并内听道底部骨质缺损的内耳畸形患者,人工耳蜗电极容易直接植入到内听道,开机后由于电极直接刺激内听道内的面神经,可导致面肌抽搐。因此,对于此类患者,植入电极后,需要行术中CT或X线检查了解电极位置,必要时及时重新调整电极。
本研究结果表明,内耳畸形的CT分类对内耳畸形患者的人工耳蜗植入手术具有指导价值,可根据内耳畸形的程度和类型选择合适的手术入路及电极类型,以获得较好的手术效果,有效减少手术并发症的发生。
