杨树桑黄胞外多糖的分子结构及抗氧化活性
2018-11-06何培新吴双双许春平
何培新, 吴双双, 郑 凯, 许春平*
(1.郑州轻工业学院 食品与生物工程学院,河南 郑州 450002;2.河南中烟工业有限责任公司许昌卷烟厂,河南许昌461000)
杨树桑黄,即瓦尼木层孔菌 (Phellinus vaninii Ljub),是一种生长在杨树上的药用真菌,俗称为杨黄,属担子菌亚门、层菌纲、非褶菌目、锈革孔菌科(Hymenochaetaceae),木(针)层孔菌属(Phellinus)[1],是近年来被广泛关注的桑黄“新秀”。桑黄是国际公认的生物治癌领域中效率最高的大型真菌[2],有报道杨黄具有与传统桑黄同样的抑制肿瘤的功效[3-4],我国传统中药中用于治疗痢疾、盗汗、血崩等[5]。近几年,对瓦尼木层孔菌的驯化栽培已经获得成功[6-8],但是关于瓦尼木层孔菌活性物质多糖结构和生物活性相关的报道很少。
作者对发酵罐制得的杨树桑黄EPS进行分离纯化、结构表征和抗氧化的测定,为进一步研究杨树桑黄EPS的构效关系及其在医药行业的应用奠定了基础。
1 材料与方法
1.1 试验材料
1.1.1 供试菌珠杨树桑黄来源于郑州轻工业学院发酵工程研究室,于斜面培养基上4℃保存。
1.1.2 发酵罐种子液的制备用打孔器取平板边缘新生菌丝两块,接种到含有50 mL种子液的250 mL锥形瓶中,于160 r/min、26℃的摇床中培养4 d。然后向种子液中加入适量灭菌磁珠和玻璃珠,用磁力搅拌器将菌丝球打碎后备用。本研究所有接种体积分数均为4%。
1.1.3 发酵培养条件采用摇瓶优化的发酵培养基:40 g/L 蔗糖,4 g/L 玉米粉,4 mmol/L KH2PO4,pH 7,发酵培养温度28℃,搅拌速度160 r/min,进气量2 vvm。
1.1.4 透析袋采用截留相对分子质量3 500,直径22 mm,压平宽度34 mm(上海索莱宝生物科技有限公司)的透析袋。
1.1.5 主要仪器SW-CJ-2F超净工作台:苏净安泰空气技术有限公司;5L搅拌式发酵罐:上海百伦科技有限公司;CXG-1恒温层析柜(含DLH-A恒流泵,DBS-100全自动收集器):上海青浦沪西仪器公司;UV-17001C紫外分光光度计:上海凤凰光学科仪有限公司;Sepharose CL-6B层析柱:上海索莱宝生物技术公司;日本EYELA全自动旋转蒸发仪N-2100:东京理化器械株式会社;Nicolet 5700傅立叶变换红外光谱仪:美国尼高力仪器公司;尺寸排阻色谱-多角度激光光散射(SEC-MALLS):美国怀亚特技术公司。
1.1.6 主要化学试剂蔗糖、苯酚、浓硫酸、氯仿、正丁醇、无水乙醇、KH2PO4、NaNO3、NaN3、KBr、吡啶、甲醇:均为分析纯,购自天津市科密欧化学试剂有限公司;玉米粉:购自莲花市场;蓝色葡聚糖2000、标准葡聚糖(Dextran T10、T40、T70、T150):购自上海玉博生物科技有限公司;Sepharose CL-6B:购自Solarbio公司;三氟乙酸(色谱纯):购自阿拉丁;三甲基氯硅烷(BSTFA∶TMCS,99∶1)(色谱纯):东京化成工业株式会社。
1.2 实验方法
1.2.1 发酵液中多糖的提取利用抽滤法[9]分离菌丝体和发酵液,将所得发酵液旋蒸浓缩至100 mL左右,加入4倍体积无水乙醇,4℃静置过夜,然后10 000 r/min离心15 min,得到多糖沉淀。
1.2.2 sevag法脱蛋白用适量蒸馏水使所得多糖沉淀完全溶解,加入约1/3多糖溶液的脱蛋白液(V氯仿∶V正丁醇=5∶1),置于磁力搅拌器上 30 min,然后于分液漏斗中静置20 min,除去下层的有机相,保留水相,重复操作4~5次,直至有机相与水相间无明显沉淀为止。将所有水相浓缩至100 mL左右,加入4倍体积无水乙醇,4℃静置过夜,然后10 000 r/min离心15 min,得到粗多糖沉淀。粗多糖沉淀冷冻干燥即得胞外粗多糖[10]。
1.2.3 胞外粗多糖的分离纯化称量20 mg粗多糖,溶解于2 mL、0.2 mol/L的NaCl溶液中,用0.22 μm孔径的滤膜过滤后通过Sepharose CL-6B柱层析。调整恒流泵使洗脱液流速为1.15 mL/min,利用自动收集器收集。从每管取1 mL收集液,用苯酚硫酸法[11]于490 nm处检测多糖,于280 nm处直接检测收集液的蛋白质,记录吸光度值。然后以收集管数为横坐标,多糖和蛋白质的吸光度值为纵坐标,绘制粗多糖的分离纯化图。重复过层析柱8~10次,将同一组分的多糖收集在一起,浓缩后用截留相对分子质量为3 500的透析袋透析3 d,每天换蒸馏水3次。最后将透析过的精制胞外多糖冷冻干燥,置干燥器中备用。
1.2.4 凝胶过滤法测胞外多糖的相对分子质量用0.2 mol/L NaCl溶液平衡Sepharose CL-6B层析柱24 h后,先用蓝色葡聚糖2000加入柱内测得外水体积V0,然后取2 mL质量浓度为2 mg/mL的相对分子质量不同的标准葡聚糖 (Dextran T10、T40、T70、T150)分别相继上样,调整恒流泵使洗脱液流速为1.15 mL/min,利用自动收集器收集。用苯酚硫酸法检测吸光度值,合并洗脱液,分别求得洗脱体积Ve。凝胶柱所能容纳的总体积定为Vt,其计算方法见公式(1)。以各标准多糖的分配系数Kav值为横坐标,相对分子质量的对数值为纵坐标做标准曲线。Kav值的计算公式见式(2)。

其中:D为层析柱直径,h为层析柱高,Ve为洗脱体积,V0为外水体积,Vt为柱床总体积。
按上述方法测得真菌胞外多糖的Ve,由标准曲线求得其相对分子质量[12]。
1.2.5 精制EPS的红外光谱(IR)测定称取2~3 mg精制EPS,加入适量的KBr,研磨均匀后压片,用傅立叶变换红外光谱仪在4 000~400 cm-1波长区间内扫描红外吸收值[13]。
1.2.6 精制EPS的气相色谱/质谱(GC/MS)测定称取精制EPS 3 mg,放入棕色小瓶中,加入3 mL、2 mol/L的三氟乙酸,密封后置于121℃的烘箱中恒温2 h。冷却后过0.22 μm的水相滤膜,将所得滤液旋蒸干后,加入3 mL甲醇再次旋蒸干,重复操作3次。最后加入1.5 mL吡啶和0.1 mL衍生试剂BSTFA∶TMCA(99∶1),密封后置于 80 ℃的烘箱中恒温1 h,冷却后过0.22 μm的有机滤膜,送样检测[14]。
上样条件:色谱柱型号为HP-5 MS 60 m,分流比 100∶1,进样量 0.1 μL,延迟时间 7 min,进样口280,传输线280。升温程序:起始温度为60℃,保持2 min,然后以5℃/min的速度升温至280℃,保持20 min。MS分析条件:溶剂延迟7 min,扫描范围35~455 aum,进样口280℃,传输线温度280℃,EI能量70 eV,离子源温度230℃,四级杆温度160℃。
1.2.7 SEC/MALLS测定精制EPS的绝对分子质量及分子构象研究表明,将尺寸排阻色谱(SEC)、多角度激光光散射检测仪(MALLS)和示差折光检测仪(RI)联用,可以测定多糖的绝对分子质量及分子构象[15]。
用50 mmol/L NaNO3和0.02%NaN3溶解精制EPS样品,配制成2 mg/mL的样品溶液,用0.22 μm的水相膜过滤后备用。流速设定为0.5 mL/min,进样量为100 μL,dn/dc值根据相关研究设为0.14 mL/g[16]。多糖的相对分子质量和均方根旋转半径由软件Astra 4.72(美国怀亚特公司)计算得出。由均方根旋转半径对相对分子质量的双对数曲线,可判断多糖分子在水溶液中的构象。具体条件由以下公式给出:
球形:r3i∝Mi→lgri=k+1/3lgMi
无规则卷曲:r3i∝Mi→lgri=k+1/2lgMi
刚性杆状:r3i∝Mi→lgri=k+lgMi
其中,ri为多糖的均方根旋转半径;Mi为多糖的相对分子质量;k为均方根半径的截距;1/3、1/2和1为多糖不同构象的临界值。
1.2.8 精制EPS的粘度测定[17]EPS的粘度用乌氏粘度计在(25±0.1)℃的水浴中进行测定。为了忽略动能的校正,需要选择溶剂流出毛细管时间大于120 s的粘度计。采用逐步稀释法按照Huggins方程(3)和 Kraemer方程(4),将浓度外推至零计算[η]:

其中,ηsp/c 为比浓粘度;lnηr/c 为比浓对数粘度;k′和β为多糖在恒定温度下溶剂中的常数值。
1.2.9 精制EPS均方根旋转半径(Rg)和流体力学半径(Rh)的测定[18]分子质量中心到各质点(基团)距离平方的平均值的平方根被定义为均方根旋转半径(Rg),它反映单个高分子分子链在空间的伸展程度。流体力学半径(Rh)反映流体力学作用时大分子在溶液中的尺寸,它是一个与高聚物链有相同平移扩散系数的等效球体的半径[19]。Rg通过SECMALLS法测得,而Rh通过粘度法获得,根据Einstein理论公式(5)Rh推算得:
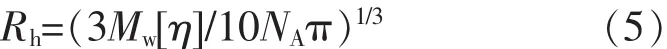
其中,NA为阿伏伽德罗常数 (6.022×1023);Mw和[η]分别为重均相对分子质量和特性粘度。
均方旋转半径和流体力学半径的比值可以用ρ表示:

1.2.10 邻二氮菲法测定EPS对·OH的清除能力
配置质量浓度梯度分别为 2、4、6、8、10 mg/mL 的EPS溶液10 mL。取7支试管,其中5支为实验组,1支作为对照组,1支为调零组。向实验组中加入1 mL pH 7.4 磷酸缓冲液 (0.02 mmol/L,PBS),1 mL 7.5 mmol/L邻二氮菲溶液,1 mL 3.25 mmol/L FeSO4溶液,1 mL 1.5%H2O2,2 mL 多糖溶液[21]。其中调零组以蒸馏水替代2 mL多糖溶液,对照组以蒸馏水替代2 mL多糖溶液和1 mL 1.5%H2O2。混匀后,37℃水浴1 h。调零组调零后,用紫外分光光度计于510 nm处测定实验组和对照组的吸光度值。每组做3次平行,取其平均值。EPS对·OH清除率的计算公式如下:

其中,Ai为实验组的吸光度值;Aj为对照组的吸光度值。
1.2.11 EPS对·DPPH清除能力的测定配置质量浓度梯度为 1、2、3、4、5 mg/mL 的 EPS 溶液 20 mL。取11支试管,5支为实验组,5支为对照组,1支为空白组。向实验组分别加入2 mL EPS溶液、2 mL 0.1 g/L的DPPH 50%乙醇溶液,混匀后25℃水浴1 h,以50%乙醇溶液为空白,于517 nm处测定其吸光度Bi;向空白组分别加入2 mL 0.1 g/L的DPPH 50%乙醇溶液、2 mL蒸馏水,混匀后25℃水浴1 h,测定其吸光度Bo[22];向对照组分别加入2 mL EPS溶液、2 mL 50%乙醇,混匀后25℃水浴1 h,测定其吸光度Bj。EPS对·DPPH清除率的计算公式如下:其中,Bi为实验组的吸光度值;Bj为对照组的吸光度值;B0为空白组的吸光度值。

2 结果与讨论
2.1 杨树桑黄EPS的分离纯化
发酵罐发酵杨树桑黄所产EPS经除蛋白质后,通过Sepharose CL-6B柱层析进行分离纯化,结果见图1。通过分析可知,杨树桑黄粗多糖纯化时有两个多糖吸收峰,即两个组分(Fr-I和Fr-II)。Fr-I为12~28管,Fr-II为29~40管,对这两个组分的管数分别进行收集,透析袋透析,然后冷冻干燥,即得精制多糖。而且可以看出,蛋白质吸收峰在两个多糖吸收峰中都有,说明其精制多糖的两个组分均可能含有糖蛋白。
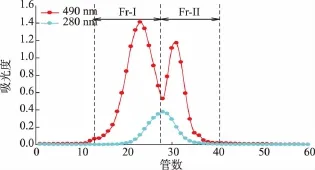
图1 杨树桑黄产EPS分离纯化结果Fig.1 Separation and purification of EPS from P.vaninii Ljup
2.2 杨树桑黄EPS的相对分子质量
以Kav值为横坐标,葡聚糖标准品系列的lgM值为纵坐标,绘得相对分子质量标准曲线,回归方程为y=-5.485 8x+6.537 9,相关性系数为R2=0.999 3。由标准曲线推算杨树桑黄EPS精制组分的相对分子质量,结果见图2。实验测得杨树桑黄EPS Fr-I和Fr-II的Ve分别为115、155 mL,根据标准曲线推算得杨树桑黄EPS Fr-I和Fr-II的相对分子质量分别为627 500和55 000。
2.3 杨树桑黄EPS的红外分析
杨树桑黄EPS Fr-I和Fr-II的红外光谱见图3。杨树桑黄EPS Fr-I在3 289.3 cm-1有宽展圆滑强吸收峰,为O-H伸缩振动,说明其以分子间氢键为主;2 927.4 cm-1处有较强吸收峰,是由多糖中甲基-CH3或次甲基-CH2的C-H的伸缩振动引起的,具有典型的多糖特征;在1 736.5 cm-1处有吸收峰,说明有酯基或O-乙酰基的存在;在1 642.9 cm-1处出现红外吸收峰,是N-H的变角振动,为氨基或酰胺基的结构[23];1 554.7 cm-1处为C=O伸缩振动;1 382.8 cm-1处的红外吸收峰为磺酰基-O-SO2-R的S=O非对称伸缩振动;1 129.8 cm-1处有红外吸收峰,为C-O-C环内醚的C-O伸缩振动;1 025.8 cm-1处的红外吸收峰为-OH的O-H变角振动;在974.0 cm-1处出现红外吸收峰,此处为吡喃环末端次甲基的横摇振动;912.1 cm-1处的红外吸收峰为α-吡喃糖的吸收峰;887.4 cm-1处的红外吸收峰为β-吡喃糖的吸收峰[24];810.5 cm-1处的红外吸收峰为甘露糖特征吸收峰[25]。由此推测杨树桑黄EPS Fr-I为α-和β-构型共存的吡喃型甘露糖苷酸性杂多糖[26]。其Fr-II图谱与Fr-I不同的是没有C-O-C环内醚的C-O伸缩振动,917.0 cm-1处的红外吸收峰为α-吡喃糖的吸收峰,推断其Fr-II为α-吡喃型甘露糖苷酸性杂多糖。

图2 杨树桑黄EPS精制组分的相对分子质量Fig.2 Relative molecular weight of refined EPS fractions from P.vaninii Ljup
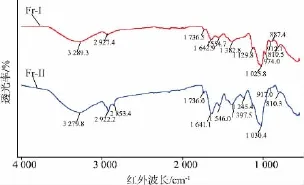
图3 杨树桑黄EPS精制组分的红外光谱图Fig.3 RT-IR spectra of refined EPS fractions from P.vaninii Ljup
2.4 杨树桑黄EPS单糖组分分析
将杨树桑黄EPS的各精制组分分别进行GC/MS检测,把各个组分的气相色谱图中每个峰的保留时间与标准单糖的保留时间进行比对。分别对杨树桑黄EPS精制组分的气相色谱图进行分析,结果见图4。
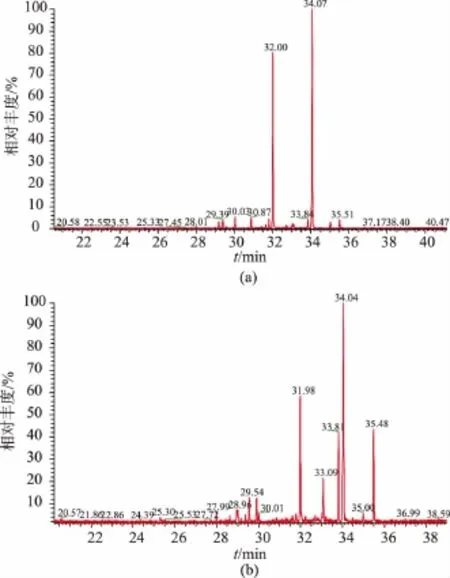
图4 杨树桑黄EPS精制组分气相色谱图Fig.4 GC of refined EPS fractions from P.vaninii Ljup
采用面积归一化法对杨树桑黄EPS单糖组分进行分析,结果见表1。其Fr-I和Fr-II所含单糖组分和质量分数分别为:核糖1.45%、1.92%,木糖2.52%、3.86%,葡萄糖醛酸40.31%、20.89%,半乳糖1.68%、7.09%,葡萄糖 1.90%、14.79%,甘露糖50.24%、36.15%,半乳糖醛酸 1.89%、15.32%,两个组分所含单糖组分的种类一样,质量分数有差异。杨树桑黄EPS各精制组分均含有葡萄糖醛酸和半乳糖醛酸,说明发酵所得的EPS可能为酸性多糖[26-27],与其红外光谱分析结果一致;其单糖组分中甘露糖的含量较多,与红外光谱中810 cm-1处出现的甘露糖特征吸收峰一致。
2.5 杨树桑黄EPS的SEC/MALLS分析
采用尺寸排阻色谱(SEC)、多角度激光光散射检测器(MALLS)和示差折光检测器(RI)联用技术,可检测杨树桑黄EPS精制组分的相对分子质量及其在水溶液中的分布情况,结果见表2。
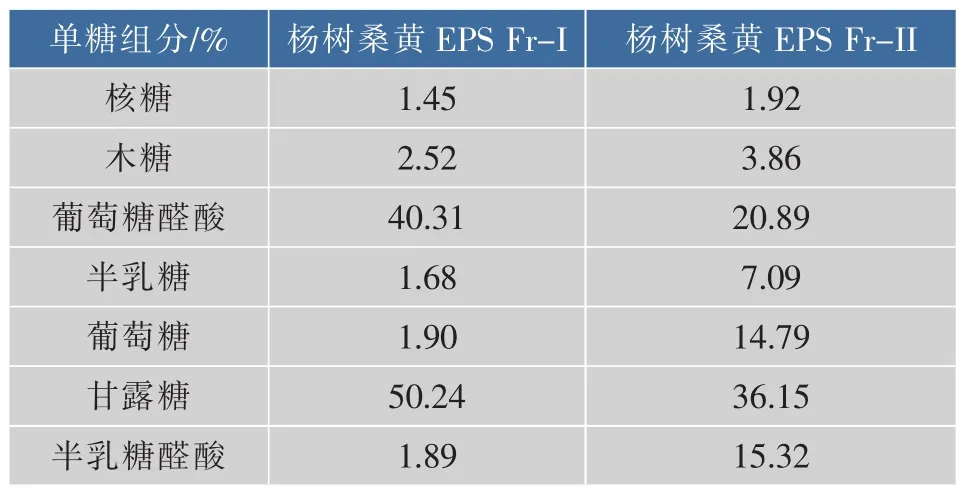
表1 杨树桑黄EPS单糖组分分析Table 1 Carbohydrate composition analysis of refined EPS fractions from P.vaninii Ljup质量分数/%

表2 杨树桑黄EPS精制组分SEC/MALLS测试结果Table 2 SEC/MALLS results of refined EPS fractions from P.vaninii Ljup
表 2 中 ,Mn、Mw、Mz、Mw/Mn、Rn、Rw和 Rz依 次 分别为数均相对分子质量、重均相对分子质量、平均相对分子质量、多分散系数、数学均方旋转半径、质量均方旋转半径和均方旋转半径的均值。
由表2数据可知,杨树桑黄EPS Fr-I和Fr-II的重均相对分子质量分别为4.746×106和2.469×105,Mw/Mn即多分散系数分别为1.537和 4.715,表明两个组分的分散性均很低,即在水溶液中很容易形成大量的聚集体,溶解度很小。杨树桑黄EPS Fr-I和Fr-II的均方根半径分别为 22.0、12.8 nm,Fr-I和Fr-II的均方根半径对相对分子质量的双对数曲线的斜率分别为0.10和0.16,说明其在水溶液中以球形构象存在,是一种高度紧密而且具有分支结构的多糖聚集体。通过SEC/MALLS测得杨树桑黄产EPS Fr-I和Fr-II的相对分子质量均大于凝胶过滤法测得的相对分子质量,这可能是因为精制多糖经过透析时多糖分子发生了聚集,溶解度降低所致。杨树桑黄产EPS精制组分Fr-I(左)和Fr-II(右)的均方根半径对相对分子质量的双对数曲线见图5。
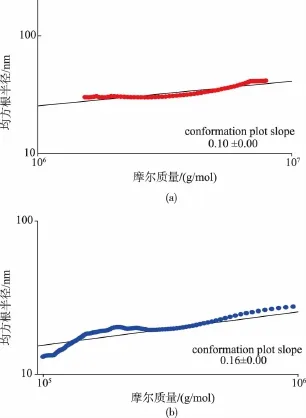
图5 杨树桑黄EPS精制组分均方根半径对相对分子质量的双对数曲线Fig.5 Double logarithmic curve of root mean square radiusvsmolecularweightforrefined EPS fractions from P.vaninii Ljup
2.6 杨树桑黄EPS的分子构象分析
杨树桑黄EPS分子构象的参数见表3。其中Mw和Rg值通过SEC-MALLS法测得,而Rh通过粘度法获得,根据 Einstein理论公式推算得。粘度由乌氏粘度计测定,它反映了在稀溶液中多糖所占的水的体积。通常认为,粘度越小,多糖越具有比较致密的构象[28]。由表3可知,实验测得杨树桑黄EPS Fr-I的粘度值较Fr-II小,说明其链未舒展开,结构较为致密。而且相对分子质量相对较大的EPS精制组分测得的粘度值相对较小,这可能是因为EPS发生了聚集,在水溶液中的溶解度不高,其构象呈高支化的多糖聚集体,该结果与SEC-MALLS中均方根半径对相对分子质量的双对数曲线斜率的分析结果一致。
k′值在0.3~0.5时,表明该溶液对聚合物是良溶剂。由表3可知,杨树桑黄EPS各精制组分的k′均大于0.5,说明其在水溶液中的溶解性较低。Rg和Rh的比值为ρ,ρ值可以用来描述多糖分子在水溶液中的链构象。ρ≈0.3时,为均一紧密的球形构象;ρ≈0.5时,为一个松散连接的超支化链或聚合物;ρ≈1时,为刚性杆状链。杨树桑黄EPS各精制组分的ρ值均接近于1,说明其EPS各精制组分在水溶液中可能为刚性链状的多糖聚集体。

表3 杨树桑黄EPS精制组分的分子构象参数Table 3 Molecular conformation parameters of refined EPS fractions from P.vaninii Ljup
2.7 杨树桑黄EPS的抗氧化活性分析
杨树桑黄EPS对·OH和·DPPH自由基的清除率见图6。当杨树桑黄EPS质量浓度为10 mg/mL时,其对·OH自由基的清除率高达38.58%,而当杨树桑黄EPS质量浓度为5 mg/mL时,其对·DPPH自由基的清除率已高达59.17%。其EPS对·DPPH自由基的清除率明显高于其对·OH自由基的清除率,表现出良好的抗氧化活性。

图6 杨树桑黄EPS精制组分对·OH和·DPPH自由基的清除率Fig.6 ·OH and·DPPH radical scavenging rate of refined EPS fractions from P.vaninii Ljup
3 结 语
研究表明,杨树桑黄EPS含有两个组分,Fr-I和Fr-II的相对分子质量分别为627 500和55 000。红外分析可知,其EPS具有明显的多糖特征吸收峰,其Fr-I为α-和β-构型共存的吡喃型甘露糖苷酸性杂多糖,其Fr-II为α-吡喃型甘露糖苷酸性杂多糖。杨树桑黄EPS Fr-I和Fr-II所含单糖组分和质量分数分别为:核糖1.45%、1.92%,木糖2.52%、3.86%,葡萄糖醛酸40.31%、20.89%,半乳糖1.68%、7.09%,葡萄糖1.90%、14.79%,甘露糖50.24%、36.15%,半乳糖醛酸1.89%、15.32%,两个组分所含单糖组分的种类一样,质量分数有所差异;其Fr-I和Fr-II均含有葡萄糖醛酸和半乳糖醛酸,说明发酵所得EPS可能为酸性多糖,与其红外光谱分析结果一致;其单糖组分中甘露糖的含量较多,与红外光谱中810 cm-1处出现的甘露糖特征吸收峰一致。SEC/MALLS结果表明,其EPS分散性很低,在水溶液中很容易形成大量的聚集体,溶解度很小,且在水溶液中以球形构象存在,是一种高度紧密而且具有分支结构的多糖聚集体。杨树桑黄EPS的分子构象参数结果表明,相对分子质量较大的EPS精制组分测得的粘度值相对较小,这可能是因为EPS发生了聚集,在水溶液中的溶解度不高,其构象呈高支化的多糖聚集体,该结果与SEC-MALLS中均方根半径对相对分子质量的双对数曲线斜率的分析结果一致;杨树桑黄EPS的ρ值接近于1,说明其EPS在水溶液中可能为高度分支的多糖聚集体。杨树桑黄EPS质量浓度为10 mg/mL时,对·OH自由基的清除率为38.58%,其质量浓度为5 mg/mL时,对·DPPH自由基的清除率高达59.17%,表现出良好的抗氧化活性。本研究结果为进一步研究杨树桑黄EPS的构效关系及其在医药、保健食品行业的应用奠定了基础。
