N-乙酰-D-葡萄糖胺-2-差向异构酶基因的克隆及表达
2018-11-06卢利平陈献忠周俊波杨海泉
卢利平 , 陈献忠 *, 周俊波 , 沈 微 , 杨海泉 , 樊 游
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;2.江南大学 生物工程学院,江苏 无锡214122)
唾液酸在自然界中分布广泛,已经发现很多生物体内都含有唾液酸[1]。N-乙酰-D-神经氨酸(Neu5Ac)是唾液酸家族中最主要成员,占整个唾液酸家族的99%以上,是合成其他唾液酸物质的生物前体物质[2]。Neu5Ac主要以α-糖苷的形式位于非还原性寡聚糖如糖蛋白和糖脂类的末端[3]。随着对Neu5Ac生理功能的研究进一步加深,其在食品、医药、疾病诊断等领域的应用也越来越广泛,Neu5Ac的生产受到越来越多的关注。传统的天然产物提取和化学合成方法受到原材料不足、反应过程复杂等诸多限制[4-7],酶催化法和全细胞催化法是非常具有工业应用潜力的Neu5Ac生产方法[8-10]。
酶法或全细胞合成N-乙酰神经氨酸的第一步是以N-乙酰-D-葡萄胺(GlcNAc)为底物通过N-乙酰-D-葡萄糖胺-2-差向异构酶(AGE)的作用异构化为N-乙酰甘露糖胺(ManNAc),接着N-乙酰甘露糖胺与丙酮酸在N-乙酰神经氨酸裂合酶的作用下缩合形成Neu5Ac。AGE是合成Neu5Ac的关键酶,对产物的合成效率起着决定性作用。Maru等[11]首次从猪的肾脏中分离纯化得到AGE,后通过cDNA克隆获得目的基因并实现了在大肠杆菌中的异源表达。双酶法制备Neu5Ac的方法需要添加ATP和MgCl2,通过固定化酶法也可以获得Neu5Ac,且酶可以循环利用[12-14]。大肠杆菌具有遗传操作容易、生长迅速等优点,常常作为细胞催化剂或表达宿主的优先选择,但是由于物种间的差异,表达蛋白质在大肠杆菌中的异源表达大部分形成包涵体,AGE酶活普遍都不高。有报道指出,在大肠杆菌表达鱼腥藻CH1AGE获得的AGE酶活性是猪源AGE的46倍以上,且仅需要极少量的ATP就能达到最大酶活性,用该全细胞催化生产Neu5Ac的产率也高于酶法生产[15]。
Tabata等从集胞藻染色体上克隆得到slr1975基因,并实现了在大肠杆菌中的初步表达[16]。然而,由于重组蛋白质的表达水平较低,纯化方法较为繁琐,从而导致重组蛋白质得率较低。作者通过克隆集胞藻AGE基因序列,在根据大肠杆菌密码子偏好性对目的基因全序列进行优化的基础上,选择带有T7强启动子的pET系列表达载体,实现在大肠杆菌BL21(DE3)中高效异源表达,并对其酶学性质进行了研究,从而为酶催化法生产N-乙酰神经氨酸进行了探索。
1 材料与方法
1.1 材料
菌株、质粒大肠杆菌Escherichia coliJM109与BL21(DE3)菌株以及所用表达载体pET28a质粒:江南大学中国高校工业微生物资源和信息中心提供;表达N-乙酰神经氨酸裂合酶(NanA)的重组大肠杆菌Escherichia coliBL21/pET28a-nanA:由作者所在实验室前期构建。
主要试剂限制性内切酶、T4 DNA连接酶、TaqDNA聚合酶及蛋白质相对分子质量marker:购自TaKaRa生物技术公司;质粒提取试剂盒、DNA纯化回收试剂盒和牛血清蛋白:购自北京博大泰克生物基因技术有限公司;卡那霉素与异丙基硫代半乳糖苷(IPTG):购自上海生工生物工程有限公司;GlcNAc、ManNAc以及Neu5Ac:购自上海西格玛公司;其他的分析纯级试剂:购自上海生物工程公司。
1.2 方法
培养基和培养条件大肠杆菌培养在LB培养基(胰蛋白胨10 g/L、酵母提取物5 g/L、NaCl 10 g/L),发酵培养基为TB培养基(胰蛋白胨12 g/L、酵母 提 取 物 24 g/L、 甘 油4 mL,KH2PO42.31 g/L,K2HPO412.54 g/L),1×105Pa灭菌 20 min。抗性筛选抗生素为卡那霉素(添加质量浓度为50 μg/mL)。
目的基因的克隆根据NCBI公布的集胞藻(Synechocystis sp.PCC 6803)AGE 编码基因 slr1975(GenBank ID:954945)序列,以及大肠杆菌密码子利用偏好性对该序列进行密码子分析、优化和人工合成。以优化后的DNA序列为模板设计一对引物,分 别 为 slrF:5’-CGCCATATGATGATGATTGCCCA TCGCCGTC-3’(下划线为NdeI酶切位点)和slrR:5’-CGGAATTCTTAAGAAACC GGCAGTTGCAGA-3’(下划线为EcoRI酶切位点),引物由上海生工生物工程技术服务部合成。PCR扩增参数:95℃变性5 min,然后 94℃变性 30 s,55℃退火 30 s,72℃延伸1.5 min,30个循环后16℃保温30 min,得到的目的基因命名为slr1975-co。
重组表达载体的构建将slr1975-co基因PCR产物与pET28a质粒同时用NdeI与EcoRI双酶切,纯化处理后用T4 DNA连接酶进行连接,16℃反应12 h,连接产物命名为pET28-slr,转化大肠杆菌BL21(DE3)感受态细胞,提质粒用相应的酶酶切鉴定。
AGE的诱导表达挑取重组菌单菌落接种于含有卡那霉素的20 mL液体LB培养基中,于37℃、200 r/min摇瓶培养过夜,次日以体积分数0.5%转接到50 mL含有卡那霉素的新鲜TB液体培养基中继续培养。37℃培养至600 nm吸光值(OD600)为0.6左右,加入500 μL母液浓度为100 mmol/L的IPTG(终浓度为1 mmol/L),转到28℃培养诱导4 h后,4℃、5 000 r/min离心10 min收集菌体[17]。
重组酶的分离纯化收集到的诱导细胞浓缩10倍,用pH 7.0的Tris-HCl缓冲液重悬后,超声波破碎处理,4℃、12 000 r/min离心10 min,取上清液得到粗酶液。将粗酶液经0.22 μm的微孔滤膜过滤后,上1 mL HisTrap FF亲和层析柱(Noveagen),蛋白质纯化系统采用AKTA全自动蛋白质分离纯化系统,先用上样缓冲液A液 (8×磷酸缓冲液,20 mmol/L的咪唑,pH 7.4)洗涤,最后用洗脱缓冲液B液(8×磷酸缓冲液,50 mmol/L 的咪唑,pH 7.4)洗脱,流速为0.5 mL/min。每管收集量1 mL,收集峰值部分为纯化酶[18]。
SDS-PAGE分析蛋白质相对分子质量以及蛋白质质量浓度的测定取10 μL点样,12%SDSPAGE电泳检测,考马斯亮蓝R250染色,用电子扫描系统分析蛋白质相对含量。以牛血清蛋白作为标准蛋白质,考马斯亮兰(Bradford法)测蛋白质质量浓度[19]。
重组酶酶活的测定以GlcNAc为底物,利用AGE转化生成ManNAc的酶促反应测定转化率确定该酶活性[20]。酶活测定反应体系:200 μL酶液加到 200 μL新配制的底物混合物 (500 mmol/L GlcNAc,2 mmol/L ATP, 含 终 浓 度 为 20 mmol/L MgCl2的 100 mmol/L Tris-HCl,pH 7.0) 中,37 ℃金属浴反应30 min,沸水浴煮5 min终止反应。4℃、12 000 r/min离心10 min去除变性蛋白质,上清液中的GlcNAc与ManNAc通过高效液相色谱法(HLPC)测定,检测使用Dionex Ultimate3000系统,色谱柱为Bio-Rad Aminex HPX-87H柱 (300 mm×7.8 mm)有机酸离子层析柱,检测器为示差检测器,流动相为10 mmol/L H2SO4,流速为0.5 mL/min,柱温65℃[15]。其中,一个酶活单位(U)为每分钟催化1 μmoL的GlcNAc转化生成ManNAc所需的酶量。
酶学性质分析及米氏常数(Km)的测定测定对GlcNAc、ManNAc的Km值时,分别以GlcNAc或者ManNAc为底物,在pH 6.0、42℃下,测定该酶对底物的反应速度[11,21]。按Lineweaver-Burk法作图。在pH 7.0条件下,将等量的底物混合物与酶液混合后置于不同温度下(25、30、37、40、42、45、50、55℃)进行酶促反应,反应时间均为30 min,以此确定该酶的最适温度。将适量的粗酶液分别在20、30、40 ℃保温不同时间(30、60、90 min)后,与底物混合物在37℃进行酶促反应测定重组酶活性来确定温度稳定性。
配制两种不同pH缓冲范围的缓冲液,0.5 mol/L磷酸缓冲液 (pH为5.0、6.0、7.0) 以及 0.5 mol/L Tris buffer缓冲液(pH 为 7.0、8.0、9.0、10.0),配制相对应的底物混合物与酶液混合,在37℃下进行酶促反应测定酶活,确定其最适反应pH。调节缓冲液pH 为 4.0、5.0、6.0、7.0、8.0、9.0, 用不同 pH 值 A 液回溶菌体破碎离心,取上清液得到不同pH的粗酶液。然后再调回到pH 7.0的酶液与pH 7.0底物混合物混匀,37℃反应30 min以确定其pH的稳定性。
调整底物混合物中不同浓度Mg2+,与粗酶液反应,测定不同浓度Mg2+对酶活性的影响;分别用Ca2+、Fe2+、Mn2+、Zn2+等不同金属离子代替 Mg2+加入到底物混合物中,以确定不同金属离子对酶活性的影响。
在确定AGE酶的最适反应温度和最适pH后,在该条件下以不同浓度的底物测定比酶活,采用Lineweaver-Burk双倒数作图法,计算AGE对GlcNAc/ManNA 的Km值[17]。
全细胞催化法合成将E.coli/pET28-nanA和E.coli/pET28-slr分别接种于250 mL的摇瓶,按照1.2.4方法诱导培养,离心收集细胞后用pH 7.5的0.1 mol/L Tris-HCl缓冲液洗涤2次,用相同的缓冲液重悬菌体(OD600为 20),30 ℃转化 24 h(3次平行)。转化底物为N-乙酰葡萄糖胺0.6 mol/L、丙酮酸1.2 mol/L、Triton X-100 1%,通过HPLC检测分析转化的底物、中间产物和终产物。
2 结与分析
2.1 重组质粒pET28-slr的构建
以合成的slr1975-co基因为模板,slrF与slrR为上下游引物PCR扩增得到带有NdeI与EcoRI酶切位点的目的基因片段,重组质粒pET28-slr酶切验证,见图 1(a),slr1975-co片段大小为 1 176 bp。载体构建流程,见图1(b),证明重组质粒pET28-slr已经构建成功并导入到大肠杆菌BL21(DE3)中。

图1 酶切产物电泳检测图和重组载体的构建流程图Fig.1 Electrophoresis detection of enzyme-digested product and construction of the recombinant plasmid
2.2 重组酶的诱导表达及纯化
将携带有pET28-slr质粒的重组大肠杆菌进行诱导表达,利用载体自身含有的His标签进行纯化,SDS-PAGE结果见图2。发酵上清液中不含目的蛋白质,粗酶液经纯化得到了单一条带的目的产物,其相对分子质量大小约为43 000,与预期蛋白质相对分子质量相符,而对照菌株没有相应的基因表达。结果表明,slr1975-co基因在大肠杆菌BL21(DE3)菌株中成功异源表达,纯化后的可溶性蛋白质质量浓度约为1.7 g/L。
2.3 诱导条件对产物表达量的影响
诱导时间对产物表达量的影响考察了诱
导时间对AGE重组蛋白质表达的影响。分别取诱导 2、4、6、8 h的培养液,离心收集菌体并破碎,取等量上清液进行SDS-PAGE分析,同时以携带pET28a质粒的重组大肠杆菌作为对照。由图3(a)可以看出,诱导时间与产物表达量关系密切,随着诱导培养时间的延长,产物表达量也随之增加。
诱导物浓度对产物表达量的影响进一步考察了不同浓度的IPTG对重组蛋白质表达的影响。由图 3(a)可以看出,IPTG 终浓度在 0~0.8 mmol/L范围内,重组酶表达量随IPTG浓度的增大而增加;IPTG终浓度为0.8 mmol/L时,重组酶表达量达到最大,而终浓度为1.0 mmol/L时表达量略有下降;未添加诱导物的菌体不表达重组酶。
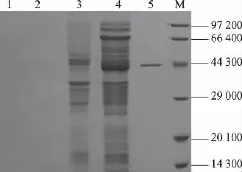
图2SDS-PAGE分析AGE重组蛋白质的表达Fig.2 SDS-PAGE analysis of the recombinant enzyme AGE expression

图3 不同诱导时间和诱导剂IPTG浓度对AGE重组蛋白质表达的影响Fig.3 Effects of induction time and IPTG concentrations on the AGE expression in E.coli BL21 (DE3)/pET28-slr
2.4 重组酶酶学性质研究
最适反应温度及温度稳定性考察了重组AGE的最适反应温度。结果见图4(a)。可以看出,在pH 7.0条件下,重组酶的最适反应温度为42℃;在25~42℃范围内重组酶活性随着反应温度升高而增加,当反应温度超过45℃时,酶活力迅速下降,在55℃相对酶活仅为62.5%。
适量的粗酶液分别在不同温度不同保温时间测定酶活力,结果见图4(b)。重组酶在低温(20℃)保温后反应稳定性最差,保温在30℃时稳定性最好,保温时间越长酶活性越低。
最适反应pH及pH的稳定性考察了pH对重组酶AGE的影响,结果见图5(a)。重组酶的最适反应pH为6.0,当pH超过6.0时酶活性开始下降,在pH 6.0~8.0范围内重组酶能够维持85%以上的酶活性,pH为10.0时相对酶活为75%,在pH 5.0条件下相对酶活只有72%。
重组酶AGE在不同pH缓冲体系的稳定性见图5(b)。在pH 6.0条件下重组酶保留活性最高;在pH 4.0~7.0范围内相对酶活性能够维持在80%以上并随pH升高而增加;当pH超过7.0时相对酶活迅速下降,pH为9.0时相对酶活仅为17%。由此可知重组酶在酸性条件下能够保持较高的酶活性,而在碱性条件下比较容易失活。
金属离子对酶活性的影响在胞外由AGE催化GlcNAc异构化生成ManNAc的反应中,需要外源添加ATP提供能量,也需要添加Mg2+作为ATP酶的激活剂。首先考察了不同浓度Mg2+对酶活性的影响,以不同浓度的MgCl2加入到底物混合物中,结果见图 6(a)。 Mg2+浓度在 0~10 mmol/L 范围内时重组酶活性随着Mg2+浓度升高而提高;当Mg2+浓度为15 mmol/L时重组酶活性最高,超过15 mmol/L时酶活开始下降。

图4 不同温度下反应重组酶的相对活性和重组酶温度稳定性的测定Fig.4 Optimal temperature and thermostability of the recombinant enzyme AGE

图5 不同pH下重组酶的相对活性和重组酶pH稳定性的测定Fig.5 Optimal pH of the recombinant enzyme AGE and pH stability of the recombinant enzyme AGE
进一步考察了不同金属离子对重组酶酶活性的影响,在底物混合物中加入15 mmol/L的金属离子溶液,结果见图 6(b)。 Zn2+、Mn2+对重组酶活性均有抑制作用,其中Zn2+的抑制作用最为明显;加入Fe2+后重组酶活性略有增加,而Mg2+和Ca2+对重组酶活性的促进作用不是很明显。

图6 不同Mg2+浓度对重组酶活性的影响和不同金属离子对重组酶活性的影响Fig.6 Effects of different Mg2+concentration on the recombinant enzyme activitiy and effects of different metal ion on the recombinant enzyme activities
最适反应条件下酶活测定在最适反应条件即42℃、pH 6.0下,以 N-乙酰-D-葡萄糖胺(GlcNAc)为底物经酶促反应测定粗酶液的比酶活为3.36 U/mg,纯化酶的比酶活为12.91 U/mg。
2.5 反应动力学的测定
Klermund等[17]研究表明,来自Anabaena variabilis ATCC 29413的AGE的Km/GlcNAc为16.3 mmol/L,Km/ManNAc为16.7 mmol/L。本研究分别以GlcNAc和ManNAc为底物,测定了该酶的反应动力学参数。结果表明,AGE对GlcNAc的Km值(39.0)低于对ManNAc(46.5),对 GlcNAc的催化效率 kcat/Km为 1.04×103L/(mol·s)高于对 ManNAc 的催化效率,其 kcat/Km为 0.84×103L/(mol·s)。 相比较而言,尽管该酶是可逆催化的,但本实验优化合成的slr975-co催化方向有利于向N-乙酰甘露糖胺合成方向进行的,这对于构建双酶法催化合成NeuAc的生物催化剂是有益的。
2.6 全细胞催化法合成NeuAc
分别收集诱导表达后的E.coli/pET28-nanA和E.coli/pET28-slr细胞,按照1∶3细胞量混合于催化缓冲液中,加入0.6 mol/L GlcNAc和1.2 mol/L丙酮酸作为底物,检测反应体系中底物和产物,结果如图7。由图7可以看出,重组细胞能够有效的将底物转化为产物NeuAc。48 h时产物浓度达最高,为0.26 mol/L,此时的转化率达到43.30%。随着反应继续进行,NeuAc浓度开始下降而中间产物ManNAc则相对维持在较高水平。由此可见,重组酶的特性决定了在本反应体系中底物浓度和中间产物以及产物浓度达到相对平衡时,剩余了较多的底物和中间产物,从而导致转化效率低于50%。其他研究者在进行全细胞催化合成NeuAc时也出现相似的结果[10]。因此,通过蛋白质工程等手段改进酶的反应动力学特性,优化反应条件从而提高由GlcNAc向NeuAc合成速率是我们接下来要做的工作。

图7 全细胞催化法合成NeuAc的过程曲线Fig.7 Time course of NeuAc production and substrate consumption
3 结 语
根据集胞藻PCC6803来源的N-乙酰-D-葡萄糖胺-2-差向异构酶基因(slr1975)序列,经密码子分析和优化合成slr1975-co基因序列,测序成功后构建重组质粒进行诱导表达和蛋白质纯化,纯化产物SDS-PAGE分析结果显示为大小约43 000的单一条带。
重组AGE的最适反应温度为42℃,最适反应pH为6.0,在pH为4.0~7.0范围内保温30 min后能保留85%以上的酶活性,在碱性条件下较容易失活;由于物种间的差异,这与鱼腥草7120 AGE温度为40℃,最适pH为8.0时酶活最高,且碱性条件下活性较好的报道有一定差别[22]。此外,在进行不同金属离子对酶活性影响的实验,都采用Mg2+作为ATP的激活剂,但结果显示Fe2+对重组酶催化活性也有一定的促进作用。本研究中用考马斯亮蓝染色法测定蛋白质质量浓度为1.7 g/L,这是由于携带重组质粒的菌株诱导表达后需要经过超声破碎和过滤才能得到粗产物,在这一过程中重组酶丢失较严重;冷冻保存之后的产物再用于酶促反应,在冻融过程中重组酶活性进一步损失,固定化酶法生产N-乙酰神经氨酸可以循环利用酶[23]。
Neu5Ac是唾液酸(Sialic acid)家族中最重要的成员,其家族99%以上都是由Neu5Ac组成[24-25]。AGE酶可以高效催化N-乙酰-D-葡萄糖胺为底物得到N-乙酰神经氨酸。全细胞催化法合成Neu5Ac既减少了酶纯化的繁琐步骤也降低了生产成本,已成为研究热点。本研究实现了AGE在大肠杆菌中高效表达,为全细胞催化法高效合成N-乙酰-D-神经氨酸奠定了坚实的基础。
