代谢工程改造毕赤酵母生产葡萄糖二酸
2018-11-06堵国成华兆哲
刘 叶 , 巩 旭 , 康 振 , 堵国成 , 陈 坚 , 华兆哲 *
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;2.江南大学 生物工程学院,江苏 无锡214122)
葡萄糖二酸(Glucaric acid)是一种自然界存在的高附加值有机酸,在十字花科蔬菜、樱桃和柑橘类水果中含量丰富,少量存在于包括人在内的哺乳动物中[1]。葡萄糖二酸及其衍生物具有广泛的应用价值,它可以降低胆固醇[1]、治疗糖尿病[2]、预防癌症[3]等,同时,在合成生物可降解的聚合物、羟基化尼龙等新型材料方面也有大量的应用[4-5],曾被美国能源部确定为“最具价值的生物炼制产品”之一[6]。
目前,葡萄糖二酸的制备方法主要为化学法,如硝酸氧化、 以 2,2,6,6-四甲基哌啶氧化物(TEMPO)为催化剂的共催化氧化等[7]。此方法投入高、得率低,同时产生的废气废液对环境造成一定的污染。由于化学法存在的局限性,生物法制备葡萄糖二酸越来越受到研究者的关注。葡萄糖二酸与抗坏血酸是哺乳动物中葡萄糖醛酸代谢途径的终产物,然而,从葡萄糖到葡萄糖二酸,至少需要10步反应[8]。Prather等通过在大肠杆菌中异源表达酿酒酵母(Saccharomyces cerevisiae)来源的肌醇-1-磷酸合成酶基因(Ino1)、小鼠来源的肌醇氧化酶基因(MIOX)以及丁香假单胞菌(Pseudomonas syringae)来源的醛酸脱氢酶基因(udh),成功构建葡萄糖二酸合成途径,实现了葡萄糖二酸的生物合成[9-11]。通过优化途径、提高MIOX的稳定性及前体物质肌醇的转运能力,在补加肌醇的条件下,葡萄糖二酸的产量达到了4.85 g/L。但是,大肠杆菌耐酸能力弱,易受噬菌体感染,并具有潜在的致病性,因此在工业上难以推广应用。
毕赤酵母是一种单细胞真核生物,具有营养要求低、生长快、培养基廉价、可进行高密度发酵等优点[12]。相比大肠杆菌,毕赤酵母具有真核生物表达时对蛋白质的加工和修饰等功能[13],同时,毕赤酵母耐酸能力较强(pH 3~7)[14],因此是一种可用于生产功能性有机酸的优良宿主。
在本研究中,我们通过异源表达小鼠来源的MIOX基因及Pseudomonas putidaKT2440来源的udh基因,成功在毕赤酵母内构建了葡萄糖二酸合成途径,通过对碳源、初始pH、接种龄及接种量进行摇瓶水平的优化,进一步提高了葡萄糖二酸的产量。最后,我们按照摇瓶优化的条件,对重组菌在3 L发酵罐上进行了补料分批培养的研究。
1 材料与方法
1.1 材料
1.1.1 菌种和质粒Pichia pastorisGS115:本研究中代谢工程改造的宿主菌株;Pseudomonas putidaKT2440:用于 udh基因的克隆;Escherichia coliJM109、E.coliTOP10:用于构建质粒的宿主菌;质粒pUC57-mM:含小鼠来源的MIOX基因,由南京金斯瑞生物科技有限公司合成,并按照毕赤酵母密码子偏好性进行了优化;质粒pPIC9K、pGAPZB:用于重组质粒的构建。
1.1.2 培养基LB培养基(g/L):胰蛋白胨10,酵母粉 5,NaCl 10。制备固体培养基时添加2%的琼脂。
YPD 培养基(g/L):蛋白胨 20,酵母粉 10,葡萄糖20。
YPDM 培养基(g/L):蛋白胨 20,酵母粉 10,葡萄糖 20,肌醇 10。
YPDS 培养基(g/L):蛋白胨 20,酵母粉 10,葡萄糖 20,山梨醇 182.2。
MD 固体培养基(g/L):葡萄糖 20,YNB 13.4,生物素 4×10-4,琼脂 20。
改良 BSM 培养基 (g/L):85%磷酸 26.7 mL,CaSO40.93,K2SO418.2,MgSO47.275,KOH 4.125,PTM1离子液4.35 mL,葡萄糖60,肌醇13。
PTM1 离子液 (g/L):CuSO4·5H2O 6,KI 0.08,MnSO4·H2O 3,H3BO30.02,MoNa2O4·H2O 0.2,CoCl20.5,ZnCl220,FeSO4·7H2O 65,生物素 0.2;浓 H2SO45.0 mL。
1.1.3 酶、引物、DNA Marker及相关试剂盒Primer STAR DNA聚合酶,DNA Marker,T4 DNA连接酶,大肠杆菌感受态制备试剂盒:购自TaKaRa(大连);各种限制性内切酶:购自Thermo公司;PCR引物(见表1):由上海生工生物有限公司合成;质粒小量抽提试剂盒、细菌总DNA提取试剂盒:购自上海生工生物有限公司;酵母基因组提取试剂盒:购自天根生化科技(北京)有限公司;葡萄糖二酸钾色谱级标准品:购自Sigma-Aldrich公司。
1.2 方法
1.2.1 重组表达载体的构建以pGAPZB质粒为模板,TU-1-F、TU-1-R为引物扩增毕赤酵母组成型启动子TEF,同时以恶臭假单胞菌 (P.putidaKT2440)基因组为模板,TU-2-F、TU-2-R为引物扩增udh基因。使用融合PCR方法,将TEF启动子与udh基因融合。使用限制性内切酶SacI和NotI对得到的融合片段双酶切,连接至具有相应切口的表达载体pPIC9K上,转化至E.coliJM109中,在确保阅读框正确的前提下鉴定出重组表达质粒pPIC9KTEF-U,经DNA测序比对,重组序列正确。以pUC57-mM质粒为模板,mM-F、mM-R为引物扩增小鼠来源的MIOX基因,使用XhoI和XbaI连接至具有相应切口的表达载体pGAPZB上,转化E.coliTOP10中,在确保阅读框正确的前提下,鉴定出重组表达质粒pGAPZB-M,经测序比对,序列正确。

表1 本文所用的引物Table 1 Primers used in this study
1.2.2 毕赤酵母转化方法及转化子筛选将质粒pPIC9KTEF-U经SalI线性化之后,采用电转化方式转化至P.pastorisGS115感受态细胞中,在MD培养基中进行筛选,30℃恒温倒置培养3~4 d。挑选MD平板上生长良好的单菌落分别接种至含有1.0、2.0、3.0、4.0 mg/mL G418的YPD平板中,筛选抗高质量浓度G418(4.0 mg/mL)的重组毕赤酵母,以重组子基因组DNA为模板进行PCR验证,获得重组菌株。将质粒pGAPZB-M经BspHI线性化,转化上述重组菌感受态中,涂布于含100 μg/mL博莱霉素的YPDS平板上,30℃恒温倒置培养3~4 d。挑选生长良好的单菌落接种至分别含有500、1 000、1 500、2 000 μg/mL博莱霉素的YPDS平板上,筛选抗高浓度博莱霉素(2 000 μg/mL)的重组子,以重组子基因组DNA为模板进行PCR验证,获得重组菌株。
1.2.3 重组毕赤酵母菌株培养条件
1)摇瓶培养:将重组菌单菌落接种至25 mL(摇瓶容量为250 mL)种子培养基YPD中,30℃、220 r/min培养24 h,将种子培养液按10%接种体积分数转接至50 mL(摇瓶容量为500 mL)的发酵培养基YPDM中发酵,培养60 h。
2)3 L发酵罐培养:将重组菌单菌落接种至50 mL(摇瓶容量为 500 mL)YPD 培养基中,30℃、220 r/min培养24 h,将种子培养液按25%的接种体积分数转接至含1 L改良BSM发酵培养基的3 L发酵罐中。使用80%氨水控制pH为5.5,温度30℃,搅拌转速为800 r/min,通气量为4 vvm。当发酵液中葡萄糖质量浓度低于5 g/L时,流加葡萄糖维持质量浓度在0~5 g/L之间。
1.2.4 葡萄糖二酸的检测
1)定性检测:发酵结束后,取1 mL发酵液在12 000 r/min下离心5 min,取上清液经0.22 μm滤膜过滤,用于岛津离子阱飞行时间质谱仪(LCMSIT-TOF)分析[15]。流动相:A:1 mmol/L 甲酸铵+0.01%甲酸+水;B:1 mmol/L 甲酸铵+乙腈;洗脱程序:0~12 min 30%B;12~30 min 30%~65%B;30~31 min 65%~95%B;31~35 min 95%B;35~36 min 95%~30%B;36~40 min 30%B; 色谱柱:Shim-pack VPODS(150 L×2.0);流速:0.15 mL/min 进样量:5 μL;离子化模式:电喷雾负离子模式;雾化气流速:1.5 L/min;CDL温度:200℃,HB 温度:200℃;扫描范围:MS1,m/z:150~300。
2)定量检测:取样品发酵液上清液,经Affi-Gel凝胶处理[16]后,用高效液相色谱仪(HPLC)分析。流动相:5 mmol/L稀硫酸;色谱柱:Aminex HPX-87H;流速 0.5 mL/min;柱温:55 ℃;进样量:10 μL;检测器:UV(检测波长:210 nm)。
1.2.5 MIOX及Udh的活性测定发酵结束后,将发酵液在12 000 r/min、4℃下离心5 min,弃上清液。将菌体用Tris-HCl缓冲液(10 mmol/L,pH 8.0)清洗两遍后,重悬在清洗缓冲液中。在重悬菌体加入1.0 mm硅珠,采用FastPrep-24均质破碎仪破碎,破壁后离心,上清液用来检测途径酶活性。MIOX及Udh的活性检测方法见文献[10]。
MIOX单位酶活定义:1 min内生成1 nmol/L醛酸所需要的酶量;Udh单位酶活定义:1 min内生成1 μmol/L NADH所需要的酶量。
2 结果与讨论
2.1 重组表达载体的鉴定及重组菌的构建
将重组表达质粒pPIC9KTEF-U用SacI和NotI双酶切,得到约8.3 kb与1.2 kb的两条可见特异性DNA条带,见图1(a),分别对应于切除AOX启动子的线性化pPIC9K和融合片段TEF-Udh。重组表达质粒pGAPZB-M经XhoI、XbaI双酶切,得到约2.9 kb与 858 bp的两条可见特异性DNA条带,见图1(b),分别对应于线性化的pGAPZB和目的基因MIOX。上述结果表明,重组表达质粒pPIC9KTEF-U及pGAPZB-M均构建成功。
将重组质粒pPIC9KTEF-U采用电转的方式转化P.pastorisGS115感受态细胞中,获得重组菌,命名为P.pastorisGS115-TU,进一步将重组质粒pGAPZB-M转化P.pastorisGS115-TU感受态细胞中,获得相应的重组菌,命名为P.pastorisGS115-TUM。

图1 双酶切验证重组质粒Fig.1 Confirmation of recombinant plasmids by digestion
2.2 重组毕赤酵母发酵生产葡萄糖二酸
将重组菌P.pastorisGS115-TUM及对照菌P.pastorisGS115在摇瓶中培养60 h后,取1 mL上清液进行LCMS-IT-TOF质谱分析,结果见图2。在P.pastorisGS115-TUM发酵上清液中成功检测到葡萄糖二酸(m/z=209),而对照菌P.pastorisGS115并未检测到葡萄糖二酸。该结果表明,通过引入MIOX基因及udh基因,在重组菌P.pastorisGS115-TUM中已成功实现葡萄糖二酸的合成,而原始菌株并不具有生成葡萄糖二酸的能力。为了进一步分析途经,我们对途经酶MIOX及Udh的活性进行了检测,结果见图3。MIOX并未检测到明显的活性,推测原因为表达量较低或不稳定,但Udh酶活性较高,后面的研究工作将进一步分析并提高MIOX的活性。
经高效液相色谱(HPLC)定量检测,重组菌P.pastorisGS115-TUM在500 mL三角摇瓶中培养60 h 后,葡萄糖二酸产量为(566.36±16.98)mg/L。

图2 发酵液中葡萄糖二酸的质谱检测Fig.2 Mass spectrum of glucaric acid in the culture supernatant

图3MIOX及Udh酶活性检测Fig.3 Specific activities of MIOX and Udh
2.3 摇瓶水平优化培养条件提高葡萄糖二酸产量
2.3.1 不同碳源对葡萄糖二酸产量的影响选择甘油和葡萄糖作为碳源,分别以不同初始质量浓度(20、40、60、80、100 g/L)在 500 mL 摇瓶中培养重组菌P.pastorisGS115-TUM,结果见图4。不同的碳源对菌体细胞生长及葡萄糖二酸的产量影响较大,与底物甘油相比,虽然以葡萄糖为碳源获得的菌体量较低,但是葡萄糖二酸产量明显高于甘油。由图4可以看出,初始葡萄糖质量浓度为60 g/L时葡萄糖二酸产量最高,为(830.08±32.60) mg/L,因此选择葡萄糖作为后期培养的碳源。

图4 碳源对菌体生长及产量的影响Fig.4 Effect of carbon sources on recombinant strain and glucaric acid production
2.3.2 不同初始pH对葡萄糖二酸产量的影响配制 初 始 pH 分 别 为 4.0、4.5、5.0、5.5、6.0、6.5 的YPDM发酵培养基,初始葡萄糖质量浓度为60 g/L,将培养24 h的种子培养液以10%的接种体积分数转接到发酵培养基中,培养60 h,结果见图5。不同初始pH对菌体量影响不大。pH值为4.0~5.5时,葡萄糖二酸的产量逐渐增大;当pH大于5.5时,葡萄糖二酸产量略有下降。因此,选择培养基最适初始pH为5.5。

图5 初始pH对菌体生长及产量的影响Fig.5 Effect of initial pH on recombinant strain and glucaric acid production
2.3.3 不同接种龄对葡萄糖二酸产量的影响分别取培养 12、16、20、24、28、32 h 的种子培养液以10%的接种体积分数转接到初始pH为5.5的发酵培养基中,发酵培养60 h,见图6。在24 h之前,随着接种龄的增加,葡萄糖二酸产量及菌体量逐渐增加,在24 h之后,菌体量变化不大,但是葡萄糖二酸产量有所下降。因此,选择最适接种龄为24 h。
2.3.4 不同接种体积分数对葡萄糖二酸产量的影响取培养24 h的种子培养液分别以5%、10%、15%、20%、25%、30%的接种体积分数转接至初始pH为5.5的发酵培养基中,发酵培养60 h,见图7。在5%~25%范围内,菌体量、葡萄糖二酸产量与接种体积分数成正相关关系;当大于25%时,菌体量、葡萄糖二酸产量均略有下降。因此,最优接种体积分数确定为25%。

图6 接种龄对菌体生长及产量的影响Fig.6 Effect of seed time on recombinant strain and glucaric acid production

图7 接种体积分数对菌体生长及产量的影响Fig.7 Effect of inoculation amount on recombinant strain and glucaric acid production
2.3.5 不同初始肌醇质量浓度对葡萄糖二酸产量的影响配制初始肌醇质量浓度分别为2、4、6、8、10 g/L和12 g/L的发酵培养基,初始葡萄糖质量浓度60 g/L,初始pH为5.5,将培养24 h的种子培养液以25%的接种体积分数转接到发酵培养基中,培养60 h,见图8。不同初始肌醇质量浓度对菌体量的影响不大。在肌醇质量浓度2~10 g/L范围内,葡萄糖二酸产量随初始肌醇质量浓度的增加而增加,当大于10 g/L时,葡萄糖二酸产量则趋于平稳。因此,初始肌醇质量浓度确定为10 g/L。
通过对碳源、初始pH、接种龄、接种体积分数及初始肌醇质量浓度摇瓶水平的优化,葡萄糖二酸的产量达到了(967.60±3.90)mg/L,相比优化前的产量(566.36±16.98) mg/L,提高了 70.85%。
2.4 发酵罐补料分批培养的研究
依据摇瓶优化的结果,将重组菌P.pastoris GS115-TUM在3 L发酵罐中进行放大实验。以改良BSM为发酵培养基,初始葡萄糖质量浓度60 g/L,肌醇质量浓度13 g/L。发酵培养过程中,为保证碳源的充足,实现菌体高密度培养,当残糖质量浓度低于5 g/L时,流加800 g/L葡萄糖母液 (含12 mL/L PTM1),维持残糖质量浓度在0~5 g/L之间,结果见图9。葡萄糖二酸的生成与菌体的生长呈正相关关系,因此可以判断为生长偶联型。在发酵60 h之前,肌醇的质量浓度下降明显,此时葡萄糖二酸快速积累。发酵60 h之后,肌醇的质量浓度不再有明显下降,而葡萄糖二酸的产量也趋于稳定。由此可以看出,培养基中添加肌醇有助于葡萄糖二酸的生成,且葡萄糖二酸的积累与肌醇的消耗成正相关关系。发酵培养96 h后,葡萄糖二酸的产量达到了(2.60±0.04) g/L。

图8 初始肌醇质量浓度对菌体生长及产量的影响Fig.8 Effect of initial concentration of myo-inositol on recombinant strain and glucaric acid production
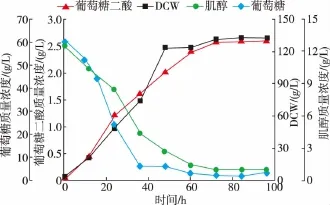
图9 重组菌3 L发酵罐补料分批发酵过程曲线Fig.9 Fed-batch fermentation of recombinant strain in a3 L fermenter
3 结语
葡萄糖二酸作为一种自然界存在的高附加值有机酸,具有重要的生物功能。作者通过在毕赤酵母内异源表达小鼠来源的MIOX基因及Pseudomonas putida KT2440来源的udh基因,成功构建葡萄糖二酸合成途径,在添加肌醇的摇瓶培养基中,葡萄糖二酸产量为(566.36±16.98) mg/L。通过对碳源、初始pH、接种龄及接种体积分数的优化,葡萄糖二酸产量达到(967.60±3.90)mg/L。按照摇瓶优化的条件,我们将重组菌在3 L发酵罐上进行补料分批培养,在补加葡萄糖及肌醇的情况下,葡萄糖二酸的产量达到(2.60±0.04) g/L。
本研究提出的重组毕赤酵母生产葡萄糖二酸的方法,具有广阔的发展前景,为生物法合成葡萄糖二酸提供了新的思路。今后工作将通过对毕赤酵母内葡萄糖二酸代谢途径进行分子层面的改造及优化,以期进一步提高葡萄糖二酸的产量。
