2个养殖水温下罗非鱼食后肠道消化酶活性的动态变化
2018-11-01翁祖桐
翁祖桐
(福建省水产技术推广总站,福建 福州 350002)
消化酶是一类参与食物营养消化吸收的蛋白质,其活性高低直接影响了鱼类对营养的吸收利用程度,进而影响其生长发育[1]。相关研究表明,鱼类摄食后消化酶活性呈现动态变化的过程[2-3]。此外,消化酶活性还受温度、盐度、pH等环境因素的影响[4-7]。水温作为最重要的环境因素之一,在消化酶活性变化过程中起到重要作用[8]。银鲫(Carassiusgibelio)肠道蛋白酶、淀粉酶、脂肪酶活性分别在28℃、24℃、28℃达到最高值[9];当温度为16~28℃时,条石鲷(Oplegnathusfasciatus)幼鱼的脂肪酶和蛋白酶活性较高、 淀粉酶活性较低[7];星斑川鲽(Platichthysstellatus)胃蛋白酶活性的最适温度为40℃,肠蛋白酶活性的最适温度为45℃,肝胰腺蛋白酶活性的最适温度为45℃[10]。
罗非鱼是福建省主要的淡水水产养殖品种之一。针对罗非鱼的消化酶活性,黎军胜等[11]探究了饲料成分与环境温度对罗非鱼消化酶活性的影响,发现在水温17~32℃时,胃、肝胰脏、肠道的蛋白酶、淀粉酶、脂肪酶活性均随温度的升高而提高。由于罗非鱼无乳链球菌病发病初始养殖水温为26℃[12]和发病高峰期开始养殖水温为30℃[13],因此本实验选择在这2个水温养殖下的罗非鱼空腹一次性投喂后,研究其肠道胰蛋白酶、淀粉酶、脂肪酶的活性动态变化,旨在为罗非鱼口服疫苗饲料的选择、饲料配方的设计提供基础数据。
1 材料与方法
1.1 试验鱼
“新吉富”罗非鱼由福建省淡水水产研究所榕桥中试基地提供,连续充气,每日投饵1次,投饵量为鱼体质量的5%,每天换水1次,于0.6 m3体积水族箱内暂养一周后使用。
1.2 主要试剂
胰蛋白酶测定试剂盒、淀粉酶测定试剂盒、脂肪酶测定试剂盒购自南京建成生物工程研究所。
1.3 试验设计
随机挑选健康的“新吉富”罗非鱼100尾,体重为67.15~100.65 g,体长为16.34~19.05 cm,平均分为2组,分别设置试验养殖水温为26℃和30℃,暂养1周,于试验前停止投喂3 d。
1.4 样品制备
停止投喂3 d后,取样前按罗非鱼鱼体质量的5%投喂基础饲料1次,在投喂后0、1、3、6、12、24、30、36、48、56、96 h共 11个时间点各取试验鱼3尾,迅速敲击鱼头部致其死亡,在冰盘上解剖,取出肠道,去除内容物,以冷蒸馏水冲洗内壁后,等分为三段[14](前、中、后肠),滤纸吸干,分别称重。加入9倍体积(V/W)0.85%生理盐水,用匀浆器冰浴匀浆,4℃、2 500 r·min-1离心10 min,取上清液,4℃冰箱保存待测。
1.5 胰蛋白酶活性测定
采用紫外比色法进行罗非鱼肠道各段胰蛋白酶活性测定,具体方法和计算方式参见胰蛋白酶测定试剂盒说明书。
胰蛋白酶活性(U/mgprot)定义:在37℃条件下,每毫克组织蛋白每分钟催化使吸光度变化0.003定义为一个酶活性单位。
1.6 淀粉酶活性测定
采用碘-淀粉比色法进行罗非鱼肠道各段淀粉酶活性测定,具体方法和计算方式参见淀粉酶测定试剂盒说明书。
淀粉酶活性(U/mgprot)定义:在37℃条件下,每毫克组织蛋白与底物作用30 min,水解10 mg淀粉定义为一个酶活性单位。
1.7 脂肪酶活性测定
采用比色法进行罗非鱼肠道各段脂肪酶活性测定,具体方法和计算方式参见脂肪酶测定试剂盒说明书。
脂肪酶活性(U/gprot)定义:在37℃条件下,每克组织蛋白在其反应体系中与底物反应1 min,每消耗1 μmol底物定义为一个酶活性单位。
1.8 数据处理与分析
2 结果与分析
2.1 胰蛋白酶活性
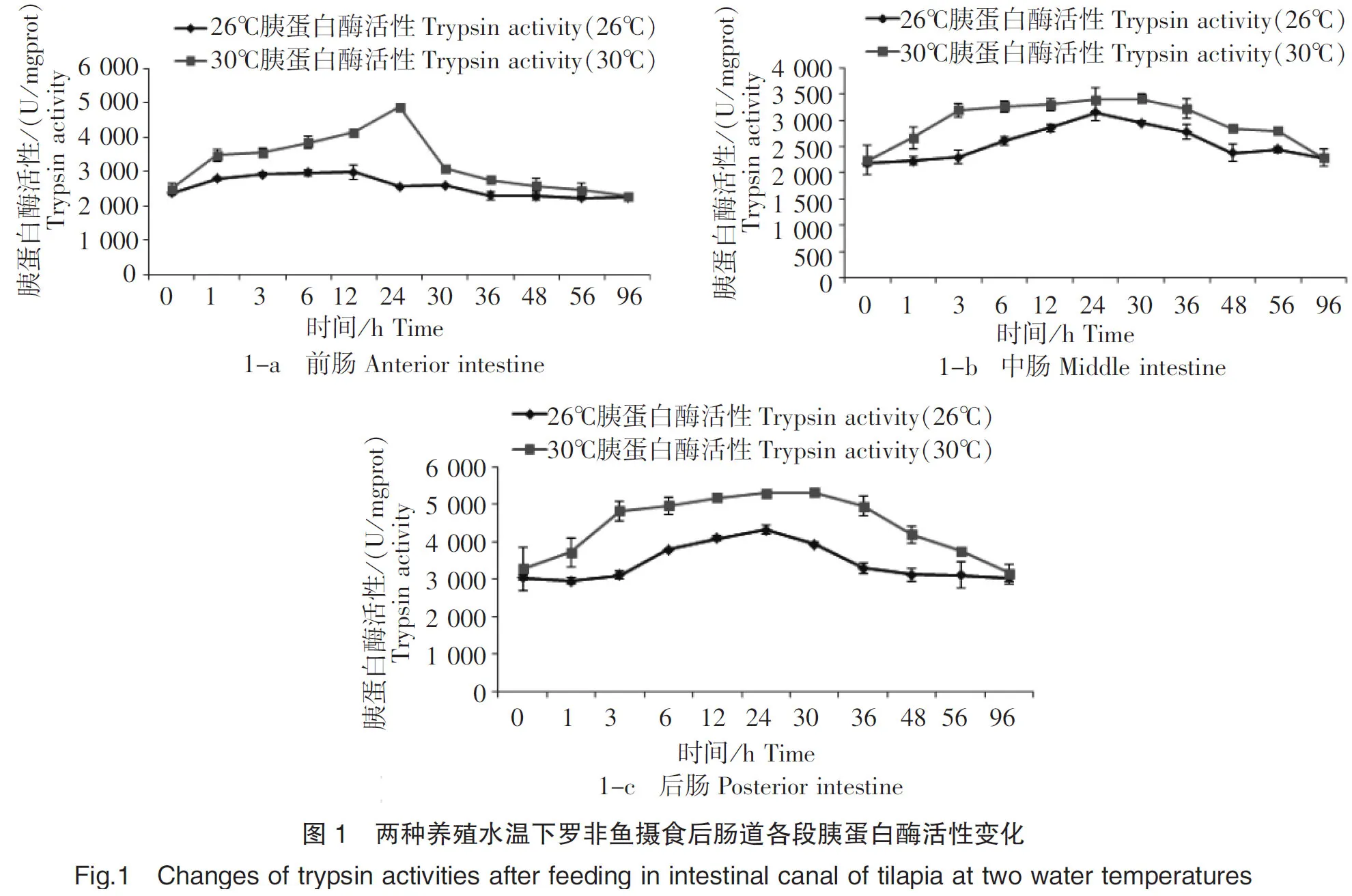
在26℃和30℃养殖水温下摄食后,罗非鱼前、中、后肠的胰蛋白酶活性基本呈现先上升后下降的趋势(图1-a、1-b、1-c)。在26℃养殖水温下,前、中、后肠胰蛋白酶活性分别从摄食后0 h、3 h和3 h开始升高,分别在12 h、24 h和24 h达到最高值,活性值分别为2 989.03 U/mgprot、3 148.62 U/mgprot和4 324.69 U/mgprot,分别是初始酶活性值的1.25倍、1.45倍和1.42倍;在30℃养殖水温下,前、中、后肠胰蛋白酶活性分别从摄食后0 h、0 h和0 h开始升高,分别在24 h、30 h和30 h达到最高值,活性值分别为4 891.47 U/mgprot、3 410.79 U/mgprot和5 329.96 U/mgprot,分别是初始酶活性值的1.96倍、1.52倍和1.63倍。30℃养殖水温下的肠道各段胰蛋白酶活性在1~48 h时均大于2 581.22 U/mgprot,而26℃养殖水温下的肠道各段胰蛋白酶活性仅在6~30 h时均大于2 558.94 U/mgprot。30℃养殖水温下的肠道各段胰蛋白酶活性最高值高于26℃养殖水温,除中肠差异不显著(P>0.05)外,其余各段均差异显著(P<0.05)。在肠道各段中,26℃水温下的胰蛋白酶活性大小依次为后肠>中肠>前肠,30℃水温下的胰蛋白酶活性大小依次为后肠>前肠>中肠。
2.2 淀粉酶活性
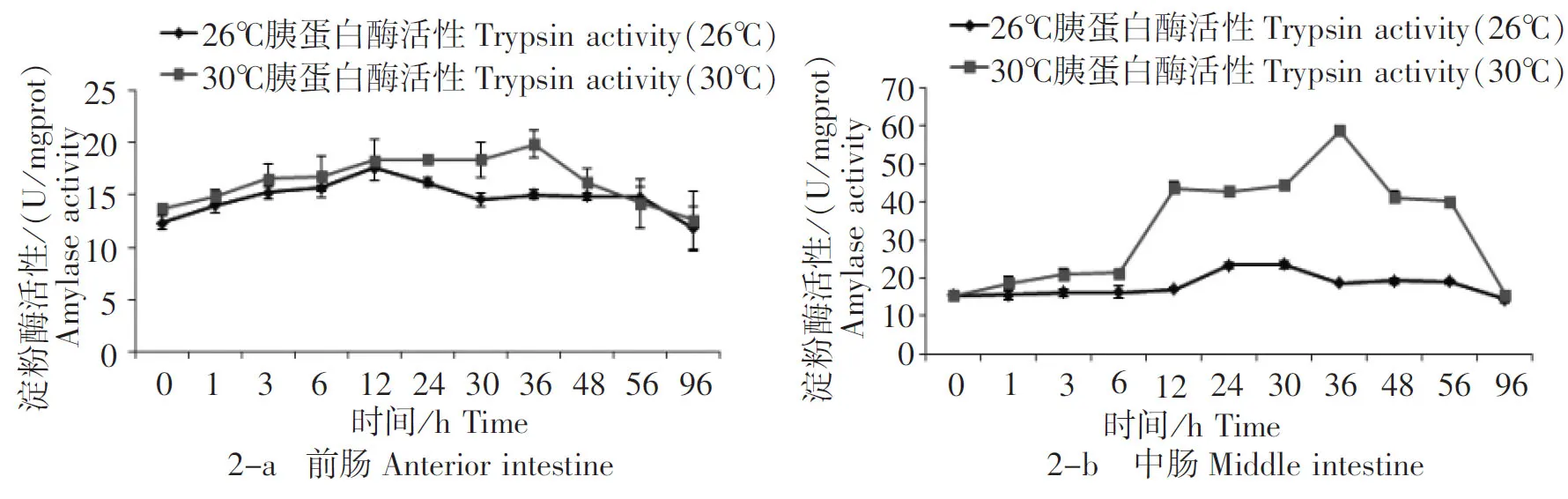
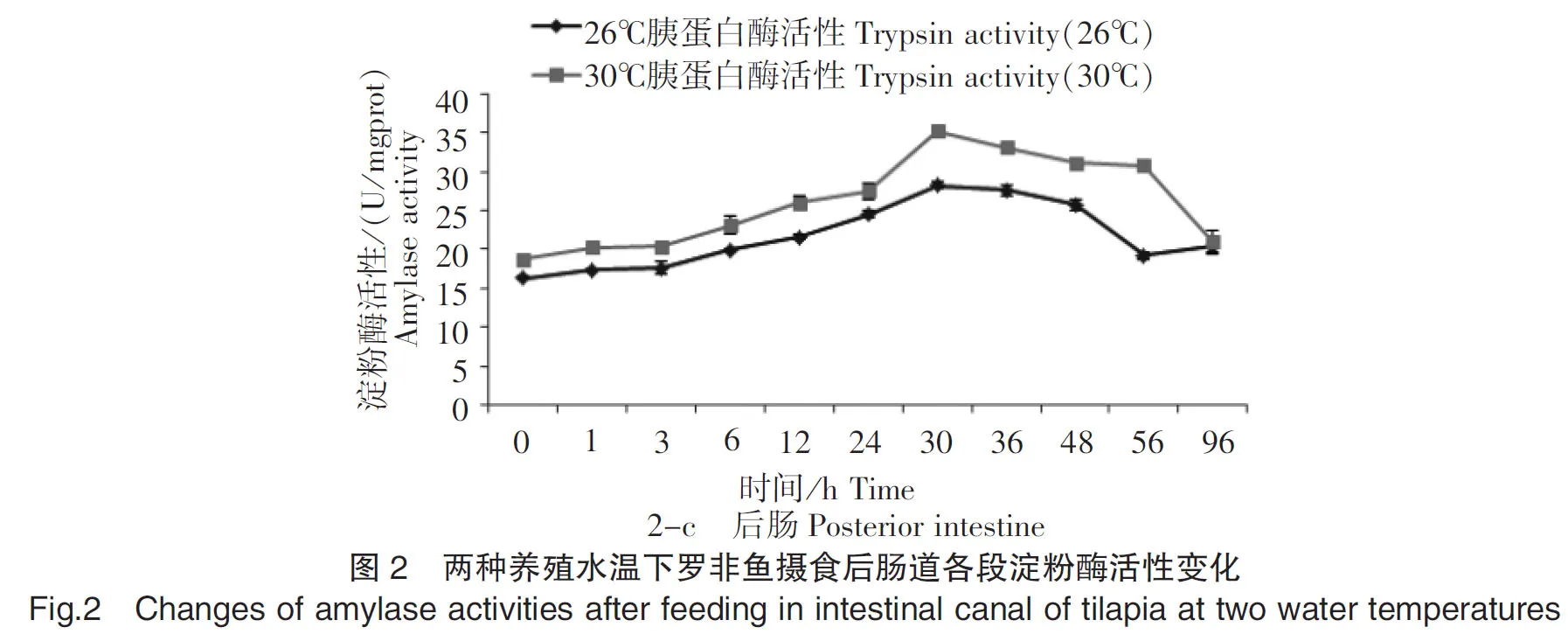
在26℃和30℃养殖水温下摄食后,罗非鱼前、中、后肠的淀粉酶活性基本呈现先上升后下降的趋势(图2-a、2-b、2-c)。在26℃养殖水温下,前、中、后肠淀粉酶活性分别从摄食后0 h、12 h和0 h开始升高,分别在12 h、30 h和30 h达到最高值,活性值分别为17.61 U/mgprot、23.52 U/mgprot和28.22 U/mgprot,分别是初始酶活性值的1.43倍、1.54倍和1.73倍;在30℃养殖水温下,前、中、后肠淀粉酶活性分别从摄食后0 h、6 h和0 h开始升高,分别在36 h、36 h和30 h达到最高值,活性值分别为19.87 U/mgprot、58.77 U/mgprot和35.24 U/mgprot,分别是初始酶活性值的1.45倍、3.82倍和1.88倍。30℃养殖水温下的肠道各段淀粉酶活性在3~48 h时均大于16.18 U/mgprot,而26℃养殖水温下的肠道各段胰蛋白酶活性仅在3~36 h时均大于15.02 U/mgprot。30℃养殖水温下的肠道各段淀粉酶活性最高值均高于26℃养殖水温,并表现出显著差异(P<0.05)。在肠道各段中,26℃水温下的淀粉酶活性大小顺序为后肠>中肠>前肠,30℃水温下的淀粉酶活性大小顺序为中肠>后肠>前肠。
2.3 脂肪酶活性
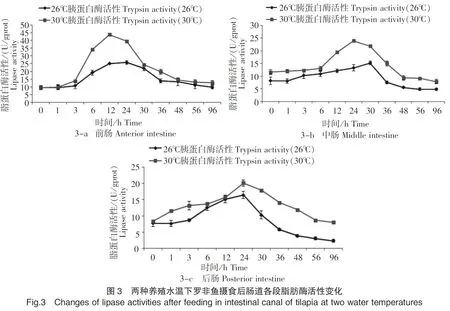
在26℃和30℃养殖水温下摄食后,罗非鱼前、中、后肠的脂肪酶活性基本呈现先上升后下降的趋势(图3-a、3-b、3-c)。在26℃养殖水温下,前、中、后肠脂肪酶活性分别从摄食后3 h、1 h和1 h开始升高,分别在24 h、30 h和24 h达到最高值,活性值分别为25.74 U/gprot、15.25 U/gprot和16.44 U/gprot,分别是初始酶活性值的2.71倍、1.86倍和2.13倍;在30℃养殖水温下,前、中、后肠脂肪酶活性分别从摄食后1 h、0 h和0 h开始升高,分别在12 h、24 h和24 h达到最高值,活性值分别为43.73 U/gprot、23.96 U/gprot和20.12 U/gprot,分别是初始酶活性值的4.58倍、2.06倍和2.40倍。30℃养殖水温下的肠道各段脂肪酶活性在3~36 h时均大于11.87 U/mgprot,而26℃养殖水温下的肠道各段脂肪酶活性仅在12~30 h时均大于10.27 U/mgprot。30℃养殖水温下的肠道各段脂肪酶活性最高值高于26℃养殖水温,并且差异显著(P<0.05)。在肠道各段中,26℃水温下的脂肪酶活性大小顺序为前肠>后肠>中肠,30℃水温下的脂肪酶活性大小顺序为前肠>中肠>后肠。
3 讨论
3.1 水温对消化酶活性的影响
水温作为最重要的环境因子之一,影响着鱼类消化酶活性的变化。据报道鱼类消化酶的最适温度一般为30~50℃[15]。泥鳅肠道蛋白酶、淀粉酶和脂肪酶的最适温度分别为40℃、45℃和35℃;肝胰脏蛋白酶、淀粉酶和脂肪酶的最适温度分别为30℃、40℃和35℃[16]。针对罗非鱼,研究发现在17~32℃温度范围内,消化酶活性随着水温的升高而上升[11]。本研究结果表明在30℃养殖水温条件下的肠道胰蛋白酶、淀粉酶、脂肪酶等消化酶活性均高于26℃养殖水温条件,且30℃养殖水温下的肠道各段消化酶较高活性水平持续时间比26℃养殖水温更长,与上述研究结论一致。由此可以推断,在不同的养殖水温下,由于消化酶活性的差异,罗非鱼对饲料的消化吸收能力也会随之改变。因此在罗非鱼实际养殖生产中,应根据不同地区、不同时间的环境温度特点,及时有针对性地调整投喂饲料量和配方,以取得最佳养殖效益。
3.2 消化酶的组织差异性
相关研究表明,罗非鱼表现为以植食性为主的杂食性鱼类特征,肠道较肉食性鱼类长,盘曲多,食物在肠道中移动滞留的时间相对较长,因此推测出肠道在罗非鱼食物消化中比其他消化器官起到更重要的作用[17]。本研究选择罗非鱼肠道为研究对象,并对比了肠道各段的消化酶活性,结果显示在30℃养殖水温下,胰蛋白酶活性水平在后肠最高,淀粉酶活性水平在中肠最高,脂肪酶活性水平在前肠最高。在唇鱼骨(Hemibarbuslabeo)上的相关研究表明,唇鱼骨的蛋白酶活性大小顺序为前肠>中肠>后肠,淀粉酶活性大小顺序为中肠>后肠>前肠,脂肪酶活性大小顺序为中肠>前肠>后肠[18]。而对鲇鱼(Plecoglossusaltivelis)的研究则发现,在最适温度下,蛋白酶活力顺序为前肠>中肠>后肠,淀粉酶的活力顺序为前肠>中肠>后肠,脂肪酶的活力顺序为前肠>中肠>后肠[19]。几种鱼类消化酶的组织差异性结果存在较大差异,推测可能与肠道消化酶活性受鱼种类别、投喂方式、饵料种类、环境因子、食性等因素影响有关[20]。
罗非鱼口服疫苗因其实施方便、对鱼体无损伤等特点,在养殖生产中越来越受到关注。本研究通过摄食后肠道各段消化酶活性的动态变化,对罗非鱼的消化机制进行了初步探讨,为罗非鱼口服疫苗的开发、饲料配方的设计提供了研究基础。
致谢:感谢福建省水产技术推广总站吴斌高级工程师、福建省淡水水产研究所林煜高级工程师和钟全福高级工程师等对本研究提供的支持和帮助。
