新型蓝紫光荧光分子N2-烷基-1,2,3-三氮唑的光谱性质
2018-10-26石晓濛吕雯雯敖慧龙贺信淳胡庆霞王飞军
石晓濛, 吕雯雯, 敖慧龙, 贺信淳, 胡庆霞, 王飞军, 赵 敏
(华东理工大学 化学与分子工程学院, 上海 200237)
1 引 言
有机小分子发光材料因具有种类丰富、分子结构易于设计修饰、方便制备提纯、色彩丰富、荧光量子产率高等优点而备受关注,主要应用于有机发光二极管、光活性材料、印刷染料、生物荧光探针、光敏传感器[1-6]等众多研究领域。尽管有机小分子发光材料的研究成果已经部分商品化,但是蓝紫光材料研究依旧很少。原因可能是蓝紫光材料能隙较宽,很难提高光稳定性或者量子产率较低[7]。有机小分子蓝紫光材料主要有芳香烃蓝紫光材料、含氮原子蓝紫光材料和含其他杂原子蓝紫光材料三大类[8-11]。芳香烃蓝紫光材料是最为常见,共平面结构[12-13],易发生分子内聚集,导致光活性降低。芳环间增加双键或大平面稠环芳香烃等结构可以延长分子共轭体系[14-15],提高荧光量子效率,但易使分子激发波长红移,导致色纯度降低。含氮原子蓝紫光材料主要有芳胺类蓝紫光材料和含氮杂环蓝紫光材料[16-17]。含氮杂环蓝紫光材料的氮原子被固定在共轭环中,相比芳胺类材料,其分子结构更稳定。
主要成分为三氮唑小分子是含氮原子蓝紫光材料的一种,分子内氮原子的孤对电子可以与π环电子共轭,增大共轭体系,增加荧光量子效率。2011年,Shi等探究了N2-芳基-1,2,3-三氮唑的光谱性质。结果表明,当N2-芳基-1,2,3-三氮唑的C4位是大位阻取代基会降低荧光强度,C4位和N2位与缺电子芳基(氰苯基,氟苯基,氯苯基)相连时荧光强度最大且荧光量子产率显著提高。之后,不同N2-芳基取代的三氮唑光谱性能得到了很好的研究与应用[18-22]。
2 实 验
2.1 试剂和仪器
所用试剂均为市售分析纯试剂,产物使用柱层析法提纯。核磁共振氢谱碳谱由Bruker AM.400型核磁共振仪(德国)测定,1H NMR采用TMS(δ0.0)或 CDCl3(δ7.26 ppm)为内标,13C NMR的内标为CDCl3(δ=77.0)。ESI由沃特世LCT Premier XE飞行时间质谱仪测定,EI由沃特世GCT Premier高分辨气质联用仪测定。紫外-可见光谱由Varian Cary-100型分光光度计(美国)测定。荧光光谱通过Varian Cary Eclipse荧光光谱仪(美国)测定。
2.2 合成方法
目标化合物合成路线见图1。

图1 目标化合物合成路线
在干燥的具塞玻璃试管中,加入A(145.1 mg,1 mmol)和B(2 mmol),加入TsOH(38.0 mg,0.2 mmol)和5 mL DCE,塞上玻璃塞,放入到80 ℃的油浴中,反应48 h。反应结束取出反应液,加入适量100~200目硅胶旋干柱层析。先用流动相为PE∶EA=30∶1,将1a分离出来,然后将流动相换成PE∶EA=6∶1,将1a′分离出来。
1a:无色液体,产率68%;1H NMR(400 MHz,CDCl3)δ:2.13(s,6H),7.06(d,J=7.6 Hz,2H),7.22~7.34(m,4H),7.41(t,J=7.6 Hz,2H),7.82(d,J=7.2 Hz,2H),7.89(s,1H);13C NMR(100 MHz,CDCl3)δ:29.4,67.7,124.7,125.9,127.2,128.2,128.8,130.6,130.7,146.0,147.0; HRMS(Micromass GCT,TOF MS ES+) Calcd. for C17H17N3[M+Na]+: 286.132 0; Found: 286.132 0。
1a′:无色液体,产率27%;1H NMR(400 MHz,CDCl3,TMS)δ: 2.11(s,6H),7.16~7.19(m,2H),7.28~7.42(m,6H),7.62(s,1H),7.80~7.83(m,2H);13C NMR(100 MHz,CDCl3,TMS)δ:29.8,64.4,118.6,125.0,125.6,127.8,128.0,128.7,130.7,144.8,147.5;HRMS(Micromass GCT,TOF MS ES+) Calcd. For C17H17N3-[M+H]+:264.150 1;Found:264.150 2。
2a:白色固体,产率72%;1H NMR(400 MHz,CDCl3,TMS)δ:1.68(s,3H),2.08(s,6H),7.10(d,J=7.2 Hz,1H),7.19~7.27(m,2H),7.32(t,J=7.6 Hz,1H),7.40(t,J=7.2 Hz,2H),7.48(d,J=7.6 Hz,1H),7.82(d,J=7.2 Hz,2H),7.86(s,1H);13C NMR(100 MHz,CDCl3,TMS)δ: 19.6,29.3,68.0,125.4,125.9,126.0,127.6,128.2,128.7,130.7,132.6,136.1,142.6,146.9;HRMS(Micromass GCT,TOF MS ES+) Calcd. for C18H19N3[M+H]+: 278.165 5; Found: 278.165 2。
冗余总线用于平衡系统中的所有功率,冗余总线的不确定性影响系统运行和发电成本。松弛总线有功功率的CDF曲线和不确定性结果如图9和表5所示。
2b:无色液体,产率91%;1H NMR(400 MHz,CDCl3)δ:2.12(s,6H),2.30(s,3H),6.98(d,J=8.0 Hz,2H),7.09(d,J=8.4 Hz,2H),7.31~7.36(m,1H),7.42(t,J=7.2 Hz,2H),7.79~7.83(m,2H),7.88(s,1H);13C NMR(100 MHz,CDCl3)δ:20.9,29.4,67.5,124.7,125.9,128.2,128.8,129.1,130.6,130.8,136.9,143.0,147.0; HRMS(Micromass GCT,TOF MS ES+) Calcd. for C18H19N3[M+H]+: 278.165 7; Found: 278.165 5。
2c:无色液体,产率80%;1H NMR(400 MHz,CDCl3)δ:2.11(s,6H),5.01(s,2H),6.88(d,J=9.2 Hz,2H),7.04(d,J=8.8 Hz,2H),7.28~7.43(m,8H),7.79~7.83(m,2H),7.87(s,1H);13C NMR(100 MHz,CDCl3)δ:29.5,67.2,69.9,114.5,125.9,126.1,127.4,127.9,128.2,128.5,128.7,130.6,130.7,136.9,138.3,146.9,157.8; HRMS(Micromass GCT,TOF MS ES+) Calcd. for C24H23N3O[M+H]+:370.191 9; Found: 370.191 4。
2d:无色液体,产率84%;1H NMR(400 MHz,CDCl3)δ:2.11(s,6H),7.00~7.03(m,2H),7.21~7.27(m,2H),7.31~7.36(m,1H),7.40~7.44(m,2H),7.80-7.82(m,2H),7.89(s,1H);13C NMR(100 MHz,CDCl3)δ:29.3,67.2,125.9,126.3,128.3,128.5,128.8,130.5,130.8,133.1,144.4,147.2; HRMS(Micromass GCT,TOF MS ES+) Calcd. for C17H16N3Cl[M+H]+:298.111 1; Found: 298.110 1。
2e:无色液体,产率87%;1H NMR(400 MHz,CDCl3)δ:2.11(s,6H),3.75(s,3H),6.80(dd,J=2.0,6.8 Hz,2H),7.05(dd,J=2.0,7.2 Hz,2H),7.32(t,J=7.6 Hz,1H),7.40(t,J=7.6 Hz,2H),7.82(t,J=7.2 Hz,2H),7.87(s,1H);13C NMR(100 MHz,CDCl3)δ:29.4,55.2,67.2,113.6,125.9,126.0,128.1,128.7,130.6,130.7,138.0,146.9,158.6; HRMS(Micromass GCT,TOF MS ES+) Calcd. for C18H19N3O[M+H]+:294.160 6; Found:294.160 9。
2f:无色液体,产率91%;1H NMR(400 MHz,CDCl3)δ:2.11(s,6H),2.20(s,6H),6.82(dd,J=2.4,8.0 Hz,1H),6.88(d,J=2.0 Hz,1H),7.04(d,J=7.6 Hz,1H),7.29~7.35(m,1H),7.41(t,J=7.6 Hz,2H),7.80~7.84(m,2H),7.88(s,1H);13C NMR(100 MHz,CDCl3)δ:19.3,20.0,29.4,67.5,122.2,125.9,126.0,128.1,128.7,129.6,130.6,130.8,135.6,136.5,143.4,146.9;HRMS(Micromass GCT,TOF MS ES+) Calcd. for C19H21N3[M+H]+:292.181 4;Found: 292.180 8。
3a:无色液体,产率81%;1H NMR(400 MHz,CDCl3,TMS)δ:2.12(s,6H),2.29(s,3H),6.98(d,J=8.4 Hz,2H),7.07~7.21(m,4H),7.25~7.32(m,1H),8.00~8.07(m,2H);13C NMR(100 MHz,CDCl3,TMS)δ:20.9,29.4,67.6,115.9(d,J=21.8 Hz),118.7(d,J=12.7 Hz),124.4(d,J=2.8 Hz),124.7,128.4(d,J=3.7 Hz),129.1,129.4(d,J=8.6 Hz),133.5(d,J=11.5 Hz),136.9,141.4(d,J=2.7 Hz),142.9,159.9(q,J=247.9 Hz);19F NMR(470 MHz,CDCl3,TMS)δ:-114.793; HRMS(Micromass GCT,TOF MS ES+) Calcd. For C18H18FN3[M+Na]+:318.138 2,Found:318.138 2。
3b:无色液体,产率89%;1H NMR(400 MHz,CDCl3,TMS)δ:2.11(s,6H),2.30(s,3H),6.97~7.04(m,3H),7.10(d,J=8.0 Hz,2H),7.33~7.40(m,1H),7.52~7.58(m,2H),7.87(s,1H);13C NMR(100 MHz,CDCl3,TMS)δ:20.9,29.4,67.7,112.8(d,J=22.9 Hz),115.0(d,J=21.2 Hz),121.5(d,J=3 Hz),124.6,129.1,130.3(d,J=7.4 Hz),130.8,132.9(d,J=8 Hz),137.0,142.8,145.9(d,J=2.3 Hz),163.1(q,J=243.1 Hz);19F NMR(470 MHz,CDCl3,TMS)δ:-112.800; HRMS(Micromass GCT,TOF MS ES+) Calcd. For C18H18FN3[M+Na]+:318.138 2,Found:318.138 2。
3c:无色液体,产率91%;1H NMR(400 MHz,CDCl3,TMS)δ:2.11(s,6H),2.29(s,3H),6.98(d,J=7.6 Hz,2H),7.08~7.11(m,4H),7.77(t,J=6.2 Hz,2H),7.82(s,1H);13C NMR(100 MHz,CDCl3,TMS)δ:20.9,29.4,67.5,115.7(d,J=21.1 Hz),124.7,127.0(d,J=2.9 Hz),127.6(d,J=8.2 Hz),129.0,130.3,136.9,142.9,146.1,162.7(q,J=245.6 Hz);19F NMR(470 MHz,CDCl3,TMS)δ:-113.531;HRMS(Micromass GCT, TOF MS ES+) Calcd. For C18H18FN3-[M+Na]+:318.138 2,Found:318.138 2。
3d:无色液体,产率90%;1H NMR(400 MHz,CDCl3,TMS)δ:2.11(s,6H),2.30(s,3H),6.98(d,J=8.4 Hz,2H),7.09(d,J=7.6 Hz,2H),7.36~7.39(m,2H),7.72~7.76(m,2H),7.85(s,1H);13C NMR(100 MHz,CDCl3,TMS)δ:20.9,29.4,67.6,124.7,127.2,128.9,129.1,129.3,130.5,133.9,137.0,142.8,145.9; HRMS(Micromass GCT,TOF MS ES+) Calcd. For C18H18ClN3[M+Na]+:334.108 7,Found:334.109 1。
3e:白色固体,产率82%;1H NMR(400 MHz,CDCl3,TMS)δ:2.12(s,6H),2.30(s,3H),7.00(d,J=8.0 Hz,2H),7.10(d,J=8.4 Hz,2H),7.69(d,J=8.4 Hz,2H),7.93(t,J=8.4 Hz,3H);13C NMR(100 MHz,CDCl3,TMS)δ:20.9,29.3,68.0,111.5,118.8,124.6,126.3,129.1,131.2,132.6,135.2,137.1,142.5,145.2; HRMS(Micromass GCT,TOF MS ES+) Calcd. For C19H18N4[M+Na]+:325.142 9,Found:325.143 1。
3f:无色液体,产率86%;1H NMR(400 MHz,CDCl3,TMS)δ:2.10(s,6H),2.28(s,3H),2.36(s,3H),6.97(d,J=8.4 Hz,2H),7.08(d,J=8.0 Hz,2H),7.21(d,J=8.4 Hz,2H),7.70(d,J=8.0 Hz,2H),7.84(s,1H);13C NMR(100 MHz,CDCl3,TMS)δ:20.9,21.3,29.4,67.4,124.7,125.8,128.0,129.0,129.4,130.4,136.8,138.0,143.1,147.0;HRMS(Micromass GCT,TOF MS ES+) Calcd. For C19H21N3[M+Na]+:314.163 3,Found:314.163 3。
3g:淡黄色液体,产率74%;1H NMR(400 MHz,CDCl3,TMS)δ:2.10(s,6H),2.29(s,3H),3.84(s,3H),6.96(dd,J=9.2 Hz,4.0 Hz,4H),7.09(d,J=8.0 Hz,2H),7.74(d,J=8.0 Hz,2H),7.80(s,1H);13C NMR(100 MHz,CDCl3,TMS)δ:20.9,29.4,55.3,67.4,114.2,123.5,124.7,127.2,129.0,130.0,136.8,143.1,146.8,159.6;HRMS(Micromass GCT,TOF MS ES+) Calcd. For C19H21N3O[M+Na]+:330.158 2,Found:330.158 5。
3h:黄色液体,产率91%;1H NMR(400 MHz,CDCl3,TMS)δ:2.10(s,6H),2.30(s,3H),6.98(d,J=8.4 Hz,2H),7.05~7.11(m,3H),7.29(d,J=5.2 Hz,1H),7.37(d,J=2.8 Hz,1H),7.77(s,1H);13C NMR(100 MHz,CDCl3,TMS)δ:20.9,29.4,67.6,124.5,124.7,125.2,127.5,129.0,130.4,133.2,136.9,142.2,142.8; HRMS(Micromass GCT,TOF MS ES+) Calcd. For C16H17-N3S[M+Na]+:306.104 1,Found:306.104 2。
2.3 光谱性能测试
将化合物1a、1a′、2a~2f、3a~3h分别配成10-3mol·L-1的1,2-二氯乙烷溶液进行吸收和荧光光谱测试,激发波长均选择各化合物最大紫外吸收波长,狭缝宽度均为5 nm,激发电压600 V。化合物的荧光量子产率测定以硫酸奎宁在水中为基准(Φref=0.564):
(1)
荧光量子产率Φ按照公式(1)计算,其中Int是激发峰面积,A是最大紫外吸光度,n是溶剂反射指数。下标的参考值为硫酸奎宁在水中各自数值。
3 结果与讨论
3.1 合成方法与荧光探究
图2是化合物1a和1a′的荧光发射光谱图,表1是化合物1a和1a′的紫外-可见吸收峰、荧光激发发射波长、Stokes位移、荧光量子产率参数。
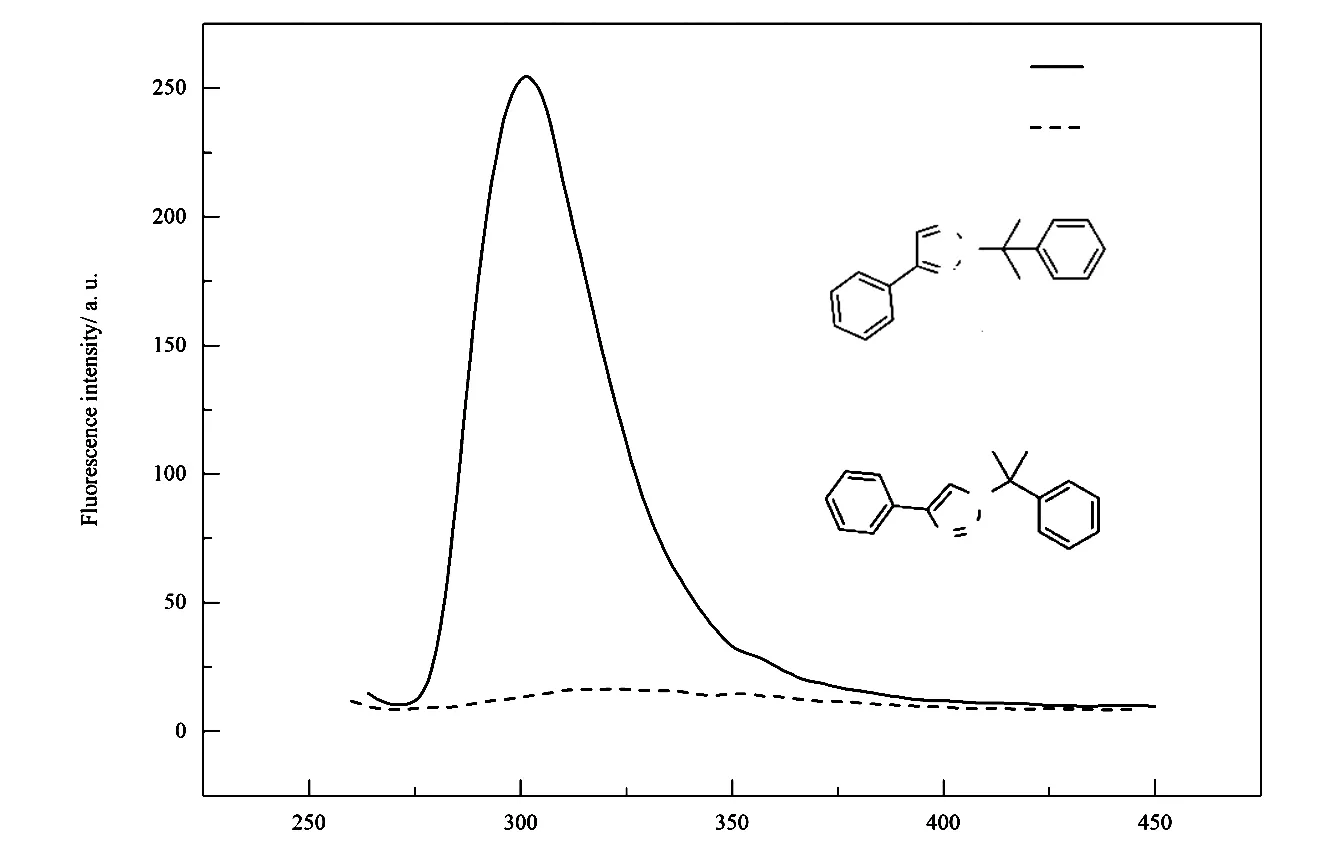
图2 化合物1a和1a′的荧光发射光谱,激发波长为254 nm。

表1 化合物1a和1a′在1,2-二氯乙烷中的光谱数据
采用对甲苯磺酸催化的方法合成N2-烷基-1,2,3-三氮唑和N1-烷基-1,2,3-三氮唑,反应条件温和且总产率高。研究结果与Shi等研究的A-π-A型链状分子荧光性能相似[19],虽然两种产物均有较强的紫外吸收(表1),但是N2-烷基-1,2,3-三氮唑(1a)有荧光,而N1-烷基-1,2,3-三氮唑(1a′)几乎没有荧光(图2)。
以1a为荧光核心,探究三氮唑N2位和C4位不同取代基对光谱性能的影响,可以帮助我们更好地了解该三氮唑小分子。
3.2 化合物光谱性质
图3和图4分别是化合物2a~2f和3a~3h的荧光发射光谱图,表2是化合物2a~2f和3a~3h的紫外-可见吸收峰、荧光激发发射波长、Stokes位移、荧光量子产率参数。

图3 化合物2a~2f的荧光发射光谱,激发波长为254 nm。

图4 化合物3a~3h的荧光发射光谱,激发波长为375 nm。
根据图3和表2可知,当N2位苯环上的取代基是烷基(2a,2b,2f)时,荧光量子产率都很高,均达到40%以上。2f有两个供电子属性的甲基取代基,但荧光发光强度却明显小于2a和2b,归属为两取代基的供电子效应存在相互抵消的作用。2e的荧光量子产率和荧光强度均明显小于2b取代基,可以归属为氯取代基的吸电子诱导效应削弱了荧光。有强供电子属性取代基的2c和2d的荧光强度和荧光量子产率远小于2b,归属为2c和2d在226 nm和254 nm均有均匀且较强的紫外可见吸收,使该分子在254 nm的激发波长下仅激发出一个波段下的荧光。虽然荧光量子产率是衡量荧光活性分子的重要指标,但却不能完全代表荧光分子的全部性能,因为分子不同其光子吸收效率(吸收常数ε)也是不同的。可以看出,N2位引入给电子取代基更有利于提高三氮唑分子的荧光性能。
由于2b合成产率更高且荧光性能优良,故选取2b作为分子骨架,探究不同C4位取代基(3a~3h)对三氮唑分子光谱性能的影响。所有的C4位芳基取代化合物相较2b都产生了更强的荧光,且最大发射波长有明显红移(图4),可能原因是不同的取代基形成了更有效的共轭,增加了光吸收能力。C4位是吸电子取代基的化合物(3a~3e)都有很高的荧光量子产率。其中氯取代基化合物(3d)荧光量子产率与氟取代基化合物(3a,3b)相差无几,但氟取代基化合物荧光强度更高(3c,3b),可能是由于引入的大原子序数取代基与π电子体系共轭效应差减弱了荧光。C4位为给电子取代基的化合物(3f,3g)相较2b荧光强度都有显著提升,荧光量子产率也达到40%以上。
不同的取代基除了荧光强度和量子产率不同之外,Stokes位移也会受到影响。C4位取代基化合物的Stokes位移最大可达到70 nm,大于N2位取代基化合物(表2)。并且这一变化趋势与荧光量子产率和荧光发射强度也是一致的,可能的原因是C4位不同取代基距离荧光分子骨架中心距离更近,影响更大。N2位取代分子(2a~2f)和C4位取代分子(3a~3h)整体的荧光量子产率都达到30%以上,最高可达到79%。与市售蓝光染料硫酸奎宁二水合物(Φ=0.56)相当,高出市售蓝光材料DSBP(Φ=0.23)2~3倍,这说明4-芳基-N2-取代-1,2,3-三氮唑未来可以发展为一种新型发射蓝紫光的荧光素。
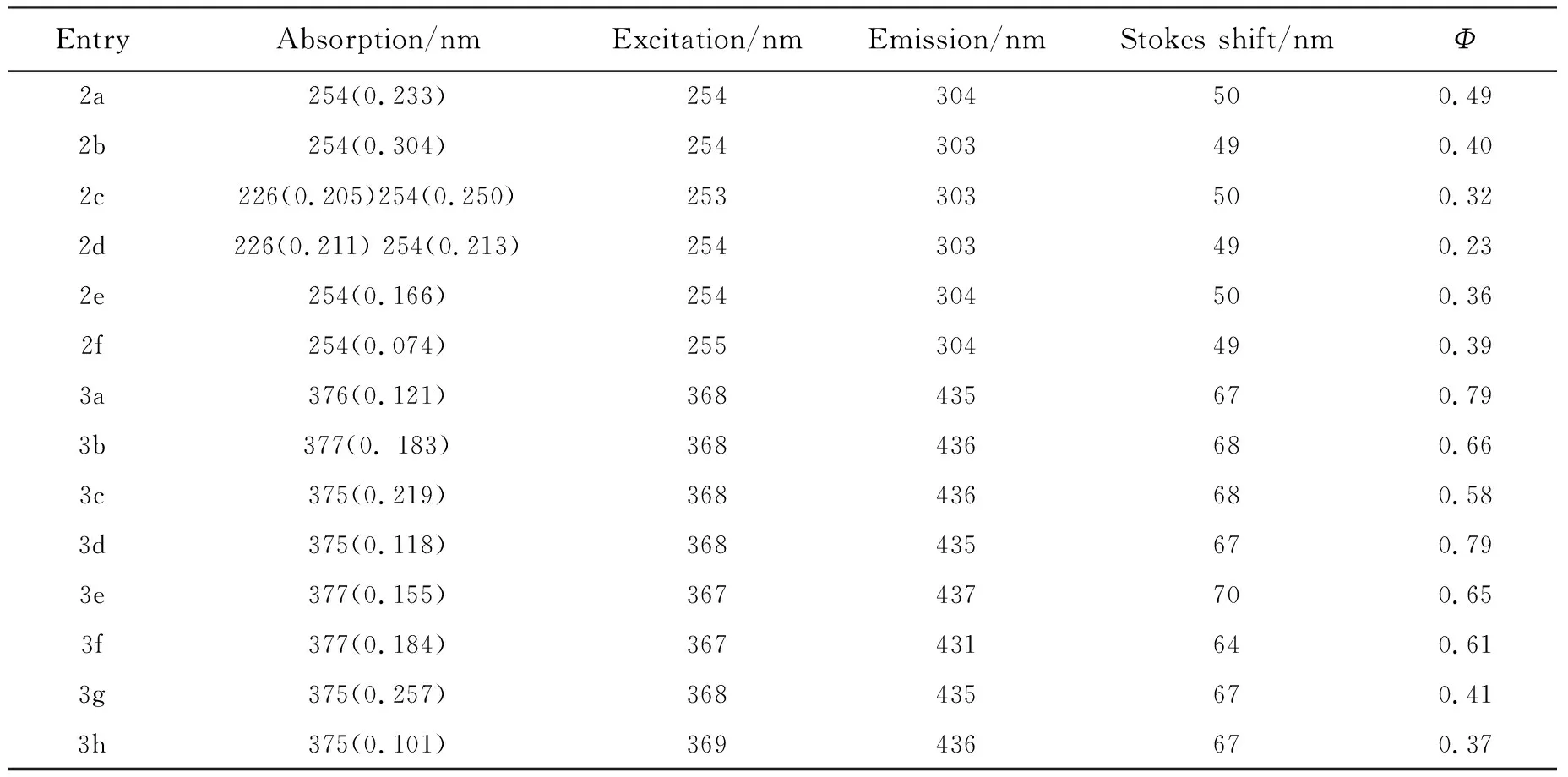
表2 化合物2a~2f和3a~3h在1,2-二氯乙烷中的光谱数据
4 结 论
合成了4-苯基-N1-烷基-1,2,3-三氮唑和4-苯基-N2-烷基-1,2,3-三氮唑,探究了4-苯基-N2-烷基-1,2,3-三氮唑的紫外吸收情况和荧光光谱属性。通过对分子C4和N2位不同的取代基进行综合比较,发现当N2位的苯环上是烷基取代基(2a,2b,2f)时化合物的荧光强度更大,C4位的苯环上是吸电子取代基(3a,3d)时化合物的荧光量子产率最大。相比N2位上的取代基,调整C4位取代基可以更加高效地调控该类化合物感光性能。修饰不同取代基可以用来调节物质的荧光发射波长(300~440 nm)、Stokes位移(49~70 nm)及其荧光量子产率(Φ=0.23~0.79),这对该类型小分子发展为蓝紫光发光材料具有重要意义。
