SMYD3对氯化钴诱导T47D乳腺癌细胞缺氧的影响分析
2018-10-23董青青徐曼丽张同存罗学刚
王 蕾,董青青,苗 峙,徐曼丽,张同存,罗学刚
(工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津 300457)
乳腺癌是世界高发癌症之一,是威胁女性生存的首要因素.目前,乳腺癌在我国呈现出了发病年龄年轻化、恶性程度不断升高、发病率增加而预后差等特点[1].与其他恶性肿瘤一样,乳腺癌细胞往往因为增殖迅速而导致附近组织血管氧供血不足,并可在缺氧条件下生存,诱导恶性选择及迁移的发生.因此,探究乳腺癌等恶性肿瘤细胞的缺氧应答机制对于相关疾病的临床合理用药及新药研发具有十分重要的理论指导意义.
SMYD3(SET and MYND domain-containing protein 3)是2004年由日本科学家 Hamamoto等[2]发现的组蛋白甲基化酶,可特异性甲基化组蛋白 H3K4、H4K5、H4K20[3-5],并作为转录因子与靶基因启动子上的“CCCTCC”或“GGAGGG”结合,调控基因转录表达、参与信号转导过程.研究[2,6-7]已发现,SMYD3在乳腺癌、肝癌、结直肠癌、宫颈癌、胃癌等恶性肿瘤中均存在高表达,并参与细胞增殖、黏附与迁移[8-11].然而,迄今为止,SMYD3与肿瘤细胞缺氧应答的关系在国内外均未见报道.鉴于此,本文对氯化钴(CoCl2)诱导缺氧损伤情况下,检测 T47D乳腺癌细胞的存活、细胞周期以及SMYD3转录水平的变化,并就SMYD3过表达对氯化钴作用的影响情况进行了分析与探讨.
1 材料与方法
1.1 细胞、试剂和主要仪器
人乳腺癌细胞系 T47D购自上海哈灵生物有限公司,并在本实验室长期保存.胎牛血清,天津康源生物技术有限公司;RPMI-1640培养基,美国 Gibco公司;CoCl2,美国 Sigma公司;Trizol试剂、M-MLV逆转录试剂盒,美国 Invitrogen公司;SYBR GREEN染料,德国 DBI公司;青霉素、链霉素、胰酶、MTT、PI及RNase A,北京索莱宝科技有限公司.pcDNA5-TO/TAP-DEST-SMYD3质粒由美国 OSI制药公司Kenneth W.Foreman博士馈赠[12].
ABI-Step OneTM型实时荧光定量 PCR仪,美国ABI公司;BD Accuri C6流式细胞仪,美国 BD公司.
1.2 细胞培养
人乳腺癌细胞系 T47D使用含 10%,胎牛血清、100,U/mL青霉素、0.1,mg/mL链霉素的 RPMI-1640培养基,在饱和水蒸气、5%,CO2恒温培养箱中进行37,℃贴壁培养.待细胞汇合度达到 70%~90%,时,采用0.25%,胰酶温和消化传代.
1.3 MTT法
将细胞以每孔 5×103个细胞的细胞密度种入96孔板中,12,h后换成无血清的基础培养基,进行24,h细胞归一化处理.第 2天,加入 CoCl2溶液(终浓度为 0、50、100、200、400,µmol/L),置于培养箱培养24,h.随后,每孔加入10,µL 5,mg/mL MTT溶液,避光 37,℃反应 4,h后随即弃去培养基,加入 150,µL DMSO溶解形成的甲瓒结晶.在酶标仪中检测570,nm 波长下的吸光度,按照式(1)计算相对细胞活力.

1.4 流式细胞术
收集处理组和对照组细胞,用 4,℃预冷的 PBS洗涤2次后,将细胞滴加至PBS稀释的75%,乙醇中固定,-20,℃静置过夜.第 2天,将固定好的细胞离心收集,并用 PBS清洗 2次后,加入 500,µL含50,µg/mL PI和 0.1%, RNase A 的 PBS 并吹匀,4,℃避光染色 30,min后即可使用流式细胞仪进行检测,数据由ModFIT软件进行分析.
1.5 实时荧光定量PCR(Real-time PCR)
将细胞以 5×104,mL-1种入 6孔板中,待细胞完全贴壁后梯度加入 CoCl2至终浓度为 0、50、100、200、400,µmol/L,放入培养箱中静置培养 24,h.第 2天,将处理过的细胞加入 1,mL Trizol,4,℃下裂解提取RNA.取2,µg总RNA加入M-MLV及随机引物,进行逆转录得到cDNA,随后即可进行PCR.PCR所用到的引物序列为:GAPDH,上游 5'-ATTCAACG GCACAGTCAAGG-3',下游 5'-GCAGAAGGGGCG GAGATGA-3';SMYD3,上游 5'-CCCAGTATCTCT TTGCTCAATCAC-3',下游 5'-ACTTCCAGTGTGCC TTCAGTTC-3'.PCR 反应条件为:95,℃预变性10,min;95,℃ 15,s,60,℃ 1,min,共 40 个循环,并以ΔΔCt法对结果进行计算.
1.6 数据与统计
本文所有实验结果均至少重复3次,实验结果数据以“平均值±标准差”表示,数据由 Graphpad Prism 5.0进行统计分析,*和**分别表示与对照组相比有显著差异(P<0.05)和极显著差异(P<0.01).
2 结果与分析
2.1 CoCl2抑制T47D细胞的活力
在加入 CoCl2处理 24,h后,MTT法检测 CoCl2对 T47D细胞的增殖影响情况发现:随着浓度的增加,T47D细胞增殖受到明显抑制,呈现出显著的浓度依赖性(图 1).在 400,µmol/L CoCl2处理后,细胞存活率降到了(58.36±8.31)%,活细胞数明显低于对照组细胞(P<0.01),表明 CoCl2诱导的化学缺氧会对细胞产生损伤,抑制细胞活力.
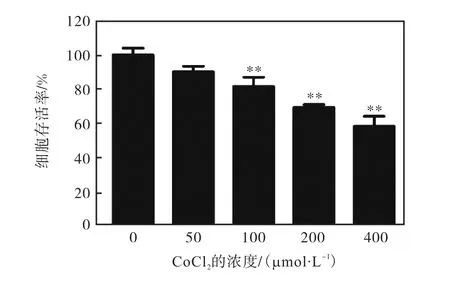
图1 CoCl2对T47D细胞增殖的影响Fig. 1 Effect of CoCl2 on proliferation of T47D cells
2.2 CoCl2诱导T47D细胞产生G0/G1期周期阻滞
为进一步探究 CoCl2对 T47D细胞活力的抑制作用机制,采用流式细胞术对加药后的细胞周期分布进行了检测,结果如图2所示.在0、100、400,µmol/L CoCl2培养24,h后,T47D细胞的G0/G1期含量发生了不同程度的变化.随着 CoCl2给药浓度的增加,G0/G1期细胞峰型面积呈显著的上升趋势,与对照组细胞相比,加入 400,µmol/L CoCl2处理 24,h后,G0/G1期细胞明显增多(P<0.05)(图 3),在总体细胞中所占比例由(50.32±1.12)%增至(75.69±3.58)%,而 S期细胞所占比例则由(26.48±0.75)%,降至(10.87±0.49)%,表明 CoCl2能够抑制细胞由G1期进入S期,从而影响细胞的复制,抑制其增殖.
2.3 CoCl2抑制SMYD3的转录
前人研究[10,13]已表明,SMYD3是雌激素受体重要的辅助因子,对于乳腺癌细胞的增殖、迁移具有十分重要的作用.Ren等[14]在雌激素受体阴性乳腺癌细胞 MDA-MB-231中干扰 SMYD3后发现细胞增殖能力受到明显的抑制,且细胞周期被阻滞在了G0/G1期.
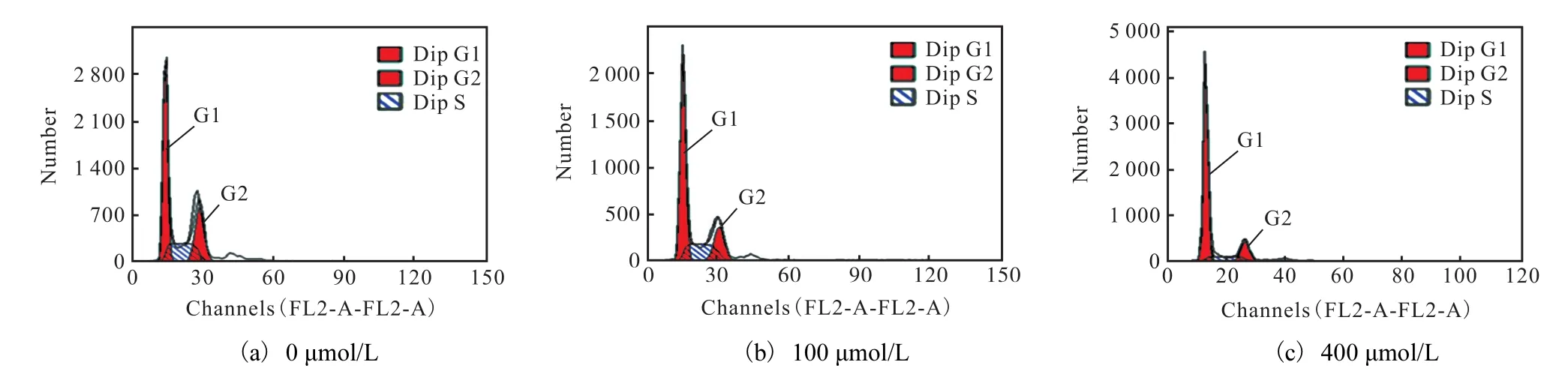
图2 CoCl2对T47D细胞周期的影响Fig. 2 Influence of CoCl2 on cell cycle of T47D breast cancer cells
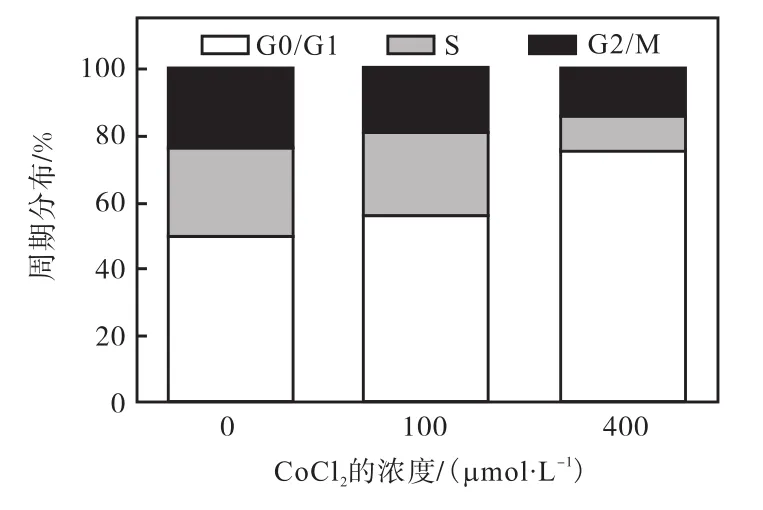
图3 CoCl2对T47D细胞的周期分布比率的影响Fig. 3 Effect of CoCl2 on the cell distribution ratio of T47D cells
在此,首先在本实验所用的雌激素受体阳性乳腺癌细胞 T47D中就 SMYD3对细胞周期的影响情况进行了分析,结果如图 4和图 5所示.用特异性siRNA抑制内源SMYD3表达后,T47D细胞同样会发生 G0/G1期阻滞,表现出了与 CoCl2处理相类似的现象.因此,推测在 CoCl2诱导 T47D 细胞产生G0/G1期阻滞、抑制细胞增殖的过程中,SMYD3很可能也牵涉其中.为验证这一假设,通过荧光定量RT-PCR方法对不同浓度 CoCl2处理后 SMYD3的mRNA水平进行了检测,结果如图6所示.
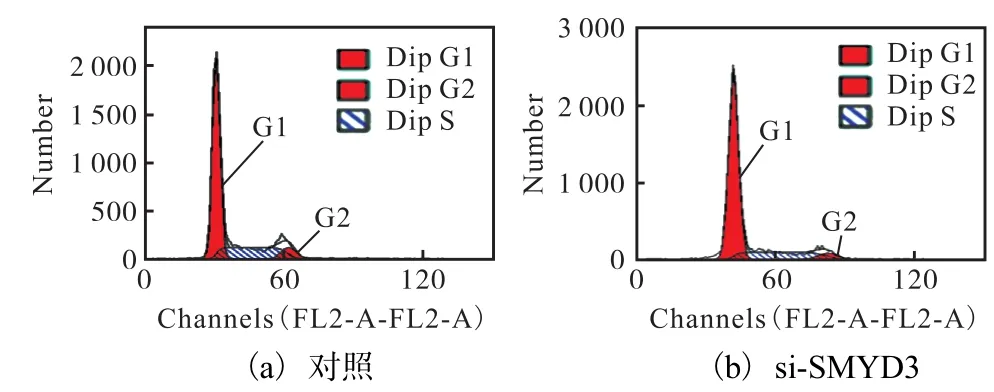
图4 干扰SMYD3诱导T47D细胞产生G0/G1期阻滞Fig. 4 SMYD3 absence induced G0/G1 arrest in T47D breast cancer cells
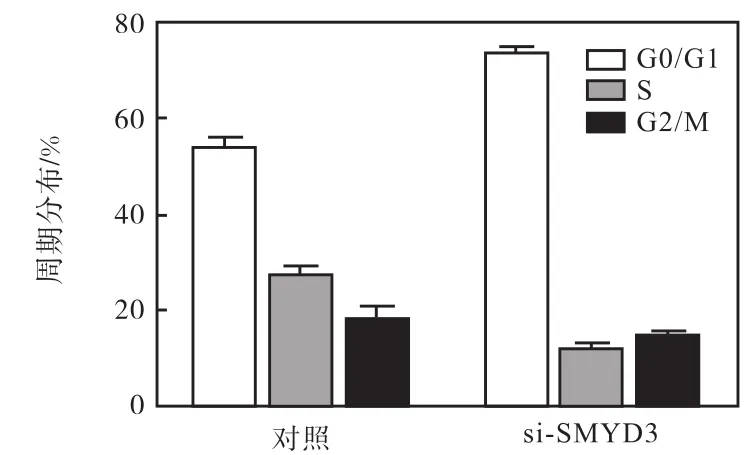
图5 干扰SMYD3周期分布图Fig. 5 Ratio of cell distribution of SMYD3 absence
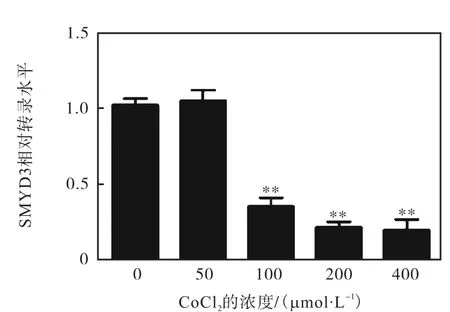
图6 CoCl2对SMYD3转录的影响Fig. 6 Effect of CoCl2 on the transcription of SMYD3
由图6可知:在CoCl2浓度大于100,µmol/L时,SMYD3的转录水平显著下降(P<0.01),至浓度达到400,µmol/L时,SMYD3的mRNA水平降到了对照细胞的1/5左右(0.20±0.12).
2.4 过表达SMYD3抑制CoCl2对T47D细胞的作用
从图 1—图 6结果可以看出,CoCl2对 T47D细胞的缺氧损伤作用很可能与其对 SMYD3的转录抑制有关.为进一步验证这一结论,将 SMYD3的过表达质粒 pcDNA5-TO/TAP-DEST-SMYD3转入 T47D细胞使 SMYD3过表达(图 7),探究其是否可以抵消CoCl2对细胞的缺氧损伤作用.MTT检测结果显示:与转染空质粒的对照组相比,过表达SMYD3可增强细胞的增殖活力,并抑制 CoCl2对细胞的增殖抑制作用(图 8).
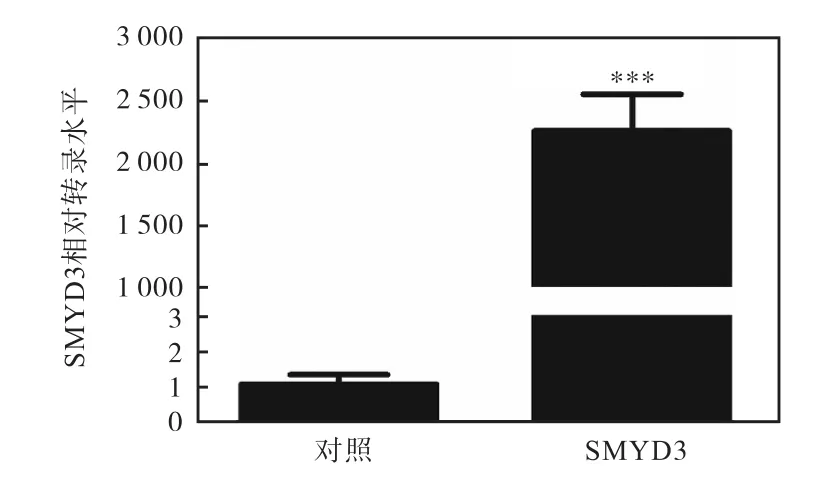
图7 过表达SMYD3的mRNA水平Fig. 7 The mRNA level of overexpressed SMYD3
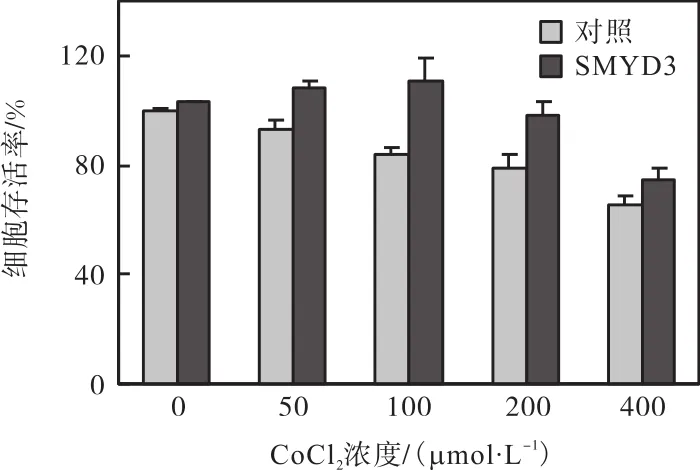
图8 过表达SMYD3抑制CoCl2诱导的抗增殖作用Fig. 8 Effect of SMYD3 overexpression on CoCl2-induced antiproliferation in T47D breast cancer cells
进一步检测细胞周期(图 9)发现:在过表达SMYD3与 CoCl2同时给药 200,µmol/L时,G0/G1期细胞含量(56.05±0.72)%较单过表达 SMYD3组(50.98±0.49)%有所升高,但比单加 200,µmol/L CoCl2组(64.21±1.46)%明显降低,周期分布比率见图10.结合MTT结果(图8),这些现象提示SMYD3的过表达可对 CoCl2诱导的缺氧损伤产生一定的保护作用,即SMYD3可提高癌细胞在缺氧条件下的存活能力.
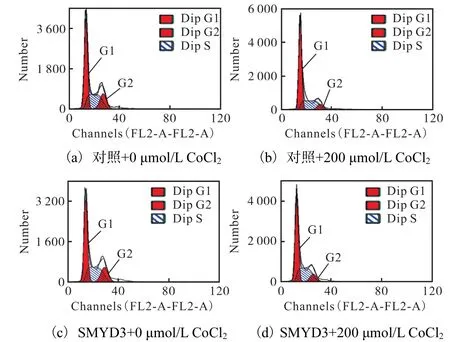
图9 SMYD3对CoCl2诱导的周期阻滞的影响Fig. 9 Effect of SMYD3 on CoCl2-induced cell cycle arrest
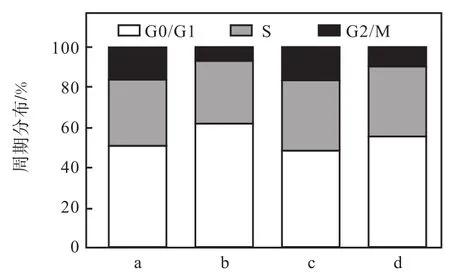
图10 细胞周期分布比率图Fig. 10 Ratio of cell distribution
3 讨 论
SMYD3已被证实在乳腺癌、肝癌、结直肠癌等多种癌组织中都有异常的高表达,而在相应的正常组织中表达量低[2],这与肿瘤患者的存活率密切相关[7,,15].Ren等[14]研究表明,敲低 SMYD3可以促进乳腺癌细胞产生周期阻滞,抑制其增殖;Tsuge等[16]认为,SMYD3是 RB-E2F信号转导通路中的一个下游靶点,5′-CCGCC-3′序列拷贝数降低将可能降低SMYD3与 E2F-1的亲和力,从而使结肠癌、肝癌和乳腺癌发生几率降低;还有研究[17]表明,SMYD3通过调控一系列靶基因及信号通路,参与到了肝癌与结肠癌的增殖和上皮-间质转化(epithelial-mesenchymal transition,EMT)进程中,促使肿瘤恶化及转移.此外,本课题组前期研究[18-19]发现,SMYD3在肿瘤的发生发展中起重要作用,干扰SMYD3可抑制宫颈癌细胞的增殖与迁移[8];过表达 SMYD3可上调迁移标志基因 MYL9,与 MRTF-A 协同促进乳腺癌发生迁移[9].由此可见,SMYD3已被视为是非常有潜力的肿瘤基因治疗及药物研发新靶点之一.
由于肿瘤细胞增殖迅速,周围组织血管逐渐无法提供足够的氧气,而容易在肿瘤内部形成缺氧微环境.缺氧会对细胞产生杀伤和抑制作用,例如:临床上就有针对局部晚期肿瘤的 SFP(hypoxic antiblastic stop-flow perfusion)缺氧疗法[20-21],即通过充气气囊导管将肿瘤与血管隔离,截断肿瘤的血氧供应,从而杀伤肿瘤细胞.然而,在低氧环境下,肿瘤细胞会逐步改善自身基因表达情况,通过增强糖酵解代谢、促进血管新生等方式,提升对缺氧环境的适应能力.这种缺氧微环境及与之相伴随的代谢方式等的改变,是恶性肿瘤细胞中普遍存在的生化特征,被称为瓦博格效应[22].尽管低氧糖酵解途径较有氧的线粒体氧化磷酸化途径产能效率低,但却可为肿瘤细胞快速提供ATP以及细胞分裂增殖所必需的前体物质,同时产生大量乳酸,形成酸性微环境,既可抵御免疫细胞、免疫分子及抗癌药物的杀伤作用,还可分解破坏细胞基质,促进肿瘤细胞浸润和转移.因此,对低氧损伤的耐受能力增强是肿瘤细胞恶性转化、侵袭转移和对放化疗抵抗的重要原因之一[23-24].
CoCl2模拟肿瘤细胞低氧环境是体外诱导细胞缺氧的经典模型,研究表明 CoCl2可通过置换脯氨酸羟化酶(prolyl hydroxylases,PHD)辅因子中的 Fe2+,阻断氧信号的转导,阻止 HIF-1α 被羟化,同时影响抑癌基因产物 pVHL结合 HIF-1α 氧依赖性降解区域(ODD),从而稳定细胞内 HIF-1α 的表达,引起一系列细胞对缺氧的反应.因此,CoCl2得到了国内外关于体外缺氧研究的广泛应用[25-28].在本研究中,通过CoCl2来诱导缺氧环境,探究缺氧环境对人乳腺癌细胞 T47D增殖能力及细胞周期的影响机制.结果发现:CoCl2诱导缺氧可引发细胞 G0/G1期阻滞、抑制癌细胞增殖,这一过程与其对SMYD3的转录抑制密切相关,而人为过表达SMYD3则可缓解缺氧诱导的G0/G1期阻滞及增殖抑制效应.这些结果表明:SMYD3对乳腺癌等恶性肿瘤发生发展的推动作用,很可能与其提高细胞对缺氧环境的耐受能力有关.
