氧空位缺陷对光催化活性的影响及其机制
2018-10-23张慧娜闫建成程丽君关苏军
郝 亮,张慧娜,闫建成,程丽君,关苏军,鲁 云
(1. 天津市低碳绿色过程装备国际联合研究中心,天津市轻工与食品工程机械装备集成设计与在线监控重点实验室,天津科技大学机械工程学院,天津 300222;2. 天津大学仁爱学院,天津 301636;3. 东京理科大学物理学院,东京 162-8601;4. 千叶大学工学研究院机械系,千叶 263-8522)
2000年,日本学者 Nakamura等[1]就针对 TiO2中氧空位对其可见光催化降解去除 NO气体的影响进行了研究,但该研究并没有引起足够的重视.直到2011年,陈晓波等[2]利用在氢气气氛中高温煅烧纳米TiO2粉末,在其表面引入氧空位及大量无序结构等,使其强烈地吸收可见光,进而极大地提高了可见光催化产氢效率.由此,引入并调控氧空位成为改善光催化材料活性的重要手段且备受瞩目,因而成为研究的热点之一.氧空位不仅存在于氧化物中,而且存在于所有含氧化合物中.尽管其具有众多优点,如:化学稳定性高、储量丰富、价格低廉和对人体无毒等,许多半导体材料,如:TiO2、SnO2、ZnO、In2O3、WO3、NiO、SrTiO3、BiOCl和 Bi2O2CO3等,因为其禁带宽度均在 3.0eV以上,对可见光响应性十分低,而基本没有可见光催化活性.众所周知,可见光催化活性的改善是当前光催化领域的最重要研究方向之一,也是光催化技术能否实用化的关键.通过氧空位的引入和调控来提高光催化材料活性尤其是可见光催化活性,作为当前光催化研究热点之一,相关实验及模拟计算研究已经取得了重要成果.已有研究结果表明,氧空位与光催化材料的物理化学特性,包括光催化材料的电子结构[3-4]、几何结构[5-6]、吸光特性[7-8]、表面吸附解离特性[9-10]等都有密切关系.一般而言,TiO2表面氧空位的形成能够形成不成对的电子或者 Ti3+,进而导致其电子结构中形成施主能级[11];氧空位的形成导致原来氧原子的位置空缺,进而影响周围的原子进行重排[12-13].此外,因为在价带和导带间形成一个施主能级,导致其具有可见光吸收特性[14-16];氧空位还影响光生电子空穴对的分离和迁移[17-19],进而影响着光催化活性.基于以上原因,发展氧空位调控型光催化材料的可控制备方法并开发出具有高可见光催化活性的氧空位调控型光催化剂是值得期待的.
本文参考相关文献,对氧空位的概念和分类、氧空位对光催化材料物理化学性能的影响、氧空位对光催化性能的影响、氧空位的表征及氧空位的引入和调控方法等进行详尽的总结.希望能够使光催化研究者增强对氧空位的认识,并在高性能光催化材料的设计中有所启发和帮助.
1 氧空位概述
1.1 氧空位的概念
氧空位是指在金属氧化物或者其他含氧化合物中,晶格中的氧原子(氧离子)脱离,导致氧缺失,形成的空位,图 1给出了 TiO2表面氧空位存在及在光催化中作用示意图[20].氧空位是半导体材料尤其是金属氧化物半导体中最常见的一种缺陷,对半导体材料的性能有着重要影响.
1.2 氧空位的分类
按照所处的空间位置不同,氧空位可以分为表面氧空位和体相氧空位[21-22].如果按照氧空位对光催化性能影响不同进行更细致的分类,体相氧空位又可以分为次表面氧空位和体相氧空位两种[23].如果按照束缚电子数进行分类,可以分为束缚双电子型氧空位(有效电荷为 0,即 F中心)、束缚单电子型氧空位(有效电荷为+1,即 F+中心)和无束缚电子型氧空位(有效电荷为+2)[24-25]. 氧空位的种类不同,对光催化材料的物理化学性能以及光催化活性影响亦不同,将在下面的讨论中详细叙述.
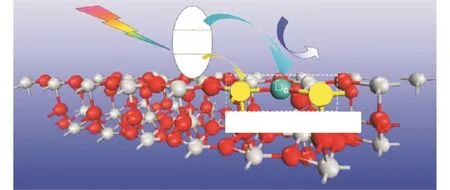
图1 TiO2表面氧空位及在光催化中作用示意图Fig. 1 Schema of oxygen vacancies in the surface of TiO2 and their role
2 氧空位的表征方法
当前,氧空位的表征手段主要有电子显微技术(electron microscopy,EM)和电子顺磁共振技术(electron paramagnetic resonance,EPR).电子显微技术是一种利用高分辨和放大倍率的电子显微镜对材料进行特征分析的分析技术,而应用于氧空位表征的电子显微技术主要有扫描隧道电子显微技术(scanning tunneling electron microscopy,STM)[26-27]和高分辨透射电子显微技术(high-resolution transmission electron microscopy,HRTEM)[28-30].STM 一般用于观察表面氧空位及其与外界分子之间的相互作用,而HRTEM用于观察表面及体相氧空位.图2给出了氧空位的 STM 和 HRTEM 图像[27,31],可以清楚地看出,HRTEM 虽然可以看到氧空位缺陷的存在,但是由于分辨率的限制,得到的氧空位图像信息仍然比较模糊.
电子顺磁共振(EPR)是由不配对电子的磁矩发源的一种磁共振技术,可以定性和定量检测物质原子或分子中所含的不配对电子,并探索其周围环境的结构特性.对自由基而言,轨道磁矩几乎不起作用,总磁矩的绝大部分来源于电子自旋的贡献,所以电子顺磁共振也称为“电子自旋共振”(electron spin reso-nance,ESR),EPR能够准确地确认材料中氧空位的存在与否以及状态[32-34].但是需要注意到,因为 EPR只能检测到不配对电子,所以它只能检测束缚单电子型氧空位,而对束缚双电子型及无束缚电子型氧空位不会产生相应 EPR信号[33].束缚单电子型氧空位对应的 g因子一般介于 2.001~2.004[35-38],如图 3[33]所示.而该 g因子值对应的束缚单电子型氧空位一般认为是处于体相而非表面[22,39-41];表面氧空位因为通常是束缚双电子型而不能被 EPR直接探测到,但是它们能够还原毗邻的 Ti4+形成 Ti3+,所以可以通过光电子能谱分析(X-ray photoelectron spectroscopy,XPS)探测 Ti3+而间接地证实表面氧空位的存在.但是,因为各种原因,很多研究也用EPR表征证明表面氧空位的存在[17,35-36].现有研究表明,表面氧空位对光催化材料物理化学性能有显著影响,因此,其相关的研究也最多.对氧空位位置的表征,现阶段大多采用HRTEM结合EPR的分析方法进行.

图2 氧空位的STM图像和HRTEM图像示例Fig. 2 STM and HRTEM images of oxygen vacancies
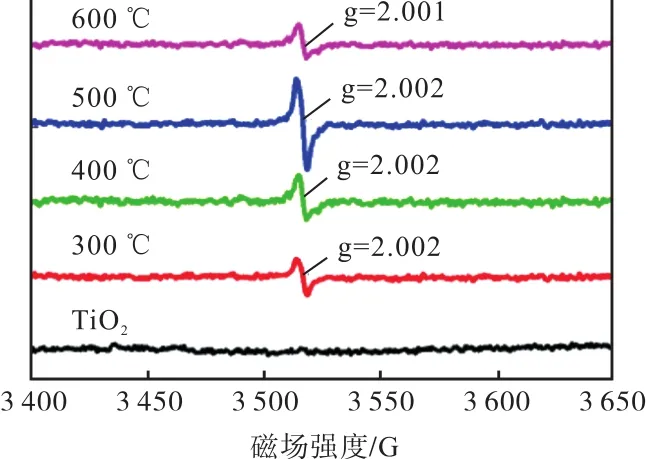
图3 不同温度氢化处理的TiO2样品EPR信号Fig. 3 EPR signals of TiO2 samples prepared at different hydrogenated temperatures
3 氧空位的引入方法
氧空位的引入方法很多,主要有加温氢化法、离子掺杂法、高能粒子轰击法、气氛脱氧法、机械化学力法和化学反应法等.
3.1 加温氢化法
2011年,陈晓波等[2]将纳米 TiO2粉末在高温氢气气氛中煅烧,制得了黑色的带有表面缺陷的 TiO2纳米晶粉末,该黑色粉末表现出极高的可见光催化光解水制氢效率.该方法是利用氢气与 TiO2晶格中的氧反应,产生含氧空位的 TiO2-x与 H2O.分析表明,大量的表面缺陷包括Ti3+以及Ti-H的形成在TiO2的价带和导带间引入了一个中间杂质能级,进而极大地增强了其可见光的吸收及可见光光解水制氢效率,图4给出了制备的黑色 TiO2粉末的外观照片以及高分辨电镜照片等信息[2].该研究也揭开了晶体缺陷改善光催化活性研究的序幕.

图4 高温氢化处理对 TiO2纳米粉末电子态密度、颜色及形貌的影响Fig. 4 Influence of hydrogenation at elevated temperatures on the electronic density,color and morphology of TiO2 nanoparticles
在一定的温度 (一般 100~800℃)将制备得到的含氧化合物光催化材料放置在真空或者低压环境内通入不同流速的氢气,使含氧化合物表面的氧与氢分子发生反应形成水分子,从而在光催化剂的表面甚至是体相中形成氧空位.Chen等[42]将BiFeO3纳米粉末在氢气气氛中加热至120~200℃并保温 8h,制得了含有表面氧空位的纳米粉末. Zhang等[43]将纳米多孔BiVO4薄膜放置在N2/H2混合气体中,400℃加热30min,在其表面以及次表面引入了氧空位.此外,可以经过氢化处理引入氧空位的材料体系还有TiO2[12,44-46]、ZnO[47-48]和WO3[49-50]等.
3.2 离子掺杂法
离子掺杂法作为改善可见光催化活性的常用手段已经使用了超过 30年[51].不管是金属离子还是非金属离子掺杂经常伴随着氧空位的形成.至于此过程中氧空位的形成机制现在仍不是很清楚.2005年,Li等[52]利用喷雾热解法制备了 F离子掺杂的 TiO2粉末,该粉末在可见光催化降解乙醛和三聚乙烯中表现出非常高的活性,可见光催化活性的产生是因为氧空位的引入.PL谱证实伴随着 F离子的掺杂引入了两种类型的氧空位:束缚单电子型氧空位和束缚双电子型氧空位.Rumaiz等[53]和Wu等[54]分别在TiO2中掺杂 N离子增强其可见光催化活性,在引入 N离子的同时引入了氧空位.其可见光催化活性要归因于N离子的掺杂以及氧空位的引入.
除了非金属离子掺杂,金属离子掺杂同样也可以引入氧空位.Jing等[55]利用溶胶凝胶法制备了Zn离子掺杂的 TiO2纳米颗粒,Zn离子的掺杂在 TiO2表面引入了氧空位,表面氧空位的形成对该材料光催化降解苯酚起着至关重要的作用,且表面氧空位越多,其PL谱以及SPS谱(表面光电压)的信号越强,光催化活性越强.Zhang等[56]通过 Zr离子掺杂 Bi2WO6引入氧空位,氧空位作为正电荷中心能够容易地捕获电子,进而延长电子寿命;此外,氧空位的形成有利于O2分子在其表面的吸附,因此有利于吸附的O2分子被捕获的电子还原形成超氧自由基.其他金属离子,如 V5+[57]和 Sn4+[58]等离子的掺杂同样也可以在TiO2晶体中引入氧空位.
3.3 高能粒子轰击法
一系列研究表明:高能电子和离子等能够解离TiO2表面上的氧离子和中性原子,进而产生氧空位.高能电子和离子能够将表面的 Ti—O键打开,进而将O原子或离子移出表面而产生氧空位[59-62].Wang等[59]利用电子束辐照和 Ar+轰击的方法在 TiO2的表面引入氧空位.Yim 等[60]利用电子轰击方法引入并调控金红石型 TiO2表面氧空位及其浓度,同样的结果也得到 Scheiber等[61]和 Stevin等[62]的证实.通过这种方法不仅可以在氧化物中,也可以在其他的含氧化合物中引入氧空位.例如:Ye等[63]以及 Sarwan等[64]利用紫外光辐照的方法在 BiOCl纳米片中引入氧空位.Suwanwong等[65]利用相同方法在 SrTiO3中引入表面氧空位.
除了电子束、离子束和光子束外,等离子体处理也可以引入氧空位.例如:Nakamura等[1]利用等离子体处理在 TiO2中引入了氧空位,并将 NO气体可见光催化降解活性大幅地提高.在制备高性能染料敏化太阳能电池过程中,利用同样的办法也可以将氧空位引入到氧化物中[66-67].
3.4 气氛脱氧法
通过在一定的气氛环境下高温热处理(通常大于 400℃)也可以在 TiO2等氧化物或者其他含氧化合物引入氧空位,这种气氛环境通常是真空[68-70]、Ar[71-72]、N2[73-74]、He[75]气氛.根据氧在接触界面两相间平衡原理,利用标准 Kröger-Vink表示法,高温下氧空位的产生遵循下列的平衡关系:
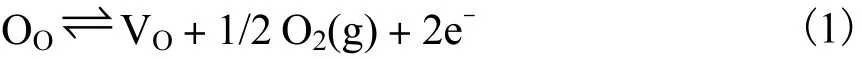
该反应的平衡常数K可以表示为

上式可以变形为

这里 OO表示晶格氧;VO为氧空位;p(O2)为氧分压.从式(3)可以看出,氧空位浓度随着氧分压的降低而增大.因此,欠氧条件下的高温热处理有利于氧空位的形成[21].
3.5 化学反应法
将含氧化合物光催化剂与特定还原剂混合,在室温或者加热条件下,可以将氧从含氧化合物的晶格中抽出形成氧空位.本课题组在前期研究中将 TiO2涂层与碳粉混合,并在空气环境中加热到一定温度形成氧空位和Ti3+,实验结果得到了XPS和EPR等表征手段的证实[76].Yu等[77]将乙二醇作为还原剂在Bi2O2CO3中引入氧空位;Liu等[78]利用 TiCl3作为还原剂在 WO3中引入氧空位;Yan等[79]利用 NaBH4还原CoFe2O4并在其晶格中引入氧空位.
3.6 机械化学力法
通过机械化学力也就是常见的球磨方法,对球磨的粉末施加机械剪切力和压力,在粉末中引入大量的晶格畸变,使氧原子脱离原有的晶格位置而引入氧空位.Daiko等[80]利用行星球磨机实施机械化学力在ZnO表面引入氧空位;同样的研究也证实机械化学力可以在氧化物中引入氧空位[81-83].
4 氧空位对材料物理化学性能的影响
氧空位的引入会对材料的物理化学特性,包括体系的电子结构、几何结构、材料吸光特性以及表面吸附特性等产生重要影响.
4.1 氧空位对电子结构的影响
氧空位对引入体系电子结构的影响通常是利用密度泛函理论(density function theory,DFT)计算与实验相结合的方法进行研究的.通常,单个氧空位的形成会在其位置处有一个或者两个电子局域化.该局域化的电子会对 TiO2电子结构产生直接影响,具体而言就是在 TiO2导带下方产生一个施主能级,该能级位于导带下 0.75~1.18eV,如图 5[1,21]所示.此外,从 TiO2(110)表面桥氧脱离出的中性氧原子在其相邻的五配位 Ti原子的 3d轨道形成了两个局域化的未成对电子[84].DFT计算结果表明,三配位氧空位的形成在 TiO2导带下产生了两个浅施主能级,而一个浅施主能级与两配位桥接氧空位情况下出现的另一个深施主能级耦合[85].总而言之,氧空位的形成还会引起其相邻的 Ti原子过量电子的重新分布,并在Ti 3d轨道形成的导带下形成浅施主能级.在 TiO2中,这些施主能级随着氧空位的增加而增加,甚至会在高氧空位浓度的锐钛矿型TiO2中与导带重叠.

图5 具有氧空位的锐钛矿型TiO2带结构模型Fig. 5 Band structure of anatase TiO2 with oxygen vacancy
4.2 氧空位对几何结构的影响
原来氧原子的位置因为氧原子缺失形成氧空位,这必然会导致周围原子的重排,这从拉曼光谱可以得到证实[86].因为氧原子的缺失,为了增强与其结合的其他晶格部分,其临近的三个 Ti原子趋向于远离氧空位,这种向外驰豫降低了三个 Ti悬挂键间的重叠并且使得Ti—O键的键长变小[87].对Cu2O表面氧空位的研究表明,引入的表面氧空位导致其最接近表面的三个原子层产生驰豫,尽管这种驰豫程度较小,与完美表面相比,这种驰豫是限定在很小范围的,并且主要产生在氧空位的附近[88].也有研究表明,MnO2中大量氧空位的引入可以导致显著的结构扭曲,当有足够的氧空位出现后就会导致一个新相 β-MnO2的形成[89].相比较氧空位对其他物理化学特性的影响,对电子结构及几何结构影响的研究仍然较少.
4.3 氧空位对吸光特性的影响
对光催化剂而言,吸收光线是产生光催化氧化还原反应的必要前提,只有光催化剂吸收了光线,才能在其表面激发产生光生电子-空穴对.然而由于 TiO2其自身禁带宽度较大(金红石型为 3.0eV,锐钛矿型为 3.2eV),只有波长小于 413nm(金红石型)、388nm(锐钛矿型)的光线才能将价带上的电子激发到导带产生光生电子-空穴对,因而,如何让其吸收可见光并激发价带电子成为光催化研究领域最重要课题之一.
通过引入氧空位,在 TiO2的导带下方引入一个施主能级,减小了其禁带宽度,进而将其光吸收边界延伸到可见光甚至是近红外波段[22,90].除了 TiO2这种最常见的光催化剂可以利用引入氧空位增强可见光吸收并提高可见光催化活性外,还有其他一些金属氧化物,如 SnO2[91]、ZnO[8,92]、In2O3[93]、WO3[94-95]和一些含氧化合物,如 Bi2WO6[56,96-99]、SrTiO3[19,100]、BiOCl[101-102]、BiOBr[103-104]和 BiOI[105-106]等,也可以利用该方法进行性能改善.同时也有研究表明,无论是表面氧空位还是体相氧空位,都能够增强可见光的吸收[22];但是在光生电荷的转移过程,两者的作用则截然相反[22].
4.4 氧空位对表面吸附的影响
作为催化反应,反应物无论是液相还是气相,首先必须吸附在光催化剂表面才能进行后面的氧化还原反应,因此,吸附是光催化反应发生的前提条件.其中,最重要也是研究最多的吸附分子包括 O2、H2O、CO2和 N2等,下面将分别就这些分子在含有氧空位的光催化剂表面的吸附情况进行详细讨论.
DFT计算表明[107]:与完美 TiO2表面相比,表面氧空位的引入有利于 O2分子的吸附.氧空位引入过程中产生的过量电子在临近的 Ti离子附近重新分布,外来的 O2可以以超氧态或者过氧化态形式吸附在氧空位.更早的研究[108]表明:在低温条件下,两个O2分子能够化学吸附在一个氧空位上,这些吸附的氧分子即使退火到700K仍然不会脱附;而当退火到200~400K时,这两个O2分子转变为含有四个O原子的其他物种.另一方面,当只有一个 O2分子吸附在一个氧空位上时,加热到150K以上这个氧分子解离而填补氧空位.更有实验研究结果[109]指出,即使温度低至120K,O2分子的解离吸附以及解离后的氧填充氧空位同样可以发生.外界 O2分子不仅与表面氧空位发生作用,也会与次表面氧空位反应[110],在五配位Ti位置处吸附的以超氧态形式存在的O2,通过与氧空位的反应转变为过氧化态.总之,与完美的表面相比,含有表面或者次表面氧空位的带负电的表面更易吸附 O2,且吸附产生的超氧自由基对于促进电荷分离以及氧化有机污染物更有利[21,111].对于表面不存在缺陷的 ZnO而言,O2更容易以物理吸附为主,因为化学解离吸附需要更高的能量.而存在表面氧空位的 ZnO表面,O2的解离吸附从能量上更容易进行,其中的一个氧原子填充原来的氧空位,另一个氧原子位于两个相邻的 Zn原子之间,形成一个桥氧吸附.而该桥氧可以沿着 Zn-O二聚体列扩散并捕获填充另一个氧空位[112].
表面吸附 H2O对光催化剂十分重要,因为表面吸附的 H2O与光催化表面发生相互作用在很大程度上影响着光催化氧化还原反应.STM观察及DFT计算结果表明:表面氧空位的引入可以通过形成桥羟基而解离H2O分子[113],氧空位处H2O分子解离而迅速羟基化,DFT计算表明未成对的桥羟基在TiO2(110)表面是十分稳定的[109].而氧空位与H2O分子发生反应形成羟基的速率则是由 H2O的扩散速率决定的[114].而每个氧空位上吸附的H2O分子的解离是通过将一个质子转移到临近的氧原子形成两个羟基,H2O解离是由氧空位的密度决定的,只要有 H2O分子扩散到氧空位处就可以进行[115].而另一方面,从能量角度而言,H2O的化学解离吸附更易发生在存在表面缺陷的 TiO2表面;而H2O分子物理吸附更易在具有完美的 TiO2表面发生[116-117].不仅表面氧空位,次表面氧空位同样也可以与吸附的 H2O分子发生相互作用[118].当 H2O 吸附在表面时,表面氧空位相比次表面氧空位,从能量上讲变得更加稳定,进而次表面氧空位可以以较小的能垒跃迁到表面.表面氧空位的存在可以极大地方便吸附的 H2O分子发生解离.反应的路径与另一种反应路径具有相似的能垒,这表明次表面氧空位可以直接或者间接地通过表面氧空位使吸附的 H2O分子发生解离.除了 TiO2外,学者们还研究了 SrTiO3[119]、Cu2O[120]和 CeO2[121]等表面H2O的吸附,研究结果表明:氧空位的存在均有利于H2O的解离吸附.
因日益严重的环境问题及全球化变暖趋势,CO2的光催化还原引起了越来越多的重视,但因其较低的转化效率该方面的研究始终没有重大突破.因其较强的键合作用,CO2要实现光催化还原,首先要解决其吸附和活化的问题.DFT计算研究表明[122]:氧空位在锐钛矿型 TiO2(001)表面上的 CO2的解离吸附发挥着重要作用,与完整晶体相比,其吸附位点从四个增加到六个,TiO2表面电荷转移到 CO2,C—O 键尺寸的增大降低了其键能,进而将反应能垒从113.6kcal/mol(475kJ/mol)减小到了最低 45kcal/mol(188kJ/mol);CO2中的一个 O 原子更容易去填补氧空位进而形成 CO.Indrakanti等[123]从量子力学角度出发,利用DFT计算也证明了存在氧空位的TiO2更容易发生电子从基体到 CO2的转移.而 Pipornpong等[9]直接计算出了 CO2分子在无表面缺陷电中性表面物理吸附和存在表面氧空位的自旋非极性表面化学吸附的吸附能分别为-9.03kcal/mol(-37.8kJ/mol)和-24.66kcal/mol(-103kJ/mol);此外,CO2在存在氧空位 TiO2表面的活化能比完美 TiO2晶体表面(001)的要低.
空气中大量的 N2气体为制备 NH3等工业气体提供了充足的原材料,通过光催化可以使水与氮气反应制备氨气.同样,氮气在光催化材料表面的吸附和活化对光催化制氨至关重要.Ye等[124]利用 Bi5O7Br在太阳光辐照条件下制备氨气,氨气产生速率高达1.38mmol·h-1·g-1,表观量子效率超过 2.3%(辐照光波长为 420nm);此外,该研究还表明氧空位有利于 N2分子的化学吸附及 N2的激活.Hirai等[125]的研究也表明,TiO2表面氧空位的引入也同时产生了 Ti3+,而Ti3+作为 N2分子的吸附活性位及光生导带电子的捕获陷阱,促进了N2的还原.
5 氧空位对电荷分离及光催化性能的调控
因为氧空位所处位置不同,对电荷分离的影响亦不同.一般而言,表面氧空位的引入不仅可以在光催化剂的导带下方形成一个缺陷态从而减小其禁带宽度而增大可见光吸收,更可以作为光生电子的捕获中心从而抑制光生电子-空穴对的再复合率,从而提高其光催化性能[12,22,41,44,126-127].光生电子-空穴对的再复合以及载流子寿命可以通过对半导体的稳态及瞬态光致发光光谱测定[128].尽管如此,当氧空位浓度高到一定程度时,氧空位又可以作为电荷复合中心并且降低自由电荷的移动度,进而降低可见光催化活性[19,129].换言之,表面氧空位浓度在改善光催化活性时存在一个最优值,当超过这一数值时,光催化活性会降低.
研究[130]表明:位于锐钛矿 TiO2次表面的氧空位比表面氧空位更稳定;锐钛矿 TiO2(101)氧空位扩散路径计算表明:从表面到次表面的扩散能垒足够低以确保在适当的表面退火温度下氧空位在表面和次表面间的迅速平衡.同时,DFT计算表明[131]:次表面的氧空位很容易扩散到表面形成表面氧空位而直接参与吸附分子的解离及光催化氧化还原反应.
普遍认为:体相氧空位作为光生电子-空穴的捕获中心,增大了光生电荷的复合,使得体相中迁移到表面参与光催化氧化还原反应的有效电荷数量减少[41,132].但同时,体相氧空位的引入可以在导带下方形成一个杂质能级,进而增强材料的可见光吸收[41].另一方面,有研究者认为:体相氧空位的引入,通过增强可见光吸收产生更多的羟基自由基和较小的光生电荷复合率,从而提高可见光催化活性[133].此外,也有研究[134]表明:纳米颗粒的尺寸对氧空位的影响也十分重要,当纳米颗粒直径小于 10,nm时,体相氧空位在改善光催化活性中起主要作用;而当直径大于10,nm 时,表面氧空位在调节光催化性能中占据主导作用.但需要注意的是,光催化反应中涉及到的因素十分多,且这些因素相互影响交织在一起,因此,很难分辨出单一因素的影响,光催化活性反映的是一个综合作用的结果.鉴于此,更有相当一部分学者的研究表明:表面/体相氧空位的比值在光催化活性改善中起到至关重要的作用[22].本课题组的最新研究表明,当表面/体相氧空位的比值在一个适中范围内时,光催化活性比较优异[76].而李远志团队[135]以及李兰东团队[127]的研究表明,光催化活性随着表面/体相氧空位浓度比的提高而得到改善.
6 氧空位的调控方法
氧空位的位置及浓度等参数变化对光催化氧化还原反应有重要影响.一般认为,表面氧空位直接影响有机分子和其他气体分子的吸附[107-110]、对光线的吸收[90]以及光生电荷的分离[126-129],大部分研究都认为表面氧空位的产生可以增强其光催化活性.而体相氧空位虽然可以增强光线的吸收[41],但是更多的是作为光生电子-空穴的复合中心而存在,因而被认为会降低其光催化活性[132].此外,氧空位浓度的不同也会对光催化活性产生可逆性的影响[129].通过不同的方法可以对光催化剂中的氧空位的位置及浓度进行有效调控,进而使其达到设计要求.
通过控制还原性热处理反应的温度和时间改变氧空位的浓度是一种常用的调控方法.Tan等[19]将制备得到的SrTiO3与还原剂NaBH4的混合物放入到氩气中,在 300~375℃条件下热处理 30~60min,可以制备得到含有不同氧空位浓度的 SrTiO3-x.也有研究者通过还原高价态金属氧化物得到含有氧空位的低价态金属氧化物.例如:Wang等[8]将制备得到的ZnO2在空气中不同温度退火不同时间制备氧空位含量不同的ZnO2-x.
一般而言,氧空位的引入均是从表面开始,也就是说先产生表面氧空位,随着处理时间的延长,可能会产生体相氧空位.在适当的退火条件下,体相氧空位可以转变为表面氧空位,但是反之则不能[130-131].目前,通过热处理的方法来改变氧空位位置的研究还未见报道.
7 问题与展望
通过氧空位的引入及调控改善光催化活性,已经取得了较大的成果,也初步掌握了氧空位对于光催化材料的吸附特性、吸光特性、几何及电子结构、光生电荷分离及转移等的过程及其机制.但是,对氧空位的表征仍然缺乏有效手段,所获取的氧空位晶体学信息仍然较少;同时,氧空位所处位置的不同对光催化活性的不同影响及其机制仍然未明;氧空位浓度的影响亦存在争论.这表明氧空位因为所处的环境,稳定性较差,极易被氧化进而降低光催化活性.因此,在今后的研究中,需要进一步探索适合的氧空位表征手段,进一步探索氧空位位置及浓度等因素对光生电荷的分离及转移的影响及其机制,进而确定对光催化活性的影响,找出表面氧空位的稳定方法及策略.
