黑曲霉电子束辐照突变菌的 遗传毒性评价
2018-10-22崔敬爱庄若岩戴碧玮邵智韬陈海燕陈晓平
崔敬爱,庄若岩,戴碧玮,邵智韬,徐 岩,曹 勇,陈海燕,陈晓平,*
(1.吉林农业大学食品科学与工程学院,吉林长春 130118; 2.长春科技学院,吉林长春 130600)
黑曲霉(Aspergillusniger)是一种丝状子囊真菌,在环境中十分常见[1-2]。在自然生长状态下,黑曲霉分泌大量多种用途的酶降解环境中的生物聚合物从而获得营养。电子束辐照黑曲霉突变菌生产的工业酶在淀粉加工、发酵、酿造、饮料生产动物饲料和造纸行业等领域发挥了巨大的作用。此外,黑曲霉突变菌还可以作为异源蛋白的生产宿主及生产柠檬酸和葡萄糖酸的细胞工厂,因其具有高产、高分泌、高安全性等优点,而被广泛地应用于发酵工业中。
电子束辐照黑曲霉是通过电子加速器发射电子束射线通过高能脉冲直接作用在生物细胞内的DNA或通过间接作用使水和小分子物质辐解,进而破坏生物细胞内DNA,使DNA结构发生改变[3-4]。电子束辐照做为应用于食品中的一种新型物理冷加工技术[5],其本身有着独特的特点。电子束诱变育种具有速度高、辐照效率高、不产生放射性残留、单位耗能低、操作方法简单等特点[6],可以通过电子束诱变的方法来获得优良的突变菌株[7]。
近年来,随着辐照技术在食品生产、加工、运输上的广泛应用以及电子束辐照技术作为一种新型的物理冷加工技术在食品生产、加工上的飞速发展[8],电子束辐照已在蔬菜、水果、干果、肉类等保鲜方面有广泛的研究[9-13]。食品辐照技术是对食品纯物理的加工过程[14],加工后的产品不会造成残留和环境危害[15]。但是通过电子束辐照诱变的黑曲霉突变菌的安全性还未有明确的试验证明,电子束诱变后黑曲霉的突变菌株作为食品发酵业的关键酶类[16-17],其安全性也需要进一步的试验证明。黑曲霉在接受电子束辐照后可能会产生一些辐解产物[18],例如一些有毒的醛类物质[19]。为了更好确定电子束辐照后黑曲霉突变菌的安全性,应对辐照后的黑曲霉进行安全性评价。
本实验根据《食品安全毒理学评价程序和检验方法》的规定[20],在前期已经完成电子束辐照后黑曲霉突变菌的急性毒性试验的基础上,通过对小鼠进行Ames试验、小鼠骨髓细胞微核试验、小鼠精子试验对电子束辐照后黑曲霉突变菌进行遗传毒性评价,旨在全面评价电子束辐照后黑曲霉突变菌的遗传安全性,为电子束辐照后黑曲霉突变菌的安全使用提供了可靠的理论依据。
1 材料与方法
1.1 材料与仪器
黑曲霉(编号40099)、察氏培养基 购于CICC工业微生物菌种保藏中心;黑曲霉突变菌(编号40099) 经电子束诱变,从吉林农业大学食品科学与工程学院安全实验室获得;ICR小鼠(许可证号:SCXK(吉)2015-0001),50只7~12周龄的ICR小鼠,雌雄各半,50只6~8周龄的ICR雄性小鼠 辽宁长生生物技术股份有限公司;鼠伤寒沙门细菌营养缺陷型突变株TA97、TA98、TA100和TA102 经基因型和生物学性状检定合格,卫生部食品安全卫生监督检验所提供;磷酸二氢钾、磷酸氢二钠、甲醇、Giemsa染色素 分析纯,上海试剂厂;环磷酰胺 成都市华西生化制品厂;D-葡萄糖-6磷酸钠盐 上海生化所;敌克松 丹东市农药总厂;叠氮钠 江苏晶美生物科技有限公司;2-氨基芴、1,8-二羟基蒽醌 南京恒诺医药化工有限公司;桔霉素、二甲基亚砜 卡迈舒生物科技有限公司;牛血清蛋白(批号:SQ-2010A) 北京依托华茂生物科技有限公司;大鼠肝S9混合液 大鼠肝匀浆经低温离心9000 r/min后所得上清液,复旦大学公共卫生学院。
XSP-4C生物显微镜 上海长方光学仪器有限公司;PH计 上海精密科学仪器厂;低温冰箱 海信容声冰箱有限公司;SW-CJ-IFD超净工作台 苏州净化设备有限公司;JY501电子分析天平 上海蒲春计量仪器有限公司;HH-6电恒温水浴锅 北京长风仪器公司;DNP-9272电热恒温培养箱 上海精宏实验设备有限公司。
1.2 实验方法
1.2.1 制备孢子悬浮液 用生理盐水洗脱斜面试管孢子,180 r/min,30 ℃分散孢子,血球计数板计数,调整黑曲霉孢子浓度到106CFU/mL。
1.2.2 小鼠骨髓细胞微核试验 将50只7~12周龄的健康ICR小鼠适应饲养7 d后,随机分为五组,每组十只,雌雄各半。由于诱变后的黑曲霉突变菌含毒可能性极低,故本研究采用最大剂量耐受法对黑曲霉突变菌进行急性毒性试验[21]。由于小鼠并未产生中毒死亡现象,所以将小鼠的最大耐受剂量设定为20 g/kg。根据小鼠的最高耐受剂量,将黑曲霉孢子悬浮液制备成不同浓度的高剂量组、中剂量组、低剂量组,以二倍梯度分别设计为6.700、3.350、1.675 CFU/mL。灌胃剂量为0.04 g/kg的环磷酰胺为阳性剂量组,蒸馏水为阴性剂量组。每个剂量组分两次对小鼠经口灌胃,每次间隔24 h。在第二次灌胃6 h后通过颈椎脱臼的方法处死小鼠。取出胸骨制作骨髓涂片,干燥后用Giemsa染液染色后在显微镜下观察。每组小鼠涂片在生物显微镜下计数1000个嗜多染红细胞(PCE),并计数出含有微核的嗜多染红细胞[22]。以含微核的PCE千分率计算微核率。每组小鼠涂片计数200个PCE,显微镜下观察并计算出嗜多染红细胞与成熟正染红细胞(NCE)的比值。
1.2.3 Ames试验 本次试验采用常规平板渗入法,采用四株经过鉴定符合要求的鼠伤寒沙门氏菌突变型菌株TA97、TA98、TA100、TA102进行小鼠细菌回复突变试验[23]。整个实验实行无菌操作。本次试验设8、40、200、1000、5000 μg/皿五个试验剂量组,同时设阴性对照组(无菌蒸馏水)、空白对照组、阳性对照组。阳性对照组分别为叠氮钠(TA100,不加S9)、敌克松(TA97、TA98、TA102,不加S9)作为非活化系统和2-氨基芴(TA97、TA98、TA100,加S9)、1.8-二羟基蒽醌(TA102,加S9)作为活化系统。每个剂量做三个平行皿。在相同的试验条件下,重复试验2次,以确定实验数据的准确性。在37 ℃电热恒温培养箱中培养48 h后,直接计数法计算每皿回变菌落数[24]。
1.2.4 小鼠精子畸形试验 选用6~8周龄,体重为25~35 kg的雄性小鼠50只,适应性喂养5 d后,随机分为五组,每组十只。试验设计高剂量组、中剂量组、低剂量组、阴性对照组和阳性对照组五个剂量组[25]。根据小鼠对黑曲霉突变菌的最大耐受剂量计算出,高剂量组为10 g/kg 体重、中剂量组为5 g/kg 体重、低剂量组为2.5 g/kg 体重。阴性对照组(蒸馏水代替药品),阳性对照组(用环磷酰胺代替药品,以40 mg/kg 体重灌胃)[26]。对小鼠经口灌胃,连续5 d每天一次。在首次灌胃后的第35 d,利用颈椎脱臼的方法处死全部小鼠,取出小鼠的两侧副睾,通过制片、染色、干燥后在高倍显微镜下观察其精子形态,每只小鼠观察1000个完整的精子,计算精子畸形率[27-28]。
精子畸形率(%)=精子畸形数/观察精子总数×100
1.3 数据处理
采用SPSS统计软件对Ames每个剂量组的平均数和标准差进行计算。进行t检验和方差分析,并以LSD(least significant difference)法和Duncan-t检验法对各剂量组进行比较,检验是否存在剂量-反应关系。检验的显著性水平设定为p<0.05(显著水平)和p<0.01(极显著水平)。
2 结果与分析
2.1 小鼠骨髓细胞微核试验结果
小鼠骨髓细胞微核试验结果如表1。
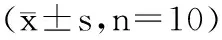
表1 小鼠骨髓细胞微核试验结果Table 1 Micronucleus test results of mouse bone marrow
由表1可见,通过哺乳动物骨髓微核细胞试验发现,雌、雄小鼠的环磷酰胺阳性对照组与蒸馏水阴性对照组的小鼠骨髓细胞微核率具有极显著性差异(p<0.01),该结果表明环磷酰胺具有强烈的致突变效果,阳性对照组可靠,证明本次试验具有可靠性。黑曲霉突变菌各剂量组雌、雄小鼠的骨髓细胞微核率与阴性对照组比较均无显著性差异(p>0.05),并且随着灌胃剂量的增加,微核率并不随之增加,即无剂量-效应关系。此实验结果表明,黑曲霉突变菌的小鼠骨髓细胞微核试验结果为阴性。证明黑曲霉突变菌不能引起哺乳动物嗜多染红细胞的微核细胞率增加,黑曲霉突变菌无致突变作用。
2.2 Ames试验结果
黑曲霉突变菌两次Ames试验结果如表2、表3。
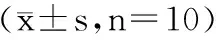
表2 黑曲霉突变菌Ames第一次试验结果Table 2 Aspergillus niger Ames first test
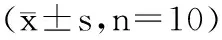
表3 黑曲霉突变菌Ames第二次试验结果Table 3 Aspergillus niger Ames second test
试验结果表明,阳性对照组的细菌回变菌落数均超过空白对照组、阴性对照组和五个试验剂量组的细菌回变菌落数两倍以上。阳性对照组表现出极强的诱变性,阳性对照组可靠,证明本次试验具有可靠性。不同剂量组的黑曲霉突变菌在加S9和不加S9的试验条件下,回变菌落数均未超过阴性对照组和空白对照组的细菌回变菌落数两倍,差异不显著(p>0.05)。两次重复试验得出结果大致相同,即可认为黑曲霉突变菌的小鼠Ames试验结果为阴性。在本次试验条件下,黑曲霉突变菌对小鼠未见致突变作用。
2.3 小鼠精子畸形试验结果
黑曲霉突变菌各剂量组的精子畸形率如表4。

表4 黑曲霉突变菌对小鼠精子畸形试验结果(n=5)Table 4 Test results of Aspergillus niger on sperm abnormality in mice(n=5)
小鼠阳性对照组的精子畸形率与阴性对照组的精子畸形率相比较具有极显著性差异(p<0.01),说明小鼠对环磷酰胺敏感,阳性对照组可靠,证明本次试验结果具有可靠性。小鼠的各个剂量组与阴性对照组的精子畸形率均在正常范围内,通过高倍显微镜对小鼠的精子形态观察,未出现双头、双尾、尾折叠、胖头等畸变类型,黑曲霉突变菌各剂量组精子畸形率与阴性对照组相比无显著性差异(p>0.05)。所以在此试验条件下,黑曲霉突变菌的小鼠精子畸形试验结果为阴性[29-31]。
3 结论
本试验研究中,通过最大耐受计量法测得黑曲霉突变菌属于无毒级别。采用Ames试验、小鼠骨髓细胞微核试验、小鼠精子畸形试验的方法,对诱变后的黑曲霉突变菌的遗传毒性进行测定。结果表明,在Ames试验中,无论是否添加S9,黑曲霉突变菌Ames试验结果均为阴性。表明黑曲霉突变菌无致突变作用。在小鼠骨髓细胞微核试验中,黑曲霉突变菌不能引起哺乳动物嗜多染红细胞的微核细胞率增加,试验结果为阴性,表明黑曲霉突变菌并无致突变作用。在小鼠精子畸形试验中,试验结果为阴性,表明黑曲霉突变菌并未对小鼠的精子产生致畸作用。综上所述,在此试验条件下,经电子束辐照处理后的黑曲霉突变菌属无毒性,并无遗传毒性作用。
