复合酶法高效制备紫菜原生质体的研究
2018-10-22穆惠敏朱常亮沈照鹏江晓路
穆惠敏,朱常亮,沈照鹏,3,孟 蕾,江晓路,3,,*
(1.中国海洋大学食品科学与工程学院,山东青岛 266003; 2.中国海洋大学医药学院,山东青岛 266003; 3.青岛海洋生物医药研究院,山东青岛 266071; 4.青岛明月海藻集团有限公司,海藻活性物质国家重点实验室,山东青岛 266400)
紫菜属于红藻门紫菜属,是一种重要的海洋经济藻类,广泛分布于世界各地,以人工养殖为主,品种较多,坛紫菜、条斑紫菜和甘紫菜为常见养殖种类[1]。近几年来,我国紫菜栽培规模不断扩大,栽培面积增长较快,但是在条斑紫菜良种选育方面发展较为滞后,仍以依靠传统育种为主[2],而我国传统的紫菜养殖基本选用未经遗传改良的自然群体,在育种过程中易出现病烂、产量及质量下降等问题,限制了我国紫菜栽培的发展,故紫菜育种过程中苗种稳定性差及低优质率成为亟待解决的问题[3]。而原生质体作为育种基础研究及作物改良的理想材料[4-6],可极大的缩短育种时间、简化紫菜育种工艺,同时原生质体还是紫菜基因工程与体细胞杂交的良好材料,故而分离高质量的原生质体是进行紫菜育种、原生质体培养和体细胞杂交的先决条件[7-8]。
原生质体的制备主要有机械法和酶解法,其中机械法制备原生质体具有操作条件剧烈、损伤大、收率低等缺点[9-12],而唐延林[13]首次利用一种从食藻性的粒嵘螺消化腺中提取、制备出的复合酶制剂分离紫菜原生质体,但其使用的复合酶制剂不易获得。
本研究利用市场上易于购买的琼胶酶制剂、纤维素粗酶粉等,通过复合酶法制备原生质体,针对一些外在因素如:反应时间、加酶量、酶解温度、转速、盐度、金属离子及酶中各组分的比例设计了实验。采取单因素实验与正交试验,以原生质体的数量为衡量指标,对紫菜原生质体的制备条件进行优化。旨在选取高效的酶解工艺,从紫菜藻体上分离大量活力较高的原生质体,以期促进紫菜遗传育种方面的研究进展。
1 材料与方法
1.1 材料与仪器
条斑紫菜 叶片长2~5 cm,青岛第三海水浴场;琼胶酶制剂(5000 U/mg、货号A6306)、纤维素粗酶粉(700 U/g、货号C2730) 均购于Sigma公司;卡拉胶酶(6.8 U/mL) 由本实验室假交替单胞菌发酵制得;消毒海水 采自青岛第三海水浴场,经过滤除去浮游藻类等固体杂质后,再经煮沸消毒后冷却后使用,含盐量为31.54‰。
TDL-5-A台式离心机 上海安亭科学仪器厂;SHZ-82(A)回旋式水浴恒温振荡器 金坛市科技仪器有限公司;OLYMPUS生物化学显微镜CHC-212-W 上海巴玖实业有限公司;Qi3536血细胞计数器 上海熙扬仪器有限公司。
1.2 实验方法
1.2.1 紫菜材料的前处理 将条斑紫菜在良好的通风状态下阴干,在其含水量在30%左右时冷冻保存于-20 ℃;实验时提前将室温解冻复苏后的紫菜切成不超过2 mm×2 mm的小块,备用。
1.2.2 单因素实验
1.2.2.1 酶解温度对紫菜原生质体制备的影响 将0.5 g处理好的紫菜样品置于100 mL的三角瓶中,加入86.77 U/mL的琼胶酶10 mL和3%(M/M,相对于紫菜质量)的纤维素酶,分别在22、24、26、28、30、32 ℃摇床中,以100 r/min的转速进行避光酶解120 min,测定其原生质体数以确定最适酶解温度。
1.2.2.2 加酶量对紫菜原生质体制备的影响 在最适酶解温度28 ℃下,以不同的加酶量(复合酶液组分参照1.2.2.1)设计2、4、6、8、10、12、14 mL的梯度,加酶量低于14 mL的以消毒海水补至14 mL,分别对0.5 g处理好的紫菜样品进行酶解,测定其原生质体数以确定加酶量。
1.2.2.3 酶解时间对紫菜原生质体制备的影响 在酶解温度28 ℃,加酶量12 mL条件下进行酶解,酶解时间分别为30、60、90、120、180 min,通过测定原生质体数以确定最适酶解反应时间。
1.2.2.4 转速对紫菜原生质体制备的影响 在酶解温度28 ℃,加酶量12 mL,酶解时间100 min条件下,将摇床转速设计成50、75、100、125、150、175、200 r/min的梯度,进行酶解实验,通过测定原生质体数以选出最适的摇床转速。
1.2.2.5 卡拉胶酶对紫菜原生质体制备的影响 分别设计10 mL琼胶酶+2 mL蒸馏水,10 mL琼胶酶+2 mL消毒海水与10 mL琼胶酶+2 mL卡拉胶酶,三组实验中纤维素酶的含量均为3%,在酶解温度28 ℃,加酶量12 mL,酶解时间100 min,转速125 r/min的条件下,进行酶解实验,通过测定原生质体数确定卡拉胶酶对紫菜原生质体制备的影响。
1.2.2.6 复合酶中各组分比率对紫菜原生质体制备的影响 参考1.2.2.5单因素实验中的结果,发现卡拉胶酶对紫菜细胞的细胞壁降解作用不明显,因此复合酶选用琼胶酶与纤维素酶组合。在10 mL酶活为 86.77 U/mL琼胶酶中分别加入1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%、4.5%、5.0%的纤维素酶,之后以海水补足12 mL,以设置不同组分比例的琼胶酶与纤维素酶复合酶液。在酶解温度28 ℃,加酶量12 mL,酶解时间100 min,转速125 r/min的条件下,进行酶解实验,通过测定原生质体数以确定复合酶中各组分最适比率。
1.2.2.7 NaCl浓度对紫菜原生质体的制备的影响 选用NaCl作为影响因素,考虑其对紫菜原生质体渗透压的影响以及对酶活力的影响,设计了2%、3%、4%、5%的NaCl梯度,在酶解温度28 ℃,加酶量12 mL,酶解时间100 min,转速125 r/min,3%纤维素酶的条件下,进行酶解实验,通过测定原生质体数确定最适NaCl浓度。
1.2.2.8 金属离子对紫菜原生质体制备的影响 已知所有酶中大约三分之一的酶需要金属离子的存在才能充分发挥其催化活性[5]。本因素中选取CaC12、FeSO4、MnSO4三种金属阳离子作为研究方向,分别设置0、25、50、75、100 mmol/L的浓度梯度,在酶解温度28 ℃,加酶量12 mL,酶解时间100 min,转速125 r/min,3%纤维素酶、4% NaCl的条件下进行酶解实验。
1.2.3 正交优化试验 经过单因素实验得到了每个因素的最佳值,正交试验因素水平如表1所示。

表1 正交试验因素水平表Table 1 Factors and levelstable of orthogonal experiment
在酶解温度28 ℃、转速125 r/min、3%纤维素酶的条件下,体积不足的13 mL以消毒海水补至13 mL,按照正交实验表进行酶解实验,测定原生质体数。
1.2.4 紫菜原生质体数的计算实验指标的测定均采取三个平行,酶解操作均在避光下进行。酶解结束后,直接取三角瓶中的酶解液,在显微镜下用标准的细胞计数器进行计数。以1 g紫菜样品经酶解得到的原生质体数作为测定结果指标,经过美兰染色活细胞计数[13],换算出酶解样中原生质体的数。
原生质体数=A/5×B×C×25×10000
式中,A为5个中方格中的原生质体总数,B为稀释倍数,C为酶解液的体积。
1.3 数据统计与分析
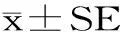
2 结果与分析
2.1 单因素实验
2.1.1 酶解温度对紫菜原生质体制备的影响 如图1所示,酶解温度为22~28 ℃的范围内,紫菜原生质体的分离效果随着酶解温度的升高而提高;当超过28 ℃后,紫菜原生质体的总量减少。这是因为,随着酶解温度的升高,分离产生的原生质体被高温所破坏,或者是酶解温度促进酶的催化效率,使其对原生质体的进一步降解。有报道称,分离原生质体时的最适酶解温度以26~30 ℃为宜[14],考虑到琼胶酶与纤维素酶的最适酶解温度皆高于32 ℃[15],选择28 ℃作为原生质体酶解制备的酶解温度。
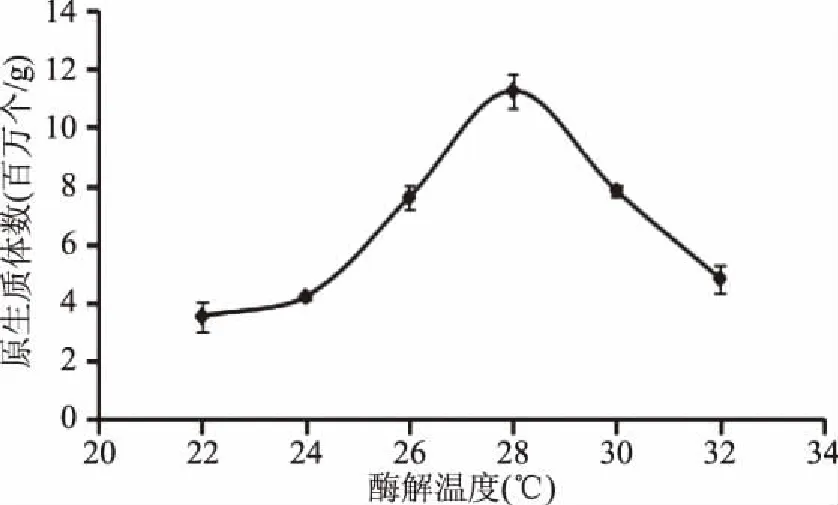
图1 酶解温度对紫菜原生质体制备的影响Fig.1 Effect of temperature on the preparation of protoplast of seaweed
2.1.2 加酶量对紫菜原生质体制备的影响 由图2可知,加酶量在0~12 mL范围内,随着加酶量的增加,原生质体数逐步增加;在12 mL时效果最佳;当加酶量大于12 mL时,原生质体总数随着加酶量的增加反而减少。这是因为,随着加酶量增加,过量的酶进一步与生成的紫菜原生质体壁结合而酶解破坏,使原生质体总数减少。故本实验选择的加酶量为12 mL。

图2 加酶量对紫菜原生质体制备的影响Fig.2 Effect of enzyme amount on the preparation of protoplast of seaweed
2.1.3 时间对紫菜原生质体制备的影响 由图3可知,时间对紫菜原生质体的分离效果明显,0~120 min范围内,随着时间的增长原生质体数增大;在100 min原生质体数达到最佳值;而随着酶解时间的进一步延长,原生质体的破坏程度进一步加深,从而使得原生质体总数下降,故选择酶解时间为100 min。

图3 酶解时间对紫菜原生质体制备的影响Fig.3 Effect of enzymatic hydrolysis time on the preparation of protoplast of seaweed
2.1.4 转速对紫菜原生质体制备的影响 由图4可知,不同摇床转速下酶解的效果明显在50~125 r/min范围内,随着转速的增大,复合酶得以与紫菜细胞壁充分结合,加速酶解反应效率,从而使得酶解分离的原生质体增多;在125 r/min时原生质体数达到最大。当转速进一步增大时,原生质体总数急剧减少。这是因为,随着摇床转速的增加,剪切力增大,破坏原生质体,造成原生质体数量减少。故本实验选择的转速为125 r/min。
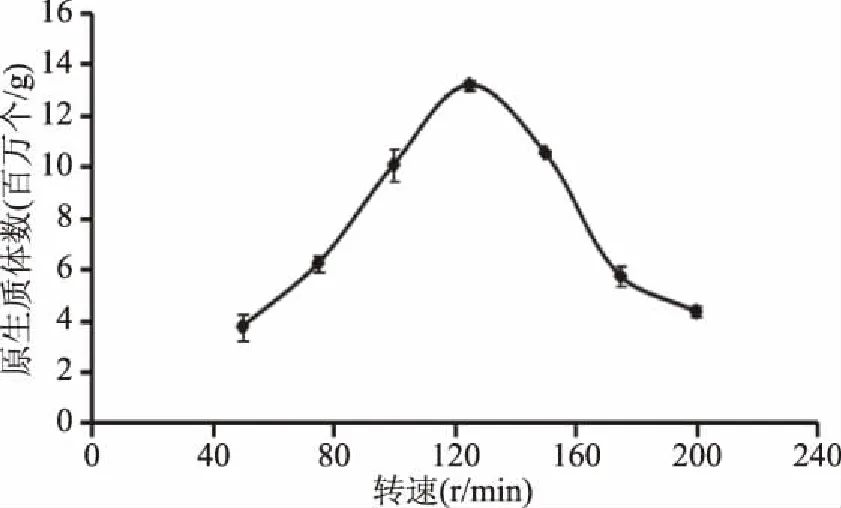
图4 转速对紫菜原生质体制备的影响Fig.4 Effect of rotating speed on the preparation of protoplast of seaweed
2.1.5 卡拉胶酶对紫菜原生质体制备的影响 由图5所示,卡拉胶酶的有无对紫菜原生质体分离效果明显。纤维素与紫菜多糖是紫菜属海藻细胞壁中主要的多糖成分[16],其较紫菜多糖主要分为紫菜胶和琼胶两大类[17],故卡拉胶在紫菜细胞壁中含量极少,卡拉胶酶的酶解效果并不明显,故出于经济效益与实验操作的有效性,本实验中混合酶液不再考虑卡拉胶酶。

图5 卡拉胶酶对紫菜原生质体制备的影响Fig.5 Effect of compound enzyme on the preparation of protoplast of seaweed注:1:不加卡拉胶酶(补加蒸馏水);2:加卡拉胶酶; 3:不加卡拉胶酶(补加消毒海水)。
2.1.6 复合酶中各组分比例对紫菜原生质体制备的影响 由图6可知,在1.0%~3.0%范围内,随着纤维素酶含量的提高,酶解原生质体数升高;在纤维素酶含量为3.0%处出现拐点;当纤维素酶含量大于3.0%时,原生质体数的增长趋势趋缓,这是因为,酶与底物的结合程度趋于饱和,酶解反应速度增长减缓。综合各因素考虑,选取3.0%为纤维素含量最适值。
图6 复合酶中各组分比例对紫菜原生质体制备的影响Fig.6 Effect of components ratio of complex enzyme on the preparation of protoplast of seaweed
2.1.7 NaCl浓度对紫菜原生质体的制备的影响 由图7可知,在NaCl浓度为4%的条件下,酶解得到原生质体数最多,可能是因为,随着NaCl浓度的增加,反应体系渗透压变大,有利于原生质体的稳定性,减少了分离的原生质体的损失;而NaCl浓度的进一步增大可能对酶的活力有所抑制,从而导致过高盐度下酶解效果的不佳,故NaCl浓度过大过小都会直接影响体系中渗透压的大小,影响紫菜原生质体制备,故本实验选择的NaCl浓度为4%。

图7 NaCl浓度对紫菜原生质体制备的影响Fig.7 Effect of compound enzyme on the preparation of protoplast of seaweed
2.1.8 金属离子对紫菜原生质体的制备的影响 如8所示,金属离子Mn2+、Fe2+、Ca2+的存在对酶活力有所抑制,其中Ca2+的抑制作用最为突出,可能是因为金属离子与酶的结合,改变了空间构象影响到酶的生物催化活性[18],这与报道分析所认为的琼胶酶的三维结构与催化特性使其对这三种金属离子具有非依赖性的结果相一致。同时发现,金属离子对琼胶酶具有抑制作用,且加酶量的增加会造成分离原生质体的破坏,故应减少金属离子对原生质体的制备造成的不利影响[19-21]。

图8 金属离子对紫菜原生质体制备的影响Fig.8 Metal ions on the impact of laver protoplast formation
2.2 正交优化试验
通过极差(表2)与方差(表3)分析结果可知,各因素对紫菜原生质体制备的影响的主次顺序为C>B>A>D,即NaCl浓度>酶解时间>加酶量>空白,且NaCl浓度(p<0.05)、酶解时间(p<0.01)对其影响显著,加酶量(p>0.05)无显著影响。通过分析四个因素的均值得知,最佳的组合为A2B2C3,即加酶量12 mL,酶解100 min,NaCl浓度为4%。因此得到紫菜原生质体的最佳条件为:酶解时间28 ℃,转速125 r/min,3.0%纤维素酶,NaCl浓度4%,加酶12 mL,酶解时间100 min。

表2 紫菜原生质体酶解正交实验结果分析Table 2 Analysis of laver protoplast digestion orthogonal experiment

表3 正交试验方差分析Table 3 Analysis of orthogonal test variance
因正交试验的最优组合并未出现在正交试验中,为进一步考察上述优选工艺的稳定性,按上述优化条件A2B2C3进行重复三次实验,结果为(16.88±0.22)×106个/g,均高于正交试验最高值,所以说明选择A2B2C3为最优组合,同时也表明此工艺具有较好的稳定性。
3 结论
紫菜细胞壁中含有琼胶、纤维素,需要专一性水解多糖的工具酶,本研究所用的酶制剂可以专一高效的作用于紫菜细胞壁。实验发现复合酶的水解效果要远高远单一酶的水解效果,故本研究在单因素实验的基础上,选取加酶量、酶解100 min与NaCl浓度三个因素进行正交试验,进一步得出复合酶液法高效制备紫菜原生质体的最佳工艺,即4% NaCl浓度,酶解时间100 min,加酶量12 mL,酶解温度28 ℃,转速125 r/min,3%纤维素酶,且在最优工艺条件下酶法制备的原生质体数达(16.88±0.22)×106个/g。复合酶法反应条件温和、操作简单,同时可以高效制备高存活率的原生质体,为紫菜育种、原生质体培养和体细胞杂交等研究工作奠定基础。
