沙门氏菌及副溶血性弧菌的 共增菌培养基的研制
2018-10-22秦鲜菊徐思源宁喜斌
晨 凡,秦鲜菊,徐思源,宁喜斌,2,3,4,*
(1.上海海洋大学食品学院,上海 201306; 2.上海海洋大学,食品科学与工程国家级实验教学示范中心,上海 201306; 3.上海水产品加工及贮藏工程技术研究中心,上海 201306; 4.国家淡水水产品加工技术研发中心(上海),上海 201306)
食源性致病菌是引起食源性疾病的主要因素之一,在世界食品安全领域中备受关注。世界卫生组织(WHO)最新研究报告表明,在2015年全球有5600多万人死亡,其中约有139万人死于腹泻病[1]。在众多食源性致病菌中,沙门氏菌与副溶血性弧菌最受关注。2008~2015年间,我国共有1597起食物中毒事件,其中由食源性致病菌引起的食物中毒占总中毒人数的62.02%,而在所有致病菌中,沙门氏菌和副溶血性弧菌分别在常见微生物食物中毒占比23%和21%,分别为第一和第二位[2-3]。
近年来,在食源性致病菌快速检测方面,检测方法主要涉及免疫学、代谢学、以DNA探针等技术为代表的分子生物学等,较之传统国标法检测,具有较高的特异性和灵敏性。现代技术如多重PCR、基因芯片等,甚至可以实现同一平台上对多种致病菌的检测[4-7]。同时,检测方法的快速发展也要求样品前处理步骤更加快捷,在食源性致病菌的检测过程中,仍需要对目标菌进行富集培养,但是不同的致病菌有特定的前增菌步骤,沙门氏菌等菌株更是需要进行多步增菌过程,较为费时、费力[8]。因此,研制可同时富集多种致病菌的共增菌培养基成为研究的热点,这对于提高致病菌共检技术的效率具有重要意义。沙门氏菌和副溶血性弧菌均为食品中重要的致病菌,研究其共增菌技术对于控制其疾病的传播及预防相应的食物中毒具有重大意义。
目前国内外研究中,涉及多种致病菌共增菌培养基的研究已有:沙门氏菌、志贺氏菌和金黄色葡萄球菌的共增技术[9],沙门氏菌、大肠杆菌和金黄色葡萄球菌的共增技术[10],沙门氏菌、大肠杆菌和单增李斯特氏菌的共增技术[11],沙门氏菌、金黄色葡萄球菌和单增李斯特氏菌的共增技术[12]等,其中大部分培养基选择性增菌能力不强,不能满足对目标菌进行富集的要求。翁思聪等[13]研究了一种选择性富集沙门氏菌、志贺氏菌、金黄色葡萄球菌和副溶血性弧菌共增菌培养基,由于其共增菌的菌株种类较多,菌株间存在较为复杂的抑制和共生关系,容易影响检出效率和重复率。沙门氏菌和副溶血弧菌均为革兰氏阴性菌,需氧或兼性厌氧,营养需求不高,且两种细菌均可利用葡萄糖、柠檬酸和甘露醇作为碳源,因此可在同种培养条件下迅速生长,两者在同一选择性增菌环境中共增菌具有现实的可行性,且更具有针对性。
本实验对富集沙门氏菌和副溶血性弧菌两种引起食源性疾病致病菌的共增菌培养基进行了研究,对其增菌效果进行了初步的评估验证,并根据目标菌不同的营养需求,筛选适宜抑制剂和促进剂,进行单因素实验,确定共增菌培养基的配方,最后验证该培养基的增菌效果,以得到具有较优增菌效果的共增菌培养基,为今后检测方法的修订提供必要的依据。
1 材料与方法
1.1 材料与仪器
沙门氏菌(Salmonellaenteritidis,Se)CMCC 15611、副溶血性弧菌(Vibrioparahaemolyticus,Vp)ATCC 13847 均为本研究室保藏;营养肉汤、营养琼脂培养基 分析纯,用于食品及其他物品检验中的菌落计数(上海疾控)上海华康科技开发公司;木糖赖氨酸脱氧胆盐琼脂(Xylose lysine deoxycholate agar,XLD) 分析纯,用于沙门氏菌的选择性分离,北京陆桥技术有限责任公司;硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂(Thiosulfate citrate bile salts sucrose agar,TCBS) 分析纯,用于致病性弧菌的选择性分离,青岛高科园海博生物技术有限公司;蛋白胨 分析纯,生工生物工程(上海)股份有限公司;磷酸氢二钾、柠檬酸钠(Na3C6H5O7·2H2O)、硫代硫酸钠(Na2S2O3·5H2O)、氯化钠、葡萄糖、甘露醇 分析纯,国药集团化学试剂有限公司;牛胆盐 分析纯,广东环凯微生物科技有限公司。
THZ-300恒温培养摇床、THZ-300隔水式培养箱9270 上海一恒科技有限公司;InoLab pH730台式pH测量仪 德国WTW公司;UV-1100型紫外可见分光光度计 上海美谱达仪器有限公司。
1.2 实验方法
1.2.1 基础培养基的选择 参照沙门氏菌、副溶血性弧菌在食品安全国家标准GB 4789.4-2016及GB 4789.7-2013中规定的增菌培养基配制方法,分别列出其中的成分及含量,参考刘园园等[12]方法,去除培养基中具有选择性的组分,并根据两种细菌生长所必要的成分确定共增菌培养基的基础成分。
1.2.2 共增菌培养基中单因素成分的筛选 根据两种细菌营养需求和抑制条件的不同,参考之前的研究[11-12]和两种目标菌各自选择培养基中的特异成分,筛选不同的抑制剂和促进剂进行实验。将添加成分列为:葡萄糖、柠檬酸钠、硫代硫酸钠、甘露醇、氯化钠、牛胆盐。根据方法1.2.1配制基础培养基,取四支试管编号1~4号,其中1号试管作为空白对照,只加入基础培养基4 mL,2、3、4号试管分别加入含低浓度、中浓度、高浓度添加成分的基础培养基4 mL(见表2),分装后高压灭菌备用。将沙门氏菌和副溶血性弧菌分别接入不同添加成分的培养基中,在37 ℃,120 r/min下摇床振荡培养24 h,用紫外可见分光光度计测定在600 nm波长处的光密度OD值,以此确定适宜添加成分及适宜添加量,制备共增菌培养基。
1.2.3 目标菌增菌效果的验证 以102CFU/mL作为目标菌初始接种量,将沙门氏菌及副溶血性弧菌分别接种至共增菌培养基中,于37 ℃摇床中振荡培养24 h。分别取0、2、4、6、8、10、12、14、16、18、20、22、24 h时的菌液1 mL,加入9 mL生理盐水中,制成1∶10稀释液,以此类推,分别进行适宜梯度稀释,每个梯度平行三次,平板涂布至XLD及TCBS培养基中,置于37 ℃培养箱中培养24 h,对平板进行菌落计数,并乘以对应的稀释倍数,得出总菌落数,绘制目标菌生长曲线并分析结果。由于营养肉汤没有特定选择性,且沙门氏菌和副溶血性弧菌均可在营养肉汤中生长,故以营养肉汤增菌液作为对照组,重复上述操作,得出对照组生长曲线。并以102CFU/mL为初始接种量,将沙门氏菌及副溶血性弧菌以1∶1比例一同接种至共增菌培养基中,于37 ℃摇床中振荡培养24 h并稀释涂布平板,观察目标菌生长情况并计算菌落总数,实验平行三次,同样以营养肉汤作为对照组,验证培养基共增菌效果。
1.3 数据处理
利用IBM SPSS Statistics 22.0软件进行数据统计,对培养基不同成分添加后目标菌的生长情况进行单因素显著性差异分析,对目标菌在共增菌培养基及对照组中的增菌情况进行配对T检验,进行显著性差异分析。
2 结果与分析
2.1 基础培养基的筛选
根据GB 4789.4-2016及GB 4789.7-2013,对目标菌增菌培养基成分进行比较,结果如表1所示。由表1分析可知,蛋白胨为沙门氏菌和副溶血性弧菌提供氮源和能源,参照国标,其含量取10.0 g为宜,氯化钠在增菌液中起到调节渗透压的作用,而磷酸二氢钾的添加可以稳定菌体生长过程中pH的变化[10],综合考虑两种目标菌的基本生长条件及配制简便性,取氯化钠5.0 g,磷酸氢二钾1.5 g为适宜含量,得出共增菌培养基的基础成分为:蛋白胨10.0 g,磷酸二氢钾1.5 g,氯化钠5.0 g,蒸馏水1000 mL。将以上成分进行分装,振荡摇匀,调节pH至7.2~7.4,于1×105Pa高温灭菌15 min后置于4 ℃保存备用。

表1 目标菌增菌培养基成分比较Table 1 Comparison of enrichment medium compositions of target bacteria
2.2 共增菌培养基添加成分及含量
添加抑制剂和促进剂的增菌液按浓度从低到高进行排列,成分及添加浓度如表2所示。

表2 各添加成分及其添加量Table 2 Additive amount of different candidate agents
将目标菌接种培养后,在基础培养基中培养24 h后,沙门氏菌的OD600值为0.523±0.014,副溶血性弧菌的OD600值为0.332±0.007,以此作为空白对照。在添加不同成分的基础培养基中培养24 h后,两种目标菌的OD600值如表3所示。

表3 各添加成分对两种目标菌生长的影响Table 3 Effect of different candidate agents on the growth of two target bacterias
对抑制剂单因素实验的结果显示,硫代硫酸钠的添加对沙门氏菌和副溶血性弧菌的生长均起到明显的作用。当硫代硫酸钠的添加量不大于5.0 g/L时,沙门氏菌受到显著促进作用,而副溶血性弧菌受到显著抑制作用(p<0.05),当硫代硫酸钠添加量达到10.0 g/L时,沙门氏菌和副溶血性弧菌均受到显著的抑制作用,综合考虑,硫代硫酸钠的适宜添加量为5.0 g/L。不同浓度的氯化钠对两种目标菌的作用不同。对于沙门氏菌而言,氯化钠浓度越高,对其生长的抑制作用越强,而氯化钠浓度为2%~4%时,对副溶血性弧菌的生长最为适宜[15]。当氯化钠添加量为2.5 g/L时,由于基础培养基中已添加5.0 g/L氯化钠,此时氯化钠的总浓度为7.5 g/L,沙门氏菌OD值为0.703±0.013,副溶血性弧菌为0.721±0.009,两种目标菌的生长较对照组显著增加(p<0.05);但当氯化钠添加量为5.0 g/L,总浓度达10.0 g/L时,沙门氏菌的OD值降到0.450±0.008,其生长受到显著抑制(p<0.05),由此可知,为了使沙门氏菌和副溶血性弧菌在相同增菌时间内均达到检测限,氯化钠浓度不能达到副溶血性弧菌最适浓度,适宜添加量为2.5 g/L。牛胆盐作为一种革兰氏阳性菌的生长抑制剂[16],在0.1 g/L以下的浓度时,对沙门氏菌和副溶血性弧菌等革兰氏阴性菌生长的影响不大,但高于此浓度会使抑制作用显著增强(p<0.05),因此0.1 g/L为牛胆盐的适宜添加量。
对促进剂单因素实验的结果显示,柠檬酸钠在1.25~2.5 g/L浓度范围内,可以促进沙门氏菌和副溶血性弧菌的生长,但当添加量达到5.0 g/L时,其促进作用不显著(p>0.05),表明柠檬酸钠的促进作用有限,其适宜添加量为2.5 g/L。在1.25~5.0 g/L浓度范围内,相较对照组,甘露醇对沙门氏菌和副溶血性弧菌有显著的促进作用(p<0.05)。当添加量为5.0 g/L时,甘露醇对沙门氏菌仍有显著的促进作用(p<0.05),但对副溶血性弧菌的促进作用不显著(p>0.05)。葡萄糖作为一种碳源,其添加对两种细菌的生长均可起到一定程度的促进作用[17],根据表中结果分析,葡萄糖最适宜的添加量为2.5 g/L,此浓度对沙门氏菌和副溶血性弧菌的促进效果均显著。
综上所述,最终确定共增菌培养基的添加成分及其含量为:蛋白胨10.0 g、磷酸二氢钾1.5 g、氯化钠7.5 g、硫代硫酸钠5.0 g、牛胆盐0.1 g、柠檬酸钠2.5 g、甘露醇2.5 g、葡萄糖2.5 g、1000 mL蒸馏水。配制后充分混匀,调节pH为7.2~7.4。将该培养基命名为SV(Salmonella-Vibrioparahaemolyticus)富集培养基。
2.3 目标菌在共增菌培养基中增菌效果的验证
沙门氏菌和副溶血性弧菌在SV培养基和营养肉汤培养基(对照组)中分别增菌的结果如图1和图2所示。

图1 沙门氏菌在营养肉汤(对照) 和SV增菌液中24 h内生长情况Fig.1 Growth of Salmonella in nutritional broth(control)and SV broth within 24 h
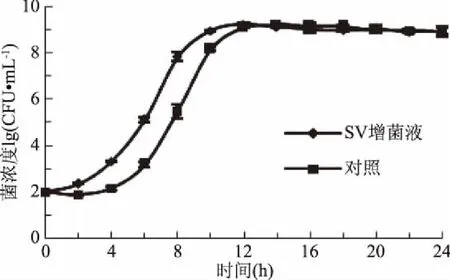
图2 副溶血性弧菌在营养肉汤(对照) 和SV增菌液中24 h内生长情况Fig.2 Growth of Vibrio parahaemolyticus in nutritional broth and SV broth within 24 h
由图1可知,较高氯化钠浓度造成的高渗环境对沙门氏菌的生长起到抑制作用,沙门氏菌在SV培养基中的生长速率略慢,生长对数期相对于对照组滞后。
表4列出了沙门氏菌在两种培养基中每4 h时的菌浓度,由表中数据分析可知,在SV培养基中培养16 h时,沙门氏菌达到最高生长浓度可达108CFU/mL,与对照组109CFU/mL存在显著性差异(p<0.05),表明沙门氏菌在SV增菌液中增菌效果低于对照组。

表4 沙门氏菌在营养肉汤(对照)和SV增菌液中生长差异性比较Table 4 Comparison of Salmonella growth differences in nutritional broth(control)and SV broth
与沙门氏菌相比,副溶血性弧菌受到盐浓度的抑制作用较小,由图2可知,副溶血性弧菌在SV培养基中培养时,约2 h就能进入对数期,且在增菌10 h时菌浓度达到最高值,相比对照组增效明显,表明SV增菌液比对照组更适于Vp。
表5中数据显示,在4、8 h时,SV培养基中的菌液浓度同对照组比,存在显著性差异(p<0.05),当增菌时间到达16 h时,SV增菌液和对照组中菌液浓度均达到109CFU/mL,差异不显著性(p>0.05),表明副溶血性弧菌在SV增菌液中增菌效率比对照组高。

表5 副溶血性弧菌在营养肉汤(对照)和SV增菌液中生长差异性比较Table 5 Comparison of Vibrio parahaemolyticus growth differences in nutritional broth(control)and SV broth
将沙门氏菌及副溶血性弧菌以1∶1比例一同接种至SV培养基及营养肉汤中,经过24 h增菌培养后,沙门氏菌菌落总数可达到107CFU/mL,副溶血性弧菌菌落总数可达到108CFU/mL(见图3),相比对照组,沙门氏菌在增菌24 h后菌浓度可达到107CFU/mL,而副溶血性弧菌在增菌24 h后菌浓度为106CFU/mL,表明SV培养基对沙门氏菌和副溶血性弧菌的共增菌效果优于营养肉汤。较翁思聪等[13]研究结果中,沙门氏菌和副溶血性弧菌在SV培养基中共同增菌时生长更为旺盛,可达到后续检测的检测限。
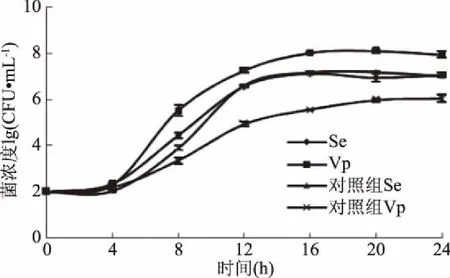
图3 沙门氏菌和副溶血性弧菌在SV培养基 及对照组中共增菌生长情况Fig.3 Simultaneous growth of Salmonella and Vibrio parahaemolyticus in SV broth and control broth
3 讨论与结论
本研究通过对GB 4789.4-2016及GB 4789.7-2013中沙门氏菌和副溶血性弧菌选择性增菌液成分的筛选以及两种目标菌营养需求的分析配制了合适的基础增菌液,并对共增培养基中促进剂和抑制剂进行了筛选,最终配制出可同时富集沙门氏菌和副溶血性弧菌的共增菌SV培养基。本研究中的两种目标菌均为革兰氏阴性细菌,因而在设计SV培养基时,添加了硫代硫酸钠、牛胆盐等革兰氏阳性菌抑制剂,同时添加适宜浓度的氯化钠,使两种目标菌能以相对一致的速度生长。柠檬酸钠、甘露醇、葡萄糖等可作为细菌的生长因子,对沙门氏菌和副溶血性弧菌的生长起到促进作用。本研究中对照组营养肉汤NB为通用型肉汤培养基,无法实现几种目标菌的共同增菌[18],且国标中各个菌株的选择性增菌液只能满足单一菌种的增菌,而SV培养基可同时对沙门氏菌和副溶血性弧菌两种目标菌进行富集,成分相对简单,配制简易,针对性较强。同时可在此基础上进一步研究目标菌的多重PCR等技术,实现快速检测的需求。
本研究结果表明,研制出用于沙门氏菌和副溶血性弧菌的共增菌培养基成分为:蛋白胨10.0 g,磷酸二氢钾1.5 g,氯化钠7.5 g,硫代硫酸钠5.0 g,牛胆盐0.1 g,柠檬酸钠2.5 g,甘露醇2.5 g,葡萄糖2.5 g,蒸馏水1000 mL。当目标菌初始浓度为102CFU/mL时,将沙门氏菌与副溶血性弧菌以1∶1比例接种至SV培养基中,37 ℃培养24 h后,菌浓度可分别达到107CFU/mL和108CFU/mL,其共增菌效果优于营养肉汤。本研究研制的SV共增菌培养基可同时富集沙门氏菌和副溶血性弧菌两种目标菌,满足目标菌检测的要求,且增菌培养基成分相对简单,成本较低,具有良好的市场前景,也为今后检测方法的修订提供了一定的依据。
