一株产γ-PGA的芽孢杆菌的 分离鉴定及发酵条件的优化
2018-10-22李晨霞孙丽慧
李晨霞,梁 晶,孙丽慧
(大连理工大学食品与环境学院,辽宁盘锦 124221)
γ-聚谷氨酸(γ-glutamic acid,简称γ-PGA),是由D-谷氨酸和L-谷氨酸单体,通过γ-酰胺键连接而成的一类均聚氨基酸[1],最先发现于炭疽杆菌的荚膜中[2]。γ-PGA是一种水溶性、可被生物降解、不含毒性的大分子聚合物,其分子链上大量游离的羧基,使其具有羧基聚合物的普遍性质。此外,大量活性位点使它便于进行材料的功能化[3-4]。聚谷氨酸的应用范围十分广泛,分为化妆品级、食品级、药品级、水处理级、土壤、植物调节剂级等[5-6]。尤其在注重环保、强调可持续发展的社会大环境下,由生物合成的可降解功能型材料γ-PGA,正日益受到人们的关注,逐渐地应用于医药制造[7]、食品加工、果蔬产品、海产品的防冻和保鲜,以及化妆品工业及植物种子保护等许多领域,是一种开发价值大、应用前景广阔的多功能新型生物材料[8],具有重要的研究价值。
目前合成γ-PGA的方法有化学合成法和生物合成法[9-10]。利用微生物发酵合成γ-PGA具有其独特的优点,例如:经济高效、对环境污染小、反应条件温和等。在γ-PGA的微生物发酵生产中,培养基的组成以及对发酵条件的控制都会显著影响γ-PGA的分子结构组成、相对分子量以及产率。尽管国内外众多学者已经在发酵法生产γ-PGA上取得了很多的研究成果,但目前研究中仍存在着一些不足之处,或是底物谷氨酸钠的利用率低;或是发酵产量比较低,这些问题都不利于γ-PGA的工业化生产。
本文从豆腐作坊周边的土地取样,筛选获得一株高产γ-PGA的暹罗芽孢杆菌,并通过单因素实验和响应面法对其发酵条件进行优化,提高了γ-PGA的产量和转化率,为发酵生产γ-PGA的工业化提供一定的基础。
1 材料与方法
1.1 材料与仪器
土样品 辽宁省某村庄豆腐作坊周边的土壤取样,表层土,下挖5 cm和10 cm的土;PCR扩增细菌16S rDNA的试剂盒、PCR裂解液 宝生物工程(大连)有限公司;革兰氏染色液试剂盒 青岛海博生物技术有限公司;牛肉膏、胰蛋白胨、酵母膏、琼脂、D-甘露糖、D-核糖、L-鼠李糖 北京奥博星生物技术有限责任公司;味精(谷氨酸钠含量≥99%) 红梅味精有限公司;玉米浆 实验室自制;其他试剂 均为分析纯。
梅里埃VITEK 2 COMPACT全自动微生物鉴定仪 法国梅里埃公司;麦氏比浊仪 法国梅里埃公司;SW-CJ-2FD洁净工作台 苏州安泰空气技术有限公司;HPX-9272MBE电热恒温培养箱 上海博讯实业有限公司;ZWY-1102C恒温培养振荡器 上海智城分析仪器制造有限公司;DF-101S集热式恒温加热磁力搅拌器 重庆东悦仪器有限公司;光学显微镜 宁波永新光学股份有限公司;SBA-40C生物传感分析仪 山东省科学院生物研究所。
1.2 实验方法
1.2.1 培养基的配制 分离平板培养基(g/L):Na3C6H5O716,C5H8NO4Na 40,NH4Cl 7,K2HPO40.5,MgSO40.5,CaCl20.16,MnSO40.104,FeCl30.104,酵母膏5,琼脂20,甘油16,pH7.0~7.4,115 ℃灭菌20 min;液体发酵培养基(g/L):C5H8NO4Na 80,NH4Cl 7,MgSO40.5,K2HPO40.5,MnSO40.104,CaCl20.05,葡萄糖45,胰蛋白胨40,酵母膏20,pH7.0,115 ℃灭菌20 min;种子培养基(g/L):葡萄糖10,蛋白胨10,酵母膏5,NaCl 5,pH7.0,115 ℃灭菌20 min。
1.2.2 菌株的筛选 取适量土样加入30 mL无菌水中,充分振荡后静置2 h,取上层清液100 μL,与900 μL无菌水混合均匀,按此方法进行浓度梯度稀释,选择进行涂布的稀释度为10-4、10-5、10-6、10-7,每个稀释度涂3个平板作为平行,每个平板接种200 μL,37 ℃培养24 h。待平板长出菌落,对长势较好的单菌落进行编号,依次接种到液体发酵培养基中,37 ℃,220 r/min培养36 h。参照文献[11]的方法测定γ-PGA的产量,检测发酵液中γ-PGA的含量,选取γ-PGA含量最高的菌株,进行进一步纯化至纯种并保藏,以待后续研究。
1.2.3 菌株的保藏 按2%的接种量[9],将上述发酵液接种至种子培养基中,37 ℃,220 r/min培养18 h。将种子培养基与40%的甘油1∶1混合,于-20 ℃冷冻保藏。
1.2.4 菌株鉴定
1.2.4.1 菌落形态观察 用肉眼观察分离平板培养基上的菌落形态,然后挑取少量菌落于载玻片进行革兰氏染色,用油镜观察。
1.2.4.2 分子生物学鉴定 16S rDNA序列扩增与分析 挑取培养基上的菌体于50 μL TaKaRa Lysis Buffer for Microorganism to Direct PCR(Code No.9164)中变性后离心(12000×g 4 ℃,30 min)取上清作为模板,反应条件:80 ℃,15 min;然后使用TaKaRa 16S rDNA Bacterial Identification PCR Kit(Code No.RR176)进行PCR扩增目的片段,经琼脂糖凝胶电泳后,切胶回收目的片段,由宝生物工程(大连)有限公司进行测序,通过NCBI数据库在线BLAST系统进行序列比对,以确定种属。
系统发育树的构建:使用BLAST将16S rDNA测序结果在NCBI(http://www.ncbi.nlm nih.gov/)上比对,在比对结果中选择模式菌株,据同源性搜索结果,使用MEGA 5.0生物学软件,对测试菌株和相关菌株的多个序列进行比对分析及Neighbor-Joining方法构建系统发育树。
1.2.4.3 生理生化鉴定 挑取纯化的菌株加至3 mL生理盐水中,振荡混匀后,利用麦氏比浊仪测定菌悬液浊度达到1.80-2.20麦氏浓度,按照BCL芽孢杆菌鉴定卡的操作说明书,进行VITEK 2 COMPACT全自动微生物分析系统分析。
1.2.5 单因素实验 分别以葡萄糖、麦芽糖、蔗糖、淀粉、果糖为碳源,每种碳源的加入量为40 g/L;分别以牛肉膏、蛋白胨、胰蛋白胨、玉米浆、酵母膏为氮源,每种氮源的加入量为40 g/L,于37 ℃、pH7.0,220 r/min恒温振荡培养36 h,考察不同碳、氮源对γ-PGA转化率的影响。接着分别探究最适碳、氮源的浓度在30、35、40、45、50、55、60、65、70 g/L时,于37 ℃、pH7.0,220 r/min恒温振荡培养36 h,考察γ-PGA的转化率的变化。以温度(25、30、35、40、45 ℃),pH7.0,转速220 r/min;pH(5.0、6.0、7.0、8.0、9.0),温度 37 ℃,转速220 r/min;转速(160、180、200、220、240 r/min),温度37 ℃,pH7.0,于1.2.1的液体发酵培养基,振荡培养36 h,测定其γ-PGA的产量,考察温度、pH、转速对γ-PGA的产量的影响。以底物谷氨酸钠浓度(20、30、40、50、60 g/L),其余均与1.2.1所示的液体发酵培养基相同,温度37 ℃,pH7.0,转速220 r/min振荡培养36 h,考察底物浓度对γ-PGA转化率的影响。按1.2.2所述方法测得γ-PGA的产量,采用下列方程计算转化率。所有实验均重复3次。
γ-PGA转化率(%)=发酵液γ-PGA质量浓度(g/L)/底物质量浓度(g/L)×100
1.2.6 响应面试验 在单因素实验的基础上,选取温度、pH、转速及底物浓度这四个因素作为多因素交叉组合实验的考察因素,以γ-PGA的产量作为响应值,利用响应面中的Box-Behnken Design方法设计实验,实验组合的因素水平编码见表1。

表1 Box-Behnken中心组合实验设计因素和水平Table 1 Factors and levels of Box-Behnken design
1.3 数据处理
单因素实验结果用Design-Expert 8.0 软件进行分析处理,采用origin Pro 8.0进行图表绘制。
2 结果与分析
2.1 高产γ-PGA菌株的筛选
利用分离平板培养基共检出12个菌株,通过观察菌落形态,初步确定这些菌株为芽孢杆菌。将上述获得的菌株分别进行摇瓶培养,发酵条件为37 ℃,220 r/min,培养36 h,利用参考文献[11]所示方法,检测发酵液中γ-PGA的含量,结果如表2所示。
由表2可知,不同芽孢杆菌产γ-PGA的能力不同,从表层土中筛选出的菌株(以B开头的编号)产γ-PGA的能力要明显好于从下挖5 cm(以X5开头的编号),下挖10 cm(以X10开头的编号)的土样中筛选出的菌株,菌株B-6578产γ-PGA的能力相对较高,达到17.53 g/L,因此将其进一步分离纯化,保藏待用。

表2 不同发酵液中γ-PGA含量比较结果Table 2 Comparison of γ-PGA production after fermentation by different bacillus
2.2 菌株的鉴定
2.2.1 形态学观察 将菌株B-6578在固体培养基上培养36 h后,菌株在平板上的单菌落呈圆形,隆起,表面有褶皱,湿润,不透明,边缘不齐,颜色为淡黄色(图1a),革兰氏染色鉴定为阳性菌(图1b),呈杆状。

图1 菌株B-6578菌落形态(a)和革兰氏染色镜检结果(b)Fig.1 Colony morphology(a)and Gram-stain microscopic examination(b)of strain B-6578
2.2.2 菌株16S rDNA序列分析 以菌株基因组DNA为模板,经过PCR扩增后,进行1%琼脂糖凝胶电泳,目的片段大约为1500 bp,将PCR产物回收纯化后测序,确定该片段实际长度为1513 bp。该序列已提交Genbank,登记号为MG066538。将该序列在NCBI中Blast比对发现,菌株与暹罗芽孢杆菌(Bacillussiamensis),解淀粉芽孢杆菌(Bacillusamyloliquefaciens),地衣芽孢杆菌(Bacilluslicheniformis)的同源性极高,序列相似性达到99%。使用分子软件MEGA 5.0对B-6578相似度较高的菌株进行多序列比对分析,并利用Neighbor-Joining方法构建系统发育树(图2)。由图可以看出,芽孢杆菌B-6578与暹罗芽孢杆菌(Bacillussiamensis)同源性最高,结合生理生化鉴定实验结果(表3),鉴定为暹罗芽孢杆菌。

图2 芽孢杆菌B-6578基于16S rDNA序列及Neighbor-Joining法构建的系统发育树Fig.2 Phylogenetic tree of bacillus strain B-6578 using neighbor-joining based on 16S rDNA

表3 菌株B-6578生理生化实验鉴定结果Table 3 Identification results of physiological and biochemical test of strain B-6578
暹罗芽孢杆菌对禾谷镰刀菌有很好的拮抗作用,禾谷镰刀菌可引起小麦赤霉病,导致小麦产量的大幅降低和品质的严重损失。因此,在农业生产中,暹罗芽孢杆菌可提高植株抗病能力[14-16]。更为重要的是,尚未见该菌株在γ-PGA生产领域的相关报道,因此,本文对暹罗芽孢杆菌产γ-PGA的发酵条件进行优化。
2.3 单因素实验
2.3.1 不同碳源对发酵的影响 在基础培养基的基础上,分别以40 g/L葡萄糖、麦芽糖、蔗糖、淀粉、果糖作为碳源,考察不同碳源对发酵的影响(图3)。总体来看,菌体利用淀粉、蔗糖的能力较差,生长受到一定程度的抑制;葡萄糖、麦芽糖、果糖均显示了较好的γ-PGA的生产性,综合考虑生产成本和原料来源这两个因素[18-19],选择葡萄糖为最佳碳源。进一步研究初始葡萄糖浓度为30~70 g/L对发酵的影响(图4)。结果显示,随着葡萄糖浓度的增加,发酵液中γ-PGA的终浓度逐渐增加。而在初始葡萄糖浓度为45 g/L时,γ-PGA的转化率最高,而后,随着初始葡萄糖浓度的增加,γ-PGA的转化率反而出现下降的趋势。这可能是由于在高浓度糖基质中,发酵液渗透压增加,从而对菌体生长及其代谢造成一定的抑制作用。因此为了获得较高的γ-PGA转化率,避免高糖浓度对微生物造成的抑制作用,考虑选择发酵初始葡萄糖浓度为45 g/L,进行发酵培养。
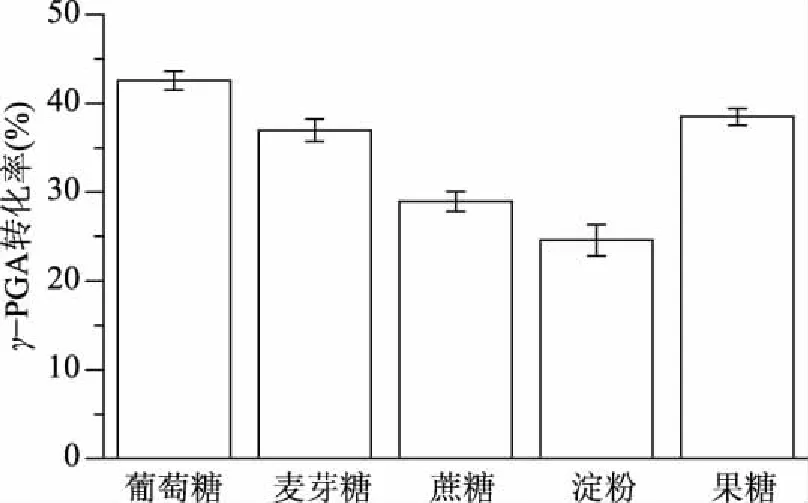
图3 碳源种类对发酵γ-PGA的影响Fig.3 Effects of different carbon sources on the fermentation γ-PGA

图4 葡萄糖浓度对发酵产γ-PGA的影响Fig.4 Effects of different glucose concentrations on the production of γ-PGA
2.3.2 不同氮源对发酵的影响 在基础培养基的基础上,分别以40 g/L的牛肉膏、蛋白胨、胰蛋白胨、玉米浆[10]、酵母膏作为氮源,考虑氮源种类对发酵产γ-PGA的影响(图5)。从图5中可以看出,胰蛋白胨和酵母膏的γ-PGA的转化率明显高于其他氮源,这可能是因为胰蛋白胨和酵母膏中氨基氮的含量均大于3%,可以满足微生物生长和代谢的需要。因此,采用胰蛋白胨与酵母膏2∶1的复合氮源进行发酵[20-21],有利于芽孢杆菌的生长。进一步研究当该复合氮源初始浓度为30~70 g/L对发酵的影响(图6),结果显示,初始复合氮源浓度为40 g/L时,γ-PGA的转化率最高,因此,以胰蛋白胨和酵母膏的比为2∶1的复合氮源的最适浓度为40 g/L。

图5 氮源种类对发酵γ-PGA的影响Fig.5 Effects of different nitrogen sources on the fermentation γ-PGA
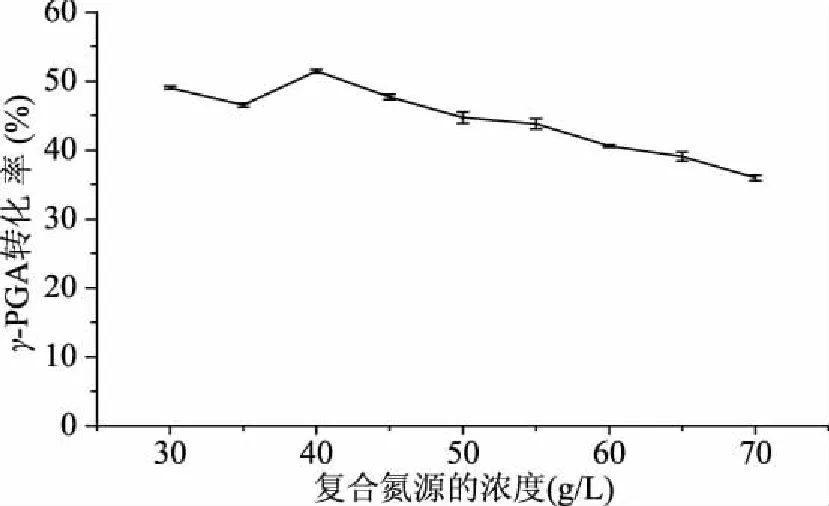
图6 复合氮源不同浓度对发酵产γ-PGA的影响Fig.6 Effect of different compound nitrogen source concentrations on the production of γ-PGA
2.3.3 温度对发酵的影响 温度对发酵产γ-PGA的影响结果如图7所示。可见,当温度为35 ℃时,芽孢杆菌B-6578合成γ-PGA的产量最高,为20.39 g/L。温度过高或过低不仅对菌株的正常生长有影响,而且发生反应所需要的酶在高温下失活,在低温下活性受到较大的抑制,从而导致γ-PGA的产量降低。而梁金钟等[22]在利用枯草芽孢杆菌时发现,菌株在37 ℃时,γ-PGA的产量最高,与本文的结果基本相近。因此,本研究选择35 ℃作为进一步发酵培养的温度。

图7 温度对B-6578合成γ-PGA的影响Fig.7 Effect of temperature on γ-PGA production from bacillus strain B-6578
2.3.4 pH对发酵的影响 适宜的pH是菌株生长的必要条件,更重要的是会影响菌株的代谢途径,从而起到调控代谢的作用。通过对pH优化发现(图8),随着初始pH的不断增加,芽孢杆菌B-6578合成γ-PGA的量也在不断增加,当初始pH达到7时,产量最大,为17.28 g/L,之后随着初始pH的继续增加,γ-PGA的产量却逐渐降低。另外,该菌株在pH为6~8时,能保持较好的生长,而任尚美等[10]和Feng等[23]结果均表明,pH为7时,γ-PGA的产量最高,与本文结果相符。因此,选择pH为7作为进一步发酵的pH。
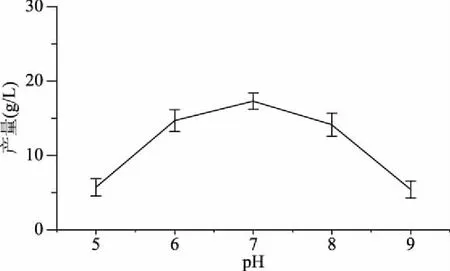
图8 pH对B-6578合成γ-PGA的影响Fig.8 Effect of pH on γ-PGA production from bacillus strain B-6578
2.3.5 转速对发酵的影响 摇床的转速和装液量影响着发酵液中溶解氧的含量,这对于好氧微生物的发酵是一个重要因素,产γ-PGA的暹罗芽孢杆菌是好氧菌,且在γ-PGA这种高黏度的发酵体系中尤为突出,γ-PGA的产量与氧的传递和料液的氧密度紧密相关,当装液量为50 mL/250 mL时,发酵产量最高[24]。
通过对转速的研究发现(图9),当转速大于200 r/min时,γ-PGA的产量较高,转速较低时,由于发酵液的黏度较高,含氧量低,不利于菌株的生长,γ-PGA的产量也就较低。因此,选择转速200 r/min进行进一步发酵。

图9 转速对B-6578合成γ-PGA的影响Fig.9 Effect of rotational speed on γ-PGA production from bacillus strain B-6578
2.3.6 底物浓度对发酵的影响 底物谷氨酸钠对γ-PGA合成的影响如图10,可以看出,随着谷氨酸钠浓度的增大,γ-PGA的转化率也逐渐增大,当谷氨酸钠浓度变为40 g/L时,γ-PGA的转化率最大,为44.78%,之后随着谷氨酸钠浓度的继续增大,γ-PGA的转化率反而出现下降。可见,底物浓度过高时,可能会降低参与反应的酶活,从而导致实际转化率降低[25]。在芽孢杆菌发酵产γ-PGA的途径中,作为底物的谷氨酸钠的浓度至关重要。浓度过低,菌株不能充分发挥催化转化的能力,浓度过高则会造成转化率低,使成本增加。任尚美等[10]通过正交实验发现,谷氨酸钠用量对γ-PGA产量的影响最大。因此,选择谷氨酸钠的浓度为40 g/L进行进一步发酵。
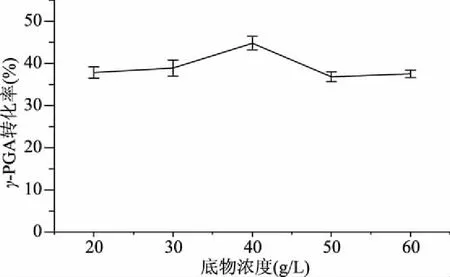
图10 底物浓度对B-6578合成γ-PGA的影响Fig.10 Effect of substrate concentration on γ-PGA production from bacillus strain B-6578
2.4 响应面优化芽孢杆菌B-6578合成γ-PGA条件
2.4.1 响应面试验设计及结果 根据Box-Behnken 中心组合设计原理,选择温度、pH、转速、底物浓度为优化参数,以产量为响应值,对芽孢杆菌B-6578发酵产γ-PGA实验进行四因素三水平响应面设计,结果见表4。采用Design-Expert 8.0.6软件对实验数据进行二次多项回归拟合,回归结果与方差分析见表5,得到目标响应值与各因素关系的二阶经验模型:
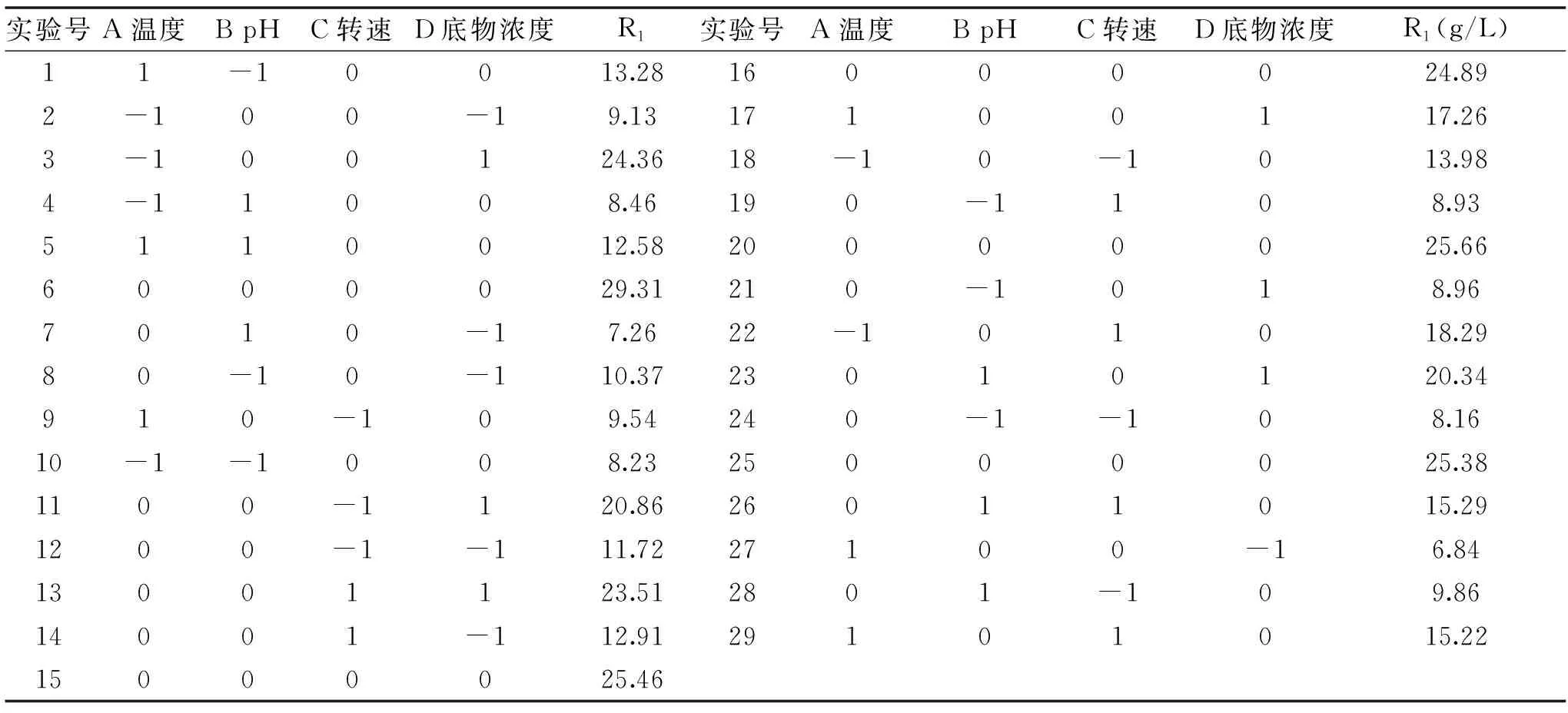
表4 Box-Behnken实验设计及结果Table 4 Experiment design and results of Box-Behnken response surface

表5 Box-Behnken实验方差分析Table 5 Variance analysis of Box-Behnken experiment
R1=26.14-0.64A+1.32B+1.67C+4.76D-0.23AB+0.34AC-1.20AD+1.17BC+3.62BD+0.36CD-6.56A2-9.74B2-5.18C2-4.52D2
式中:R1为γ-PGA的产量(g/L),A、B、C、D分别为温度(℃),pH,转速(r/min),底物浓度(g/L)。

2.4.2 各因素交互作用分析 通过Design-Expert 8.0.6软件绘制响应面图及等高线图(图11~图16),等高线图可以直观的反映各因素之间交互作用的强弱,椭圆表示两因素交互作用明显,而圆形则表示交互作用较小或没有交互作用[12-13]。可见,随着各因素水平的升高,γ-PGA的产量先增加后减少,底物浓度和pH之间的交互作用如图12所示,响应面曲面的坡度陡峭,等高线呈椭圆形,说明产量对底物浓度和pH的变化比较敏感,底物浓度和pH之间交互作用较强,对产量的影响显著(p=0.0245<0.05)。而底物浓度和温度、pH和温度、转速和温度、转速和pH、底物浓度和转速之间的交互作用如图11、13、14、15、16所示,响应面的坡度较为平缓,等高线近似圆形,所以底物浓度和温度、pH和温度、转速和温度、转速和pH、底物浓度和转速之间的交互作用较弱,但也对芽孢杆菌B-6578产γ-PGA具有一定的影响。

图11 底物浓度和温度对芽孢杆菌 B-6578发酵产γ-PGA的影响Fig.11 Effect of substrate concentration and temperature on γ-PGA production from bacillus strain B-6578

图12 底物浓度和pH对芽孢杆菌 B-6578发酵产γ-PGA的影响Fig.12 Effect of substrate concentration and pH on γ-PGA production from bacillus strain B-6578
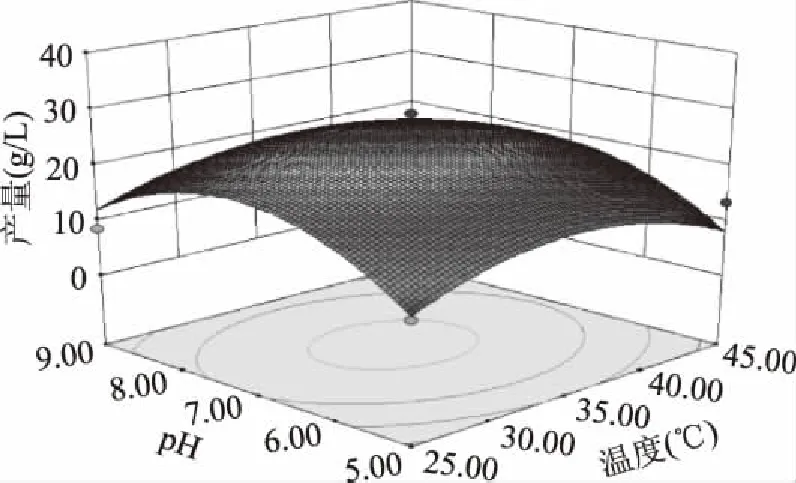
图13 pH和温度对芽孢杆菌 B-6578发酵产γ-PGA的影响Fig.13 Effect of pH and temperature on γ-PGA production from bacillus strain B-6578
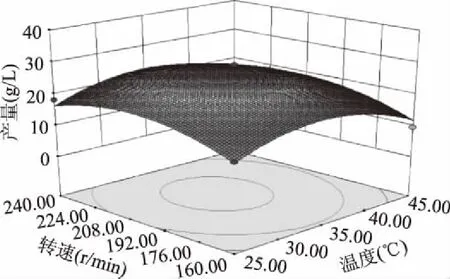
图14 转速和温度对芽孢杆菌 B-6578发酵产γ-PGA的影响Fig.14 Effect of rotational speed and temperature on γ-PGA production from bacillus strain B-6578

图15 转速和pH对芽孢杆菌 B-6578发酵产γ-PGA的影响Fig.15 Effect of rotational speed and pH on γ-PGA production from bacillus strain B-6578

图16 底物浓度和转速对芽孢杆菌 B-6578发酵产γ-PGA的影响Fig.16 Effect of substrate concentration and rotational speed on γ-PGA production from bacillus strain B-6578
2.4.3 最优发酵条件及验证 结合响应值与各因素关系的二阶经验模型及三维响应面图,确定温度、pH、转速、底物浓度的最佳优化水平分别为37.5 ℃、pH7.48、240 r/min、52.70 g/L,预测γ-PGA的产量为23.96 g/L,采用该优化发酵条件进行实验,得到实际γ-PGA的产量为24.82 g/L(实验重复3次,SD=0.1068)。γ-PGA的转化率为47.10%,比优化前提高了25.19%。
3 结论
本实验从豆腐作坊周边的表层土中筛选出一株产γ-PGA的菌株,通过菌落形态和分子生物学分析,可确定该菌株为暹罗芽孢杆菌。本实验所采用的菌株B-6578,初始γ-PGA的产量为17.53 g/L,γ-PGA的转化率为21.91%,通过单因素实验和响应面实验优化,采用温度37.5 ℃,pH7.48,转速240 r/min,底物谷氨酸钠浓度52.70 g/L的条件,测得γ-PGA的产量为24.82 g/L,该结果与模型预测的结果吻合较好,因此,优化后γ-PGA的转化率为47.10%,比优化前提高了25.19%。
