TauN368和磷酸化α-synuclein在3种帕金森病动物模型脑区的表达
2018-10-19聂淑科马凯陈贵勤张振涛曹学兵
聂淑科 马凯 陈贵勤 张振涛 曹学兵
帕金森病(Parkinson diseases,PD)是最常见的神经系统退行性疾病之一,α-synuclein的异常磷酸化和折叠聚集是PD的核心发病机制[1]。α-共核蛋白病理和tau蛋白病理现象可存在于同一种神经系统退行性变疾病中,PD患者脑中可发现tau蛋白过度磷酸化折叠聚集形成的神经原纤维缠结(neurofibrillary tangles,NFTs),阿尔茨海默病(Alzheimer disease,AD)患者脑中也可发现磷酸化α-synuclein(S129)〔以下简称为:p-α-syn(S129)〕的异常聚集[2]。p-α-syn(S129)可促进tau蛋白的异常折叠和聚集,越来越多的研究表明异常蛋白聚集存在共同致病机制及相互作用[3-5]。
天冬酰胺内切酶(asparagine endopeptidase,AEP)激活并特异性切割tau蛋白产生致病性的tauN368片段是新发现的神经变性疾病病理现象和致病机制[6-7]。PD患者脑内同样存在AD样的病理改变(如NFTs),tau蛋白毒性片段tauN368参与了NFTs形成,作者推测tau蛋白的致病片段可能也存在PD模型中。本研究通过建立慢性MPTP小鼠PD模型、鱼藤酮小鼠PD模型及鱼藤酮大鼠PD模型3种经典PD动物模型,观察不同PD模型黑质、纹状体及海马p-α-syn(S129)和tauN368的表达差异,旨在为研究PD的病理生理机制提供新的思路。
1 材料和方法
1.1实验动物选取雄性C57/BL6小鼠40只,8~9周龄;雄性SD大鼠20只,4~8周龄,体重150~180 g。实验动物均购自武汉华中科技大学实验动物中心(中国),SPF级动物房内饲养,喂养温度维持在21~23℃,12 h昼夜交替,均采用自由进食和饮水。本研究经华中科技大学动物保护机构和伦理委员会批准通过。
1.2主要材料和仪器1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)、鱼藤酮购自Sigma公司。MPTP配置方法如下:将10 mg MPTP溶于4 mL生理盐水配成2.5 mg/mL溶液,现配现用。DAB显色剂购自DAKO公司(K5007),免疫组化所需其他试剂购自武汉谷歌生物科技有限公司,免疫荧光DAPI、抗荧光猝灭封片剂购自碧云天公司。兔抗酪氨酸羟化酶抗体购自Abcam公司,兔抗p-α-syn(Ser129)抗体购自Genetex公司, 兔抗tauN368抗体由Emory大学叶克强教授赠送,兔抗β-actin抗体购自美国CST公司,羊抗兔IgG二抗购自武汉安特捷生物科技有限公司,荧光羊抗鼠二抗购自Thermo Fisher公司。
1.3方法
1.3.1 MPTP诱导的小鼠PD模型:将20只C57/BL6小鼠随机分为MPTP小鼠PD模型组(n=10)和对照组MPTP小鼠(n=10)。模型组按体重25 mg/(kg·d)给予MPTP背部皮下注射,每周2次,共5周;对照组MPTP小鼠按同法给予等量生理盐水注射,5周后处死小鼠待检。
1.3.2 鱼藤酮诱导的小鼠PD模型:将20只C57/BL6小鼠随机分为鱼藤酮小鼠PD模型组(n=10)和对照组鱼藤酮小鼠(n=10)。模型组按体重1 mg/(kg·d)给予鱼藤酮(鱼藤酮∶DMSO∶生理盐水=1 mg∶3.5 mL∶0.5 mL)背部皮下注射,连续50 d;对照组鱼藤酮小鼠给予等量溶媒(DMSO和生理盐水)背部皮下注射。50 d后处死小鼠待检。
1.3.3 鱼藤酮诱导的大鼠PD模型:将24只SD大鼠随机分为鱼藤酮大鼠PD模型组(n=10) 和对照组鱼藤酮大鼠(n=10)。模型组按体重1.5 mg/(kg·d)给予鱼藤酮(鱼藤酮∶DMSO∶玉米油=30 mg∶1 mL∶14 mL)背部皮下注射,连续5周。对照组鱼藤酮大鼠给予等量溶媒(DMSO和玉米油)注射。35 d后处死大鼠待检。
1.3.4 脑标本制备:采用7%(体积分数)水合氯醛按体重0.5 mL/100 g注射麻醉动物,切开胸腔,经左心室心尖部插入灌流针头至主动脉,切开右心耳排血,生理盐水持续冲洗至肝脏颜色变白,滴灌4%(质量浓度)多聚甲醛,灌流完毕后断头取脑,使用瑞沃德小动物脑槽切取所需脑组织块后放入4%(质量浓度)多聚甲醛中4℃固定24 h后脱水、浸蜡、包埋、切片,进行免疫组化及免疫荧光检测。
1.3.5 免疫组化及荧光染色:将石蜡切片烤片后依次放入二甲苯、浓度梯度无水乙醇脱蜡3~5 min,自来水冲洗5 min,3%(体积分数)双氧水灭活内源性过氧化物酶,柠檬酸钠抗原修复液热修复20 min,室温封闭1 h后一抗4℃孵育过夜,TBST洗涤后二抗室温孵育2 h。免疫组化染色采用DAB显色,苏木素复染1 min,梯度脱水及透明后封片。免疫荧光则使用荧光二抗避光湿盒室温孵育2 h,DAPI染核,采用抗荧光淬灭封片剂对各切片进行封片。生物学和荧光显微镜采集中脑黑质区域酪氨酸羟化酶(TH)阳性神经元图像,采用Image J进行图像采集分析中脑黑质TH阳性神经元数目。
1.3.6 Western blot:提取各模型组动物黑质、纹状体和海马总蛋白,变性后分装于-80℃冻存。配制分离胶和浓缩胶,每孔上样40 μg,100 V条件下电泳至Marker条带达到所需后停止电泳,200 mA条件下转膜70 min,5%(质量浓度)脱脂奶粉室温封闭2 h,TBST洗涤条带后加入所需的一抗4℃孵育过夜,TBST洗涤3次后二抗室温孵育2 h,Millipore发光显影液显影3 min,Bio-Rad 成像系统显像,使用Image J软件计算分析Western blot条带灰度值,分析各模型鼠脑区p-α-syn(S129)和tauN368表达水平。
1.4统计学处理采用SPSS20.0软件进行统计分析,对数据进行正态性和方差齐性检验,符合正态性分布的计量资料以均数±标准差表示,两均数比较采用独立样本t检验。以P<0.05表示差异具有统计学意义。
2 结果
2.1各组PD模型黑质多巴胺能损伤情况(1)MPTP小鼠PD模型组中脑黑质TH阳性神经元数目明显少于对照组MPTP小鼠(38.170±7.931比92.576±10.267;t=7.662,P<0.01)。(2)鱼藤酮小鼠PD模型组中脑黑质TH阳性神经元数目少于对照组鱼藤酮小鼠(40.17±6.931比125.67±16.009,t=5.609,P<0.01)。(3)鱼藤酮大鼠PD模型组黑质致密部TH阳性神经元数目少于对照组鱼藤酮小鼠(80.170±18.931比122.576±10.267,t=4.089,P<0.01)。结果见图1~2。
2.2各组模型不同脑区p-α-syn(S129)和TauN368表达
2.2.1 MPTP小鼠PD模型:与对照组MPTP小鼠相比较,MPTP小鼠PD模型黑质、纹状体及海马tauN368表达均升高(t黑质=3.709,P=0.002;t纹状体=3.137,P=0.006;t海马=2.298,P=0.035),纹状体p-α-syn(S129)表达水平升高(t纹状体=5.492,P<0.01),而黑质和海马p-α-syn(S129)表达无统计学差异(t黑质=0.510,P=0.617;t海马=-0.373,P=0.714)。结果见图3、4。
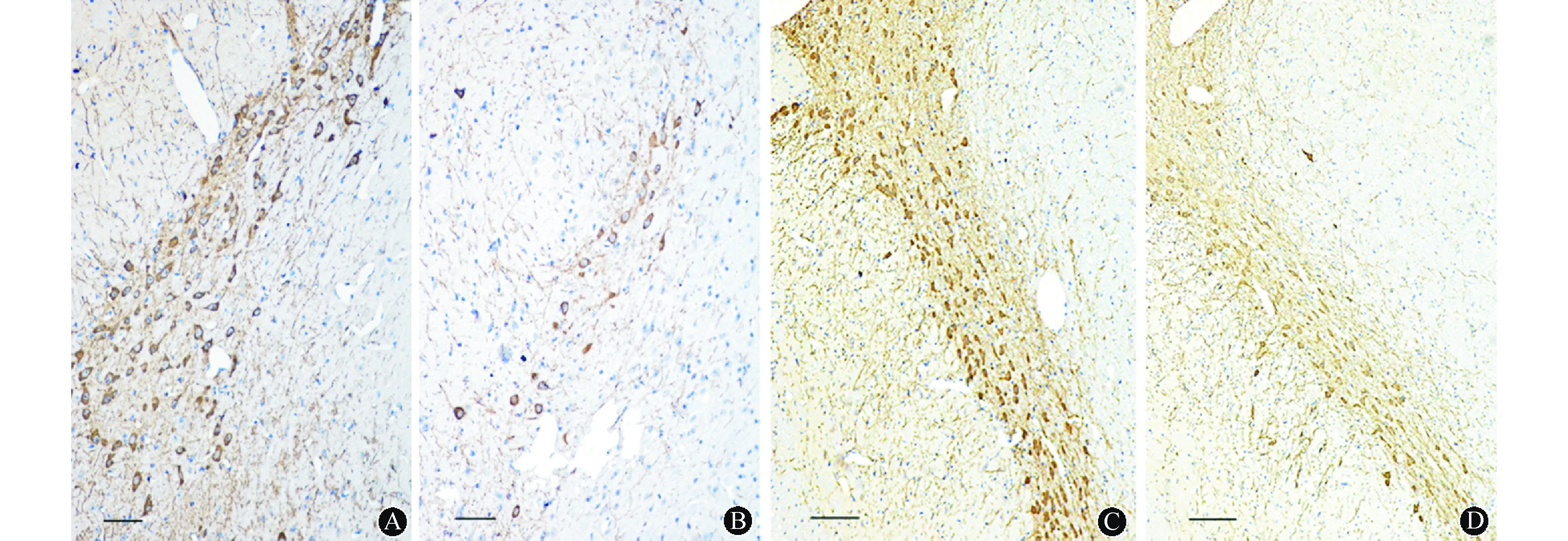
注:PD:帕金森病,图2~8同;TH:酪氨酸羟化酶,图2同;MPTP:1-甲基-4-苯基-1,2,3,6-四氢吡啶,图3、4同;A:对照组MPTP小鼠;B:MPTP小鼠PD模型组;C:对照组鱼藤酮大鼠;D:鱼藤酮大鼠PD模型组 图1 各组PD模型中脑黑质多巴胺神经元TH阳性神经元比较(免疫组化,比例尺=100 μm)
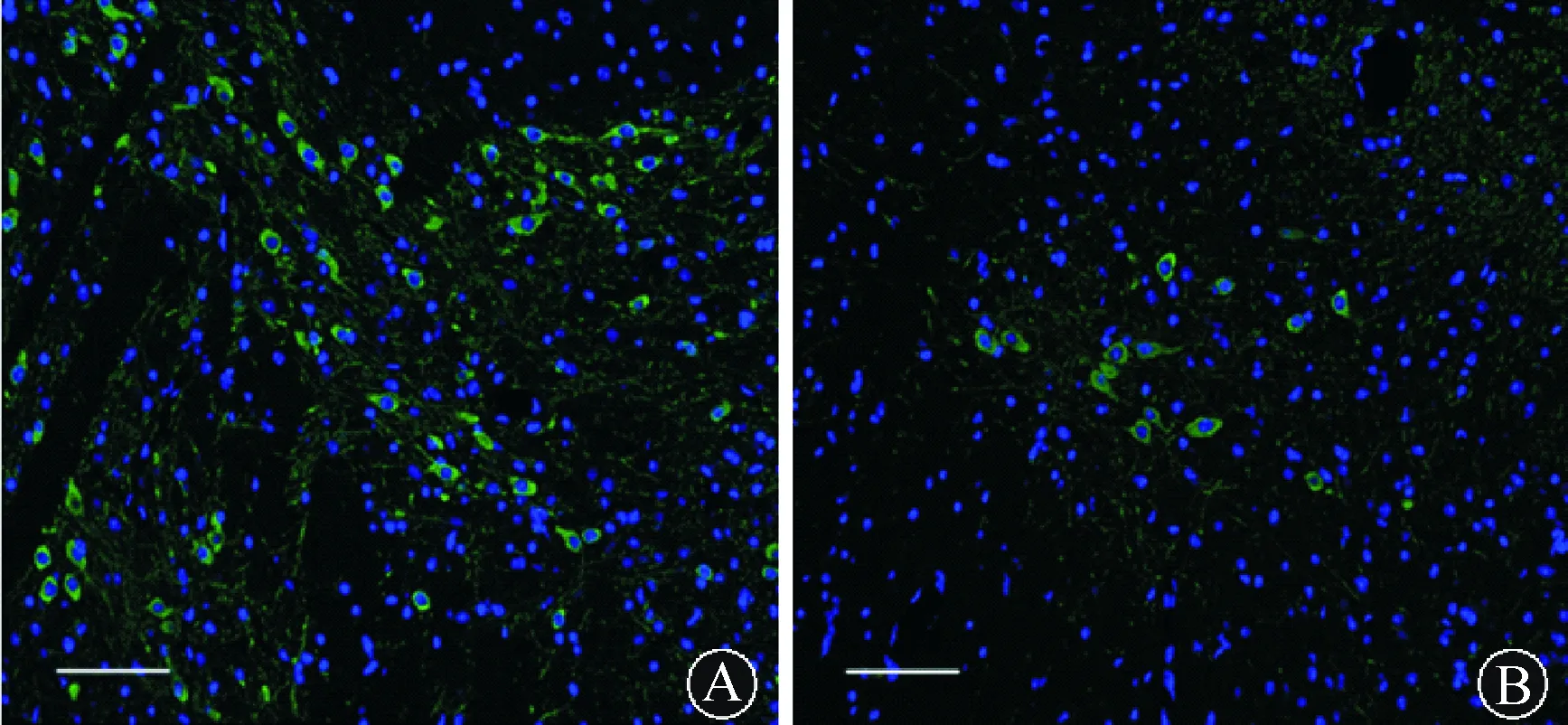
注:A:对照组;B:鱼藤酮小鼠PD模型 图2 两组小鼠中脑黑质多巴胺神经元TH阳性神经细胞比较(免疫荧光染色,TH/DADI,比例尺=100 μm)
2.2.2 鱼藤酮小鼠PD模型:与对照组鱼藤酮小鼠比较,鱼藤酮小鼠PD模型组黑质及纹状体p-α-syn(S129)和tauN368表达均升高(t黑质p-a-syn=5.855,P<0.01;t纹状体p-a-syn=5.718,P<0.01;t黑质tauN368=2.348,P=0.032;t纹状体tauN368=5.280,P<0.01),而海马p-α-syn(S129)和tauN368表达无统计学改变(t海马p-a-syn=-0.256,P=0.801;t海马tauN368=-0.529,P=0.604)。结果见图5、6。
2.2.3 鱼藤酮大鼠PD模型:与对照组鱼藤酮大鼠比较,鱼藤酮大鼠PD模型黑质、纹状体及海马p-α-syn(S129)表达升高(t黑质=2.901,P=0.010;t纹状体=4.916,P<0.01;t海马=2.352,P=0.032),纹状体tauN368表达水平升高(t纹状体=8.486,P<0.01),而黑质和海马tauN368表达无统计学差异(t黑质=0.885,P=0.389;t海马=1.314,P=0.207)。结果见图7、8。
3 讨论
tau蛋白可被AEP和caspase等酶切割截断为失去活性的片段,更加容易形成二聚体。Day等[8]在血管性痴呆患者脑尸检标本中发现caspase切割的tau蛋白片段tau C3与NFTs存在共表达现象。对AD患者尸检研究发现,tau的截断现象参与了AD脑内NFT的形成过程,而在体外实验中,tau蛋白的截断片段可促进神经细胞凋亡[9-11]。
注:p-α-syn(S129):磷酸化α-synuclein(S129),图4~8同 图3 两组小鼠不同脑区p-α-syn(S129)和tauN368表达电泳图(Western blot)
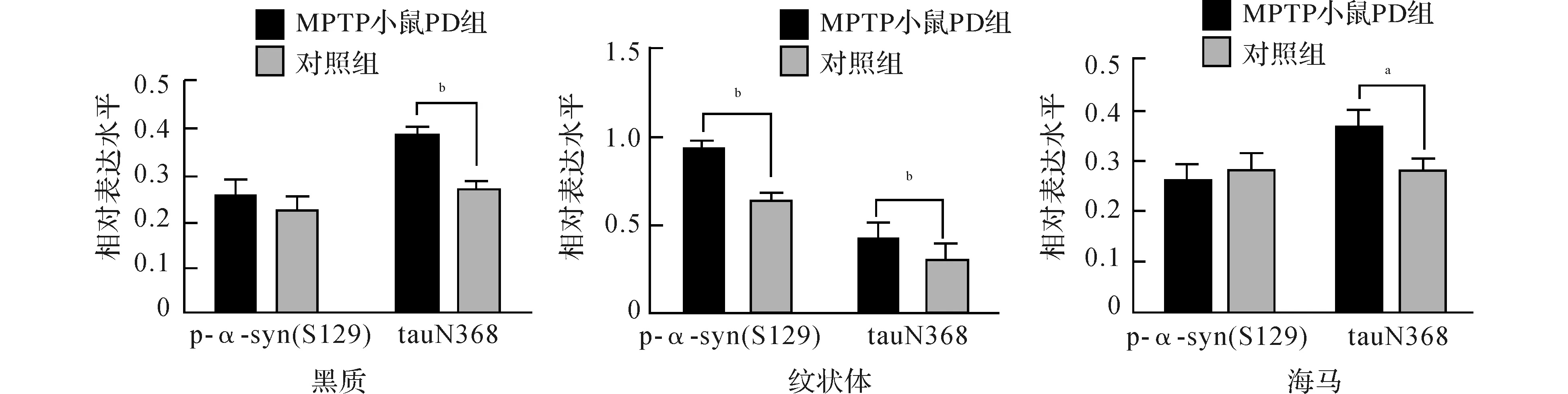
注:aP<0.05;bP<0.01 图4 两组小鼠不同脑区p-α-syn(S129)和tauN368表达比较(Western blot)
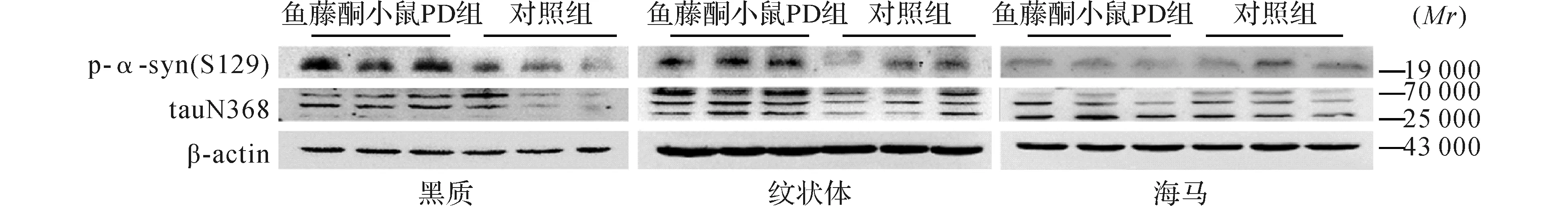
图5 两组小鼠不同脑区p-α-syn (S129)和tauN368表达电泳图(Western blot)
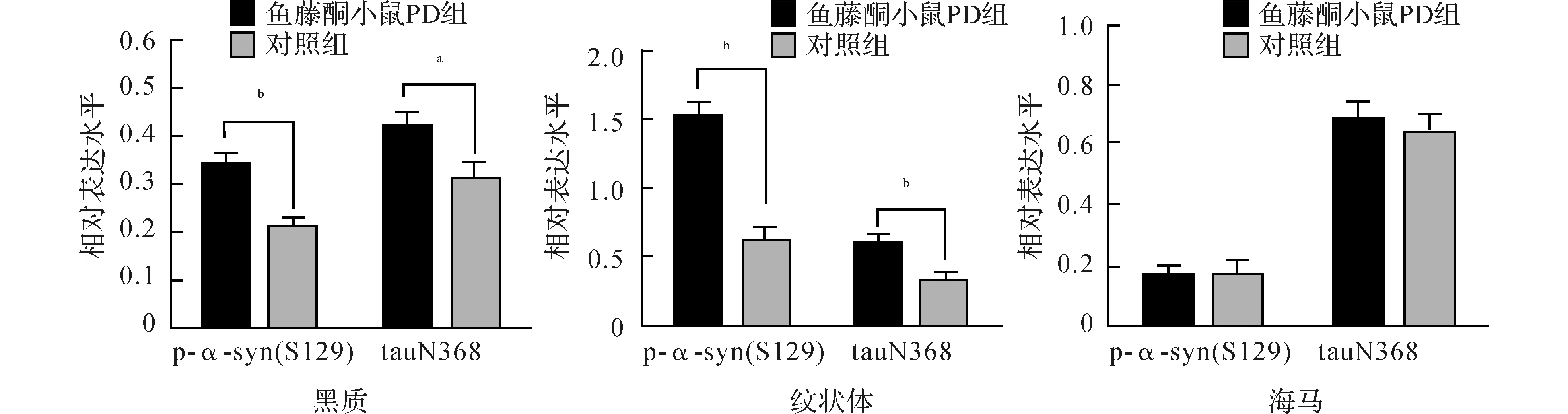
注:aP<0.05;bP<0.01 图6 两组小鼠不同脑组织中p-α-syn(S129)和tauN368表达比较(Western blot)
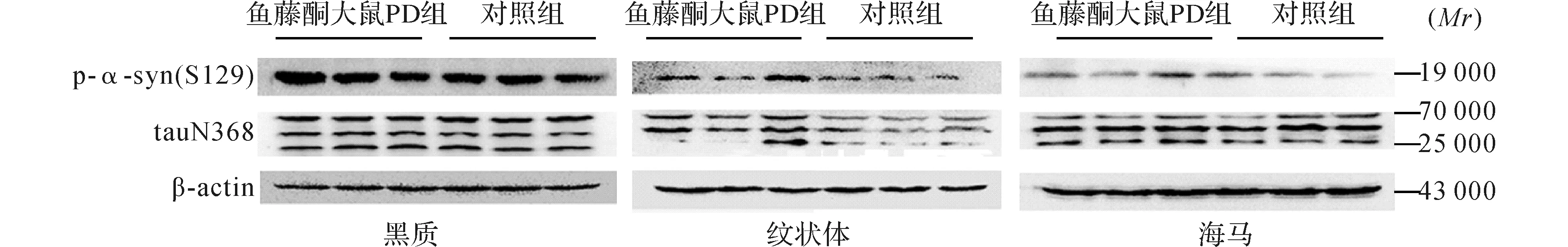
图7 两组大鼠不同脑组织p-α-syn(S129)和tauN368表达电泳图(Western blot)

注:aP<0.05;bP<0.01 图8 两组大鼠不同脑组织p-α-syn(S129)和tauN368表达比较(Western blot)
PD中同样存在类AD样的病理改变如β淀粉样蛋白斑块和tau蛋白过度磷酸化形成的NFTs,作者推测tau蛋白的切割现象可能也存在PD中。本研究结果显示,3种不同PD模型鼠黑质多巴胺神经元大量丢失,黑质部位存在不同程度的tauN368和p-α-syn表达。结合国外研究发现tau蛋白的异常切割片段具有神经毒性作用[6]这一结论,提示tau蛋白毒性片段可能参与了PD的发生和发展。进一步观察发现,MPTP诱导PD小鼠模型黑质、纹状体和海马tauN368表达均较对照组增多,鱼藤酮诱导的大鼠PD模型黑质和纹状体tauN368表达均升高,进一步验证作者的推测,其具体的致病机制需进一步研究。
有研究发现,通过给予小鼠皮下植入微泵注射鱼藤酮制备PD模型,按体重2.2~2.5 mg(kg·d)连续给药28 d,模型组小鼠中脑黑质、纹状体α-syn异常聚集及tau蛋白磷酸化较对照组明显增多,且tau蛋白的磷酸化程度更为显著[12]。而采用按体重20 mg(kg·d)连续5 d皮下注射MPTP,可选择性引起tau Ser396/404位点磷酸化水平增加,不改变ser202位点的磷酸化水平,这种表达变化高度依赖α-syn的作用,在α-syn基因敲除小鼠中未发现MPTP诱导的tau蛋白磷酸化改变[13]。本研究通过比较慢性MPTP诱导的PD小鼠模型和鱼藤酮诱导的PD大鼠和小鼠模型黑质、纹状体及海马部位p-α-syn(S129)及tauN368的表达,发现3种PD动物模型中均存在不同部位及不同水平的p-α-syn(S129)及tauN368表达增多现象;与鱼藤酮诱导的PD大鼠和小鼠模型相比,慢性MPTP诱导的PD小鼠模型黑质和海马p-α-syn(S129)未见统计学变化,提示慢性MPTP诱导的PD模型并不能完全模拟PD的病理发展过程,而鱼藤酮诱导的PD模型则能够在多个脑区增加病理性α-syn的表达。
张如意等[14]研究发现,给予Lewis大鼠皮下注射不同剂量鱼藤酮〔1.0、1.5、2.0 mg(kg·d)〕28 d后评估PD大鼠模型的运动功能障碍和纹状体多巴胺水平,结果提示1.5 mg(kg·d)剂量造模时,大鼠可出现明显的运动减少,死亡率相对较低,是建立PD大鼠模型的合适剂量。Sherer 等[12]采用皮下植入微泵的方法给予Lewis大鼠鱼藤酮造模,结果显示鱼藤酮2.0 mg/(kg·d)注射15 d和3.0 mg/ mg/(kg·d)注射21 d组黑质、纹状体多巴胺能神经元和神经纤维丢失较2.75 mg/(kg·d)注射7 d和3.0 mg/(kg·d)注射32 d组增加。Cannon等[15]将Lweis大鼠分为年轻组(3个月)、成年组(7个月)、中年组(12~14个月),分别采用2.75、3.00 mg/(kg·d)2个不同剂量鱼藤酮,给药时间为7~9 d,结果发现在第9天成年组大鼠3.00 mg/(kg·d)具有明显的多巴胺神经毒性损伤作用。作者前期预实验发现,3.0 mg/(kg·d)鱼藤酮造模剂量死亡率极高,SD大鼠1周内死亡率达80%左右,为构建慢性PD模型及成功诱导α-syn的聚集,结合国内研究报道,本实验选择1.5 mg/(kg·d)鱼藤酮造模剂量,造模时间选择35 d,结果发现鱼藤酮诱导的大鼠PD模型黑质、纹状体和海马p-α-syn (S129)表达均较对照组增加,而纹状体和海马组织中tauN368的表达虽然较对照组增多,但差异无统计学意义,这可能与鱼藤酮大鼠PD模型造模时皮下注射剂量有关。
综上所述,本研究结果显示,MPTP诱导的小鼠PD模型中黑质、纹状体及海马tauN368表达较对照组增高,而在PD病理改变发生的关键位置黑质中p-α-syn (S129)表达却未见统计学变化,进一步肯定了慢性鱼藤酮皮下注射可以作为构建PD动物模型的理想造模药物。鱼藤酮诱导的小鼠PD模型黑质和纹状体同时存在tauN368和p-α-syn (S129) 表达的统计学差异,该模型是研究PD发病中tauN368和α-syn相互作用机制的理想动物模型。
