泡沫分离过程中蛋白质变性机理研究进展
2018-10-16李天宇刘占燕纪欣彤
李天宇,刘占燕,纪欣彤,李 瑞
(济宁医学院生物科学学院,山东日照 276800)
在生物技术下游过程中,蛋白质的分离面临两个巨大的挑战:一,蛋白质在动植物细胞培养液或微生物发酵液中浓度低[1-3];二,蛋白质对高温、极端pH、极端离子强度和有机溶剂的耐受性低,容易丧失功能活性[4-6]。在工业上,蛋白质的分离主要依靠沉淀[7]、色谱分离[8]和膜分离[9]等技术,但是它们分离低浓度蛋白质的效率低且成本高,制成的蛋白质,特别是药物蛋白价格较高。因此,有必要开发新型的分离技术以降低蛋白质的分离成本。泡沫分离是一项基于界面吸附原理,以上升泡沫为分离介质的分离技术[10]。该技术具有低浓度下效率高、设备和工艺简单、投资少、能耗低和不产生污染等优点,在大幅降低蛋白质分离成本方面有巨大的潜力[11-13]。
在泡沫分离过程中,大量气-液界面的产生很容易造成蛋白质的变性,最终导致蛋白质活性收率的降低[14-16]。这极大的限制了泡沫分离技术在药物蛋白及酶等功能蛋白质分离领域的应用。因此有必要对泡沫分离过程中气-液界面诱导蛋白质变性的机理进行研究从而进行有效的抑制,以提高功能性蛋白质的分离效果。本文在综述了泡沫分离过程中界面诱导蛋白质变性研究进展的基础上,对其抑制方法进行了对比和总结,并提出了提高功能性蛋白质泡沫分离效果所需进一步研究的问题。
1 泡沫分离过程中的蛋白质变性
蛋白质分子同时具有亲水基团和疏水基团,是一种生物表面活性物质[17]。因此,它可以吸附在气-液界面上从而稳定气泡[18],这是泡沫分离蛋白质的可行性基础。气-液界面属于一种疏水性界面,当蛋白质分子吸附在该界面时,该界面会诱导蛋白质分子的结构发生不可逆的变化,从而导致蛋白质的变性[19-20]。因为气-液界面是蛋白质泡沫分离的介质,所以在该分离过程中蛋白质变性是一种常见现象。表1总结了泡沫分离过程中易变性的蛋白质及其相应的最大变性率。由于蛋白质的变性,泡沫分离的效果明显降低[14-15],因此有必要对泡沫分离过程中的变性机理进行研究从而采取有效的措施进行抑制。
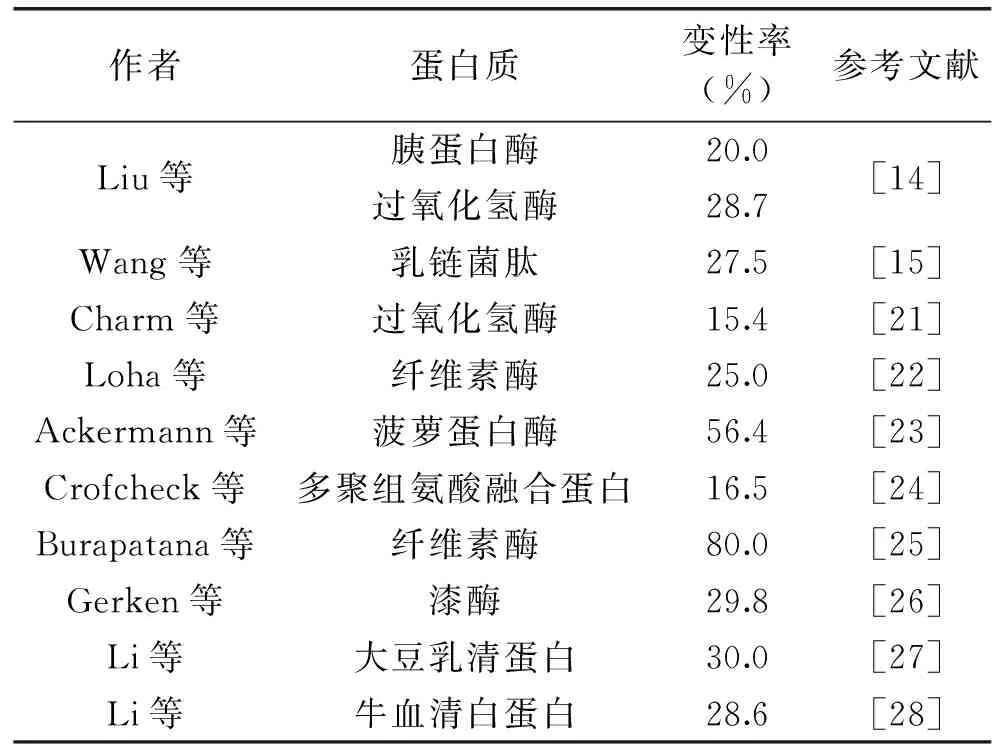
表1 泡沫分离过程中易变性的蛋白质及最大变性率Table 1 Denatured proteins and their maximaldenaturation ratio in foam fractionation
2 泡沫分离过程中蛋白质的变性机理
2.1 泡沫分离过程中蛋白质变性的分子机理
蛋白质分子是具有复杂空间结构的生物大分子,研究泡沫分离过程中蛋白质分子结构所发生的变化,是有效抑制其变性所需解决的关键问题之一。在泡沫分离塔中,气泡处于不断上升的状态,由于缺乏在线检测上升气泡表面蛋白质分子结构的方法,所以在以往的报道中,研究者们只能通过对比起泡前后溶液中蛋白质的分子结构来研究分离过程中蛋白质分子结构发生了何种变化,所采用的蛋白质分子结构检测方法一般为圆二色谱法和荧光光谱法[29-33]。由表2可知,泡沫对不同蛋白质分子结构的影响是不同的,一般来说,泡沫不会导致刚性蛋白质分子的二级结构发生变化,但是会导致所有蛋白质的三级结构发生变化[31-32]。因为很多蛋白质的功能活性主要决定于其三级结构,所以泡沫很容易诱导蛋白质的失活[34]。

表2 泡沫诱导蛋白质分子结构变化分析方法及主要研究结果Table 2 Analytical methods and main results of foam-induced structural changes of proteins
尽管上述研究方法能证实泡沫分离前后的蛋白质分子结构变化,但是由于上升气泡表面(即气-液界面)上的蛋白质分子结构无法检测,所以无法阐明这种变化是如何发生的。因此,检测气-液界面上的蛋白质分子结构成为阐明泡沫分离过程中界面诱导蛋白质变性分子机理的关键。随着检测技术的不断进步,表面扩张流变法[35]、红外反射吸收光谱法[36]、紫外-可见反射吸收光谱法[37]和频振动光谱法[38]等检测方法的出现为解析气-液界面上(即静态水表面)的蛋白质分子结构提供了技术支持。陈战教授[39]指出和频振动光谱可用于生物大分子界面结构的分析。Engelhardt等人[40]利用和频振动光谱研究了β乳球蛋白分子在气-液界面上(即静态水表面)的基团取向,解释了β乳球蛋白分子的稳泡机理。虽然这些方法能很好地解析气-液界面上的蛋白质分子结构,但是近年来,只有Barackov等[36]将其用于泡沫分离过程中蛋白质变性的分子机理研究。Barackov等[36]利用红外反射吸收光谱分析了β-酪蛋白和溶菌酶在静态水表面上的二级结构,并结合泡沫分离前后蛋白质分子结构的变化解析了泡沫分离过程中这两种蛋白质分子结构变化的历程。研究表明,当溶菌酶吸附在气-液界面上时,其分子结构会展开,但是当从气-液界面解吸后展开的分子结构无法恢复到初始的状态,发生了不可逆的结构变化,因而失去了活性。但是β-酪蛋白在吸附和解吸过程中其二级结构均未发生明显地变化,因此,泡沫分离过程中蛋白质变性的主要原因是气-液界面诱导的不可逆的分子结构变化。
根据上述研究结果,绘制了泡沫分离过程中界面诱导蛋白质变性的基本原理示意图,如图1所示。在起泡过程中,蛋白质分子吸附在气-液界面上,分子空间结构展开,其内部的疏水基团暴露于气相,使蛋白质分子能够稳定地吸附在界面上[35,37]。在消泡过程中,吸附的蛋白质分子要从气-液界面上解吸下来,但是在该过程中却无法恢复到天然的分子构象进而失去活性。蛋白质在气-液界面上的吸附是其成功泡沫分离的关键,因而气-液界面诱导的蛋白质分子结构的变化是不可避免的。尽管前人的研究已揭示了泡沫分离过程中界面诱导蛋白质变性的基本原理,但是关于气-液界面诱导蛋白质变性的基础研究还相对较少,所以真正从分子水平上阐明这一问题还需要广大研究者们的长期努力。
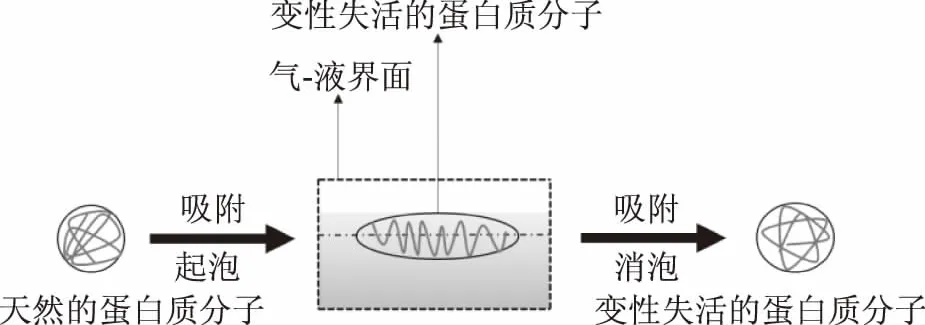
图1 泡沫分离过程中界面诱导蛋白质变性基本原理示意图Fig.1 Schematic diagram of interface-inducedprotein denaturation in foam fractionation
2.2 泡沫演化在界面诱导蛋白质变性中的作用机理
在泡沫分离塔内,随着泡沫的上升,泡沫的形态不断演化,主要表现为以下两个方面:一,由于重力泡沫中的液体逐渐排出泡沫回流到主体液相中,泡沫中的持液量逐渐减少,泡沫逐渐变干;二,泡沫内相邻气泡间的液膜逐渐变薄,气泡间气体扩散和气泡聚并加剧,气泡逐渐变大,气-液界面总面积逐渐减少[41-43]。随着泡沫的不断演化,泡沫中的蛋白质的浓度逐渐升高,与此同时吸附在气-液界面上蛋白质的量逐渐降低[44]。在气-液界面诱导人体免疫球蛋白G1聚集的研究中,Bee等[45]发现人体免疫球蛋白G1聚集体的产生量与气-液界面积的变化呈线性相关。Wiesbauer等[46]在研究气-液界面积诱导人体生长激素聚集的过程中也发现了相似的规律。因此,气-液界面积变化对界面诱导的蛋白质变性有重要的影响。在上述研究的基础上,Li等[44,47]以牛血清白蛋白(BSA)为目标蛋白,研究了泡沫演化对BSA聚集的影响,结果表明,随着泡沫的演化,泡沫内的气-液界面积不断减少,吸附的BSA不断从气-液界面上解吸下来且浓度增加,所以容易彼此间相互聚集,最终导致BSA的聚集率逐渐增加,其原理示意图如图2所示;此外,BSA聚集率随气-液界面积减少量的变化与泡沫排液紧密相关:当泡沫含水量较高时,BSA聚集率随气-液界面积减少量的增加缓慢增加;当泡沫含水量较低时,BSA的聚集率随着气-液界面积的减少量的增加快速线性增加,泡沫演化程度的加剧会明显增加消泡液内BSA聚集体的相对含量,严重降低了BSA单体的回收率和浓缩比。由于强化泡沫排液(即加剧泡沫演化)是提高蛋白质富集比的主要方法[48],所以如何解决蛋白质富集比提高与蛋白质变性加剧之间的矛盾,对于有效提高泡沫分离效果至关重要。综上所述,研究泡沫演化对泡沫分离过程中蛋白质变性影响的作用机理对于有效提高蛋白质的泡沫分离效果有重要的意义。但是,目前的研究体系仅限于为数不多的有聚集现象的蛋白质,缺少泡沫演化对无聚集现象蛋白质泡沫分离过程中变性影响的研究,因而尚难形成基本的规律。
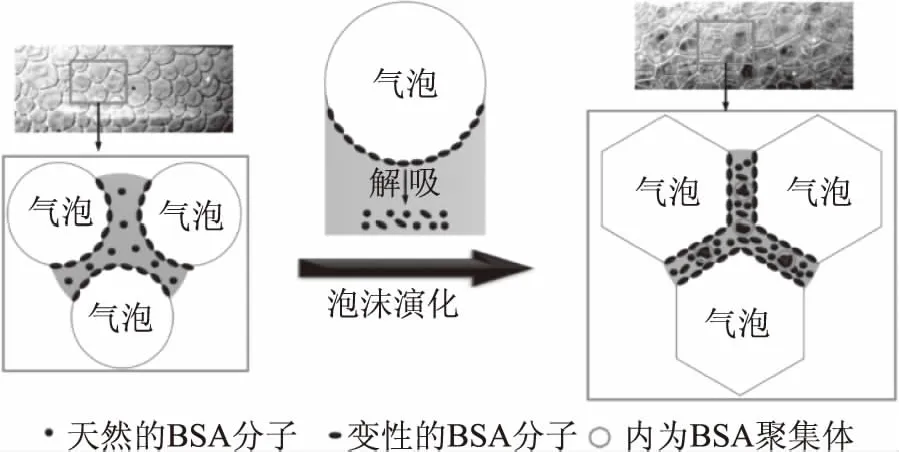
图2 泡沫演化加剧气-液界面诱导牛血清白蛋白(BSA)聚集原理示意图Fig.2 Schematic diagram of foam evolution enhancingaggregation of bovine serum albumin(BSA)
3 泡沫分离过程中蛋白质变性的抑制
作为一项蛋白质分离技术,泡沫分离的目的就是为了实现蛋白质的富集和回收。因此,抑制泡沫分离过程中蛋白质变性的方法必须同时满足以下两个条件才能得以使用:一,不能明显降低泡沫分离的效果;二,能有效抑制蛋白质的变性。目前,泡沫分离过程中蛋白质变性的机理尚未被清楚阐明,不能为抑制变性提供充分的理论支撑。但是,一些研究者已经在抑制泡沫分离中蛋白质活性损失方面做出了努力,下面将对这些工作进行分析总结。
3.1 泡沫分离过程中蛋白质变性的提前抑制
溶液的理化条件是影响蛋白质分子结构的重要因素,而蛋白质分子结构是影响泡沫分离过程中蛋白质变性因素的关键因素[33,49]。因此,一些研究者通过提前改变进料液的理化条件来减少泡沫分离过程中的蛋白质变性,以提高泡沫分离效果。Li等[49]研究发现随着pH由3.0逐渐增加到7.0,BSA的分子结构逐渐收缩,结构稳定性增加,使得泡沫分离过程中BSA的聚集率逐渐降低。Liu等[14]和Loha等[22]也通过改变进料液的pH降低了蛋白质变性率,提高了泡沫分离效果。此外,Zhang等[50]通过向体系中添加不容的无机盐改变溶液的离子强度,提高乳链菌肽的结构稳定性,提高了泡沫分离过程中乳链菌肽的活性回收率。
除了改变溶液的pH和离子强度等参数外,提前向进料液中添加蛋白质保护剂也能有效抑制泡沫分离过程中的蛋白质变性。Wang等[15]通过添加海藻糖来降低泡沫分离过程中乳链菌肽的活性损失,结果显示当海藻糖浓度为1 g/L时,乳链菌肽的活性损失由27.5%降低到了5.9%。研究者只是认为海藻糖是一个有效的蛋白质稳定剂,对于海藻糖抑制泡沫分离过程中乳链菌肽失活的机理并未阐明。Li 等[51]发现β-环糊精能与BSA分子中的芳香族氨基酸发生相互作用,并且能辅助变性的蛋白质复性[52],所以通过提前向进料液中添加β-环糊精有效降低了泡沫分离过程中的BSA聚集。此外,他们还利用β-环糊精减少了泡沫分离过程中菠萝蛋白酶的变性,使其活性收率和比酶活分别提高了34.1%和110.7%[53]。但是β-环糊精能降低蛋白质分子在气-液界面上的吸附,所以添加β-环糊精不利于蛋白质质量收率的提高[51,53]。
3.2 泡沫分离后变性蛋白质的复性
对于泡沫分离来说,消泡是不可缺少的单元操作[54]。在消泡过程中,吸附的蛋白质从气-液界面上解吸下来溶解到消泡液中。由图2可知,解吸的蛋白质分子由于无法恢复到天然的分子构象而失去活性。由于改变溶液的理化条件有可能以牺牲蛋白质的质量收率来提高其活性收率[51,53],所以一些研究者在不降低蛋白质质量收率的前提下,在消泡过程中通过复性解吸的蛋白质来提高其活性收率。Burapatana等[55]通过向消泡液中添加β-环糊精来降低泡沫分离过程中纤维素酶的活性损失,结果表明β-环糊精可以使消泡液中纤维素酶的酶活提高3倍多,这是因为β-环糊精作为人工分子伴侣可以辅助变性的蛋白质复性[56]。Li等[57]利用含吐温20的消泡剂在消泡的同时有效抑制了泡沫诱导的大豆乳清蛋白的聚集,使得消泡液中的蛋白质沉淀减少了80%。由此可见,通过复性泡沫分离后变性的蛋白质从而提高活性收率的方法是可行的。并且相对于改变溶液的理化条件来说,该方法更有利于泡沫分离效果的提高,但是相关报道却寥寥无几。
4 结论与展望
随着生物技术的快速发展,大量的重组和非重组蛋白质相继实现了工业化生产。目前,发酵液或细胞培养液中蛋白浓度普遍偏低,这就为具有低浓度下效率高和成本低等优点的泡沫分离技术的工业化应用提供了机会。但是,泡沫分离技术仅在分离发酵液中乳链菌肽的过程中实现了工业化应用,在蛋白质分离方面的工业化应用还未见报道。究其原因,主要是因为泡沫分离蛋白质的基础理论研究,特别是分子水平的研究,还十分薄弱。
气-液界面诱导的蛋白质分子结构变化是泡沫分离过程中蛋白质变性的根本原因。但是,大量的气-液界面又是蛋白质泡沫分离的唯一介质,为了解决这个矛盾从而促进泡沫分离蛋白质的工业化生产,未来的研究可以从以下三个方面进行:一、加强泡沫分离蛋白质过程的分子水平研究,借助分子模拟技术研究气-液界面吸附和解吸过程中蛋白质分子的结构变化及传质规律,更为深入得阐明气-液界面诱导的蛋白质变性机理;二、开展气-液界面诱导蛋白质变性动力学的研究,确定泡沫分离过程中导致蛋白质最大变性速率的关键阶段,阐明气-液界面诱导蛋白质变性的宏观规律;三、开展泡沫分离过程中蛋白质变性抑制机理的研究,阐明气-液界面解吸过程中蛋白质分子与变性抑制剂的相互作用机理及其复性动力学,为气-液界面诱导蛋白质变性的有效抑制提供理论依据。
