微囊化Penicillium purpurogenum Li-3细胞的制备及其催化性能研究
2018-10-16黄晓林欧阳巧凤沈瑞麟吴廷华
黄晓林,曹 红,欧阳巧凤,沈瑞麟,李 春,吴廷华,*
(1.浙江师范大学物理化学研究所,浙江金华 321004;2.嘉兴学院生物与化学工程学院,浙江嘉兴 314001;3.石河子大学化学化工学院,新疆石河子 832003;4.北京理工大学生命科学与技术学院,北京 100081)
甘草酸(Glycyrrhizic acid,GL)具有抗炎症、抗病毒、抗肿瘤、抗过敏等作用,在食品中常作为一种甜味剂使用[1-4],但甘草酸分子极性较强,不易穿透细胞膜,因而生物功效受到影响。单葡萄糖醛酸基甘草次酸[5-8](Glycyrrhetic acid 3-O-mono-β-D-glucuronide,GAMG)作为甘草酸衍生物,其分子极性适中,较易穿透细胞被人体充分吸收利用,并且甜度和安全性也更高[9-12]。所以GAMG被认为是发挥甘草酸功效的最佳分子形态。由产紫青霉(PenicilliumpurpurogenumLi-3)[9]表达的β-葡萄糖醛酸苷酶能够定向催化GL水解外端的一个葡萄糖醛酸基生成GAMG。
相比于化学法合成GAMG,生物法具有条件温和、反应速率高、能耗低、环境友好等优点[13-18],是合成GAMG最佳选择[19]。然而传统游离微生物细胞在生物转化过程中存在细胞重复利用率低、需菌量大、倒罐易染菌、对培养环境敏感等缺点,微胶囊固定化细胞技术为游离细胞培养过程增强细胞逆境耐受能力、增加底物的转化量、提高微生物全细胞催化的稳定性和重复利用率提供技术保障。
关于固定化产紫青霉细胞的研究,叶海[20]等采用吸附法以聚氨酯泡沫固定化产紫青霉细胞,其优点在于相比于游离细胞其催化周期缩短了一半,但是固定化细胞容易脱落,重复利用性差。曹红[21]等利用壳聚糖-海藻酸钙微胶囊制得了固芯微囊化产紫青霉细胞,固定化细胞的稳定性和重复利用率得到提高。王彩霞[22]等研究硅藻土改性海藻酸钙固芯微球固定化产紫青霉细胞,表明硅藻土能够提高固定化细胞催化活力。蔡静晓[23]等在制得壳聚糖-海藻酸钙固芯微囊化产紫青霉细胞的基础上,又研究了固芯液化技术对产紫青霉细胞使用性能的影响,结果显示,液芯微囊化细胞在细胞的生长情况、传质性能和催化活性均优于固芯,但制备步骤较繁琐。为了进一步简化工艺,温和反应条件,增大微胶囊内部细胞的生存空间,本文选用具有生物相容性的海藻酸钠(SA)和羧甲基纤维素钠(CMC)为囊材,采用两步法制备液芯微胶囊,研究液芯微胶囊固定化产紫青霉细胞(简称液芯微囊化细胞)的制备条件及其催化性能,考察不同因素对微囊化细胞直径、机械强度、破损率、催化性能的影响,为不断提高产紫青霉全细胞生物催化剂在甘草酸生物转化体系中的使用效率提供技术与方法。
1 材料与方法
1.1 材料与仪器
产紫青霉(PenicilliumpurpurogenumLi-3) 实验室保存菌种;甘草酸 新疆天山制药厂,纯度70%;氯化钙 上海强顺化学试剂有限公司,分析纯;羧甲基纤维素钠(分析纯)、海藻酸钠(化学纯)、NaNO3(分析纯)、K2HPO4(分析纯)、MgSO4·7H2O(分析纯)、KCl(分析纯) 国药集团化学试剂有限公司;产酶诱导培养基:甘草酸 2.8 g·L-1,NaNO33.0 g·L-1,K2HPO40.8 g·L-1,MgSO4·7H2O 0.5 g·L-1,KCl 0.5 g·L-1,FeSO4·7H2O 0.001 g·L-1,250 mL锥形瓶分装100 mL,于120 ℃高压蒸汽灭菌20 min。
BT101L型蠕动泵 保定雷弗流体科技有限公司;B-011003型酸式滴定管 上海垒固仪器有限公司;AR323CN型电子天平 奥豪斯仪器(上海)有限公司;Agilent 640型红外分光谱仪 美国安捷伦公司;THZ-C型恒温振荡器 太仓市实验设备厂;CRYODOS-50型冻干机 西班牙艾提艾斯科学医药公司;UltiMate-3000型高效液相色谱仪 美国Dionex公司。
1.2 实验方法
1.2.1 产紫青霉菌悬液的制备 配制产酶诱导培养基,产紫青霉接种量5%,32 ℃ 150 r/min恒温振荡培养96 h后,离心(12000 r/min,10 min)弃上清收集菌体,0.9%的生理盐水洗涤菌体,重悬,重复操作三次后用生理盐水制成5000 mg/L的产紫青霉菌悬液,于4 ℃冰箱中保存。
1.2.2 微囊化产紫青霉细胞的制备 配制30 mL浓度为1.0% w/v的CMC与浓度为1.5% w/v的CaCl2的混合溶液,无菌条件下加入3% v/v菌悬液,磁力搅拌均匀。混合液经蠕动泵(120 r/min)匀速滴入经磁力搅拌的100 mL 1.0% w/v的SA溶液后,迅速形成球状微囊化细胞,滴加结束后搅拌5 min,用孔径约1 mm漏网滤去SA溶液,无菌水冲洗三次微囊化细胞,滤纸吸干其表面水分,随后置于100 mL的1% w/v的CaCl2溶液中静置固化囊膜30 min,再经无菌水冲洗三次,即得微囊化产紫青霉细胞,以上所需溶液除菌悬液均120 ℃高压蒸汽灭菌20 min后冷却至室温使用。
1.2.3 微胶囊宏观形态表征 按1.2.2实验方法制得微胶囊,将微胶囊分为三组,a:不做任何处理;b:冷冻干燥36 h;c:经1.2.6.3中方法生物催化第1批次后回收的微囊化细胞,滤去培养基,经去离子水冲洗;用普通相机分别对三组拍照。
1.2.4 红外分析(FT-IR)分析 样品充分干燥后,取少量样品与KBr混合,研细、压片,光谱扫描范围4400~400 cm-1,扫描速度中速,扫描16次。
1.2.5 不同因素对微囊化细胞的影响 分别对CMC浓度、SA浓度、滴注液中CaCl2浓度、固化过程CaCl2浓度、加菌量进行优化,各因素优化条件如表1所示,其余按照1.2.2项下的方法与条件制备微囊化细胞,以各因素对微囊化细胞直径、机械强度、破损率及催化特性的影响为考察指标,各因素在前一因素最佳水平下逐级优化。

表1 各因素优化条件Table 1 Optimization conditions of various factors
1.2.6 指标测定

1.2.6.2 微囊化产紫青霉细胞物理机械强度的测定 采用单轴按压法[25]测定微囊化产紫青霉细胞机械强度,用药匙在电子天平上按压微囊化细胞,临界破裂时电子天平最大读数表示其机械强度,测量30粒微囊化细胞,取平均值。

色谱分析条件:戴安UltiMate-3000,色谱柱:InertSustain C18,ODS(250 mm×4.6 mm i.d.,5 μm),检测器:SPD,工作站:LCsoLution,检测波长:254 nm,柱温箱:30 ℃,进样量:20 μL,流速:0.7 mL/min,流动相:甲醇:重蒸水(加入适量醋酸,pH3.0)=81∶19。

1.2.7 微囊化产紫青霉细胞重复利用 微囊化细胞按1.2.6.3培养,每批次培养终点取样检测GAMG浓度,取出微囊化细胞无菌水冲洗三次,加入到新配产酶诱导培养基,进行重复利用催化反应,以微囊化细胞相对活性(%)=每批次生物转化反应结束时GAMG产率/第1批次生物转化反应结束时GAMG产率×100计算。
1.3 数据处理
微囊化细胞直径、破损率、催化特性、重复利用性均平行测量三次,机械强度平行测量30次,数据差异显著性分析采用SPSS 17.0软件,应用Origin 8.0软件作图。
2 结果与分析
2.1 微胶囊宏观形态分析
由图1可知,CMC与SA制备的是透光性良好的微胶囊(a),微胶囊球形度良好且表面光滑;冷冻干燥后的微胶囊(b),部分保持了球状,部分瘪皱,说明微胶囊具有一定抗收缩能力[26]。生物催化后的微囊化细胞(c),可以清晰看出微囊化产紫青霉细胞形态完整,晶莹通透,肉眼可见囊内菌丝,说明此微囊化环境对产紫青霉具有良好生物相容性。

图1 微胶囊及微囊化细胞的外观Fig.1 The appearance of microencapsule and microencapsulted cells注:a:微胶囊;b:冻干微胶囊;c:生物催化第1批次后,回收的微囊化细胞;“”代表比例尺为5 mm。
2.2 微胶囊样品红外分析
图2为不同样品的红外光谱图,从图2a可以看出样品CMC具有典型的特征峰,其中3424 cm-1是-OH伸缩振动,2923 cm-1是-CH2不对称伸缩振动,1615、1425 cm-1分别是-COO-的不对称伸缩振动峰和对称伸缩振动峰,1055 cm-1为伯醇C-O伸缩振动峰,1115 cm-1为CMC的醚键O-C-O。对比样品a、b,峰位置一致,红外分析结果表明CMC与氯化钙混合物可能仅仅发生物理共混,即CMC为Ca2+的增稠剂[27]。从图2c可见,样品SA在1300 cm-1处为C-C-H和O-C-H伸缩振动峰,1030 cm-1是由C-O-C伸缩振动引起[28]。图2d为SA与CaCl2混合物红外图谱,2923 cm-1处是环上的-CH伸缩振动,峰强度降低,是因为海藻酸钙的网状结构限制了六元环上-CH的伸缩振动,945 cm-1峰消失,882 cm-1峰减弱,说明部分羟基氧参与了配位反应,O-H的键能降低[29]。对比样品c、d红外图谱,说明SA与Ca2+发生了交联作用。样品e与a、b、c、d红外图谱对照可知,形成的微胶囊结构类似SA与Ca2+混合物。

图2 微胶囊样品红外图谱Fig.2 The infrared spectrum of microcapsule 注:a:CMC;b:CMC和CaCl2混合物;c:SA;d:SA和CaCl2混合物;e:微胶囊。
2.3 微囊化产紫青霉细胞工艺研究
2.3.1 滴注液中CMC浓度对微囊化细胞的影响 由图3a可知,随着CMC浓度增大,微囊化细胞直径明显减小,这是因为CMC浓度较低时,其粘度较低,对Ca2+的束缚能力较弱,Ca2+迅速向外扩散,与SA结合形成直径较大的微囊化细胞。当CMC浓度增大,芯材粘度增大,对Ca2+束缚的能力增强,Ca2+向外扩散速率降低,与SA结合形成直径较小的微囊化细胞。由图3b可知,随着CMC浓度增大,微囊化细胞的机械强度先增大后减小。机械强度先增大,是因为CMC粘度增大,对保持微囊化细胞形态具有一定支撑作用,增强了微囊化细胞的抗压能力、柔韧性,故破损率也较小,而当CMC粘度过大时,根据斯托克斯-爱因斯坦[30](Stocks-Einstein)方程(Dt=TKB/3πηd),溶液粘度η越大,扩散系数Dt越小,Ca2+向外扩散能力减弱,CMC对Ca2+的束缚作用加强,减少了SA与Ca2+的结合,囊膜的抗压能力减弱,破损率略上升;当CMC浓度为1.4%时破损率差异性显著(p<0.05),微囊化细胞具有较好的机械强度,而囊膜的抗压能力也较好,破损率最小。GAMG产率先增加后减小,这是由于CMC浓度增大,微囊化细胞的机械强度增加,破损率减小,产率增加;当CMC浓度过高,芯材粘度较大,会阻碍GL与GAMG在微囊化细胞中的扩散,使得GAMG产率降低。综上所述,CMC浓度为1.4%最佳。

图3 CMC浓度对细胞微囊化效果的影响Fig.3 Effect of the concentration of CMCon the microencapsulated cells注:同一指标字母相同,表示差异不显著(p>0.05), 字母不相同,表示差异显著(p<0.05);图4~图7同。
2.3.2 SA浓度对微囊化细胞的影响 如图4a,随着SA浓度增大,微囊化细胞的直径逐渐减小,这是因为Ca2+浓度固定时,SA浓度增大,Ca2+来不及向外扩散即与SA位点结合,SA浓度越大,Ca2+向外扩散距离越短,故形成的微囊化细胞直径越小。由图4b可知,随SA浓度增大,微囊化细胞的机械强度增大,破损率逐渐减小,这是因为SA浓度增大,Ca2+与SA位点结合越致密,微囊化细胞抗压能力增大,抗流体剪切能力增大。GAMG产率先增加后减小,是因为SA浓度低时,Ca2+与SA结合较疏松,利于底物的传入和产物传出,因此GAMG产率较大,而当SA浓度过大时,微囊化细胞结构致密,不利于产物与底物的扩散,进而导致了GAMG产率的减小。因此选用SA浓度为1.2%。
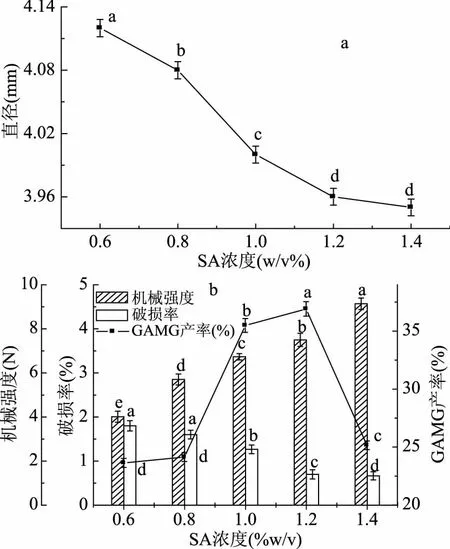
图4 SA浓度对细胞微囊化效果的影响Fig.4 Effect of the concentration of SA on the microencapsulated cells
2.3.3 滴注液中CaCl2浓度对微囊化细胞的影响 由图5a可知,随着CaCl2的浓度增加,微囊化细胞直径逐渐增大,是因为Ca2+浓度增大,由于浓度梯度推动力,Ca2+向外扩散能力增强,与SA结合形成较大直径的微囊化细胞[27]。图5b中微囊化细胞的机械强度先增大后持平,破损率先降低保持不变,这是由于CaCl2的浓度越大,SA与Ca2+凝胶结构越来越紧密,当Ca2+浓度恰好与浓度为1.2%的SA充分结合,则机械强度无法继续增大。GAMG的产率先增大后减小,当CaCl2的浓度为1.0%时,GAMG的产率最高,这是由于CaCl2的浓度较小时,CaCl2与SA所形成的凝胶结构较疏松,其表面包覆的多余的SA,则导致微囊化细胞表面通孔结构被堵塞,GAMG产率较小;当CaCl2的浓度越高时,SA与Ca2+结合越致密,传质受阻,导致了GAMG产率减小。在保证一定物理机械强度下,以GAMG产率最大化为优先,选择CaCl2浓度为1.0%。

图5 CaCl2浓度对细胞微囊化效果的影响Fig.5 Effect of the concentration of CaCl2on the microencapsulated cells
2.3.4 固化过程CaCl2溶液浓度对微囊化细胞的影响 固化囊膜过程是在微囊化细胞成形后,将微囊化细胞置于低于成囊CaCl2浓度的Ca2+溶液中,低浓度Ca2+可以从微胶囊外表面由外向内扩散,相比未固化的微囊化细胞,固化的微囊化细胞直径明显变小,随着固化过程CaCl2浓度增大,直径越来越小(见图6a)。这是由于成囊过程中较高浓度Ca2+滴入SA后,Ca2+向外扩散与SA位点结合,Ca2+扩散平衡后,微囊外层仍有较多SA,囊膜层也较厚,而放置在低浓度的Ca2+溶液,Ca2+由外向内扩散与微囊化细胞外层SA空缺位点结合,结构变得更加致密,因而直径逐渐减小。由图6b可知,固化过程CaCl2浓度对微囊化细胞的机械强度影响最大,破损率从54.0%降至0,机械强度也迅速增大。这是由于固化过程CaCl2浓度越大,更能充分与SA结合,使微胶囊囊膜结构更加致密,因而机械强度较大。固化过程CaCl2浓度增大,GAMG产率先增加后迅速减小,是因为固化过程CaCl2浓度较低时,Ca2+与SA形成的凝胶结构疏松,利于传质,而当固化过程CaCl2浓度增大,微囊化细胞结构致密,传质受阻较大,甚至底物较难传递到囊膜内,细胞因缺乏营养而生长代谢过程受阻,故GAMG降低。综上所述,固化囊膜过程CaCl2的浓度选择0.5%,此时GAMG产率最高、具有一定机械强度。

图6 固化过程CaCl2浓度对细胞微囊化效果的影响Fig.6 Effect of the concentration of the post cured CaCl2 on the microencapsulated cells
2.3.5 滴注液中加菌量对微囊化细胞的影响 由图7a可以看出,加菌量增加,微囊化细胞直径先增大后减小,加菌量为3.0%时差异性显著(p<0.05),直径最大。加入2.0%菌体,芯材粘度稍大,细胞直径较小,而菌体含量超过3.0%且继续增加时,对芯材有稀释作用,Ca2+浓度降低,Ca2+向外扩散能力减弱,微囊化细胞直径减小。图7b中,随着加菌量增加,机械强度先增大后减小,机械强度增大,是因为加入少量菌体,降低了芯材的粘度,促进了Ca2+与SA的结合,使机械强度增大,而加菌量越多,对Ca2+的稀释作用越大,能与SA结合Ca2+相应减少,从而降低了微胶囊结构的致密性,导致机械强度越来越小。随着加菌量增加,GAMG的产率先增大后减小,当加菌量为3.0%时,GAMG的产率最大。这是由于当加菌量过低时,微胶囊包埋的菌体量少,GAMG的产率不高;当加菌量增加时,微胶囊包埋的菌体量增加,形成了细胞团聚缠绕,细胞团内部的供氧困难,造成中心细胞团出现坏死现象[31],GAMG的产率降低。综上所述,选择加菌量为3.0%。
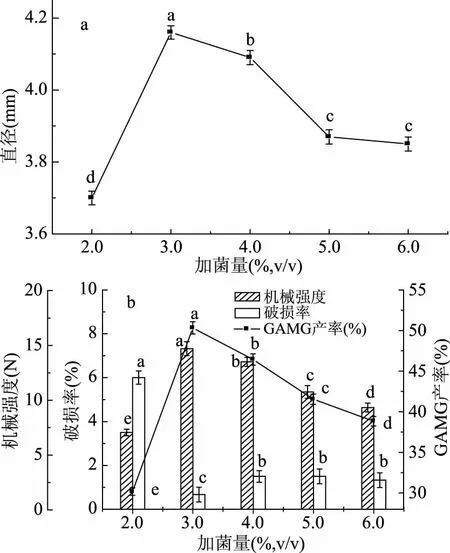
图7 加菌量对细胞微囊化效果的影响Fig.7 Effect of the concentration of cells on the microencapsulated cells
2.3.6 微囊化细胞重复利用 在最优条件下制备微囊化产紫青霉细胞进行重复利用实验,如图8所示,随着使用批次的增加,微囊化细胞的相对活性逐渐降低,但重复使用9次后微囊化细胞相对活性仍能达到56.9%。

图8 微囊化细胞重复使用Fig.8 Repeated use of microencapsulated cells
3 结论
以SA与CMC制备的微囊化产紫青霉细胞为载体,表征发现微胶囊表面平整,微胶囊的红外图谱表明样品为SA与CaCl2的混合物,可见SA与Ca2+发生交联作用形成了微胶囊,以微囊化细胞的直径、机械强度、破损率及催化特性为考察指标,优化微胶囊制备条件,最优制备条件为:羧甲基纤维素钠的浓度为1.4%,海藻酸钠的浓度为1.2%,CaCl2的浓度为1.0%,固化囊膜过程CaCl2浓度为0.5%,加菌量为3.0%,此条件下,微囊化细胞重复利用9次后,相对活性达到56.9%,具有较好的重复利用性能。
