红吉利粗肋草组培技术初报
2018-10-12高小坤
高小坤
(1.福建省林业科技试验中心,福建 南靖 363600; 2.福建省鑫闽种业有限公司,福建 福清 350301)
粗肋草(Aglaonemacommutatun)为天南星科(Araceae)粗肋草属(Aglaonema)多年生草本植物,原产亚洲东南部的泰国、越南、菲律宾、马来西亚和我国南部的多雨林地区。其叶片具有多样色彩或色斑镶嵌,美观大方而又朴素高雅,有较高的观赏价值;且耐荫耐湿、病虫害少,常被作为室内观赏和切叶植物应用[1-3]。红吉利(Aglaonemacommutatun′Big Apple′)是目前盆栽花卉市场上最受欢迎的粗肋草品种之一,2017年由泰国引进,与其它粗肋草品种相比,红吉利茎干粗壮,节间明显,叶片宽大且具有大面积颜色浓厚绚丽的红色斑块,开发潜力与市场前景广阔。粗肋草常规繁殖方法是分株繁殖和扦插繁殖[3],但常规繁殖方法存在母株利用率低、繁殖系数低、受环境条件限制多、费工费时、成本高等缺点,缺乏市场竞争力。目前粗肋草种苗生产主要通过组织培养技术进行扩繁,现已取得成功的粗肋草品种较少,主要为绿色系,而且不同品种组培技术差异较大,对于红吉利这一新优彩叶品种尚未见报[4-7]。本试验以红吉利的茎段为外植体开展组培快繁技术研究,旨在探索红吉利的高效繁育方法,为其工厂化育苗提供技术支撑,也可为其它彩叶粗肋草高效繁育技术提供参考。
1 材料与方法
1.1 材料
供试材料为红吉利优良单株上选取的带腋芽茎段。取自福建省鑫闽种业有限公司的粗肋草种质资源收集圃 。
1.2 方法
1.2.1 外植体预处理及消毒 选取健壮、无病虫害植株,从茎基部整株截断,剥除叶片,清洗茎段污垢。先在饱和洗衣粉溶液中轻轻震荡20 min,用毛笔刷轻轻刷洗去除表面尘埃,再用自来水冲洗1 h后备用。将清洗干净的茎段吸干水分后放入经高压灭菌过的玻璃瓶中,移至超净工作台。用75%酒精浸泡60 s后,再用无菌水冲洗3遍,分别置于装有0.1%HgCl2的玻璃瓶中,不断摇晃玻璃瓶消毒15、20、25 min,然后用无菌水清洗5~6遍后,将茎段切成带有1个腋芽的小段(外植体)接入培养基中,每个处理接种60瓶,每瓶1个外植体。
每7 d观察统计1次,28 d后统计污染率、死亡率、合格率以及生长情况,比较不同消毒时间对外植体的影响,确定最佳消毒时间。其中:污染率(%)=(污染数/接种数)×100%,死亡率(%)=(死亡数/接种数)×100%,合格率(%)=(1-污染率-死亡率)×100%。
1.2.2 腋芽萌发诱导 根据刘俊仙等[6]的研究结果,粗肋草的诱导采用水平放置接种方式效果最好。将消毒处理过的合格小茎段腋芽朝上分别水平接入诱导培养基上,培养基分别为MS 、B5、WPM添加6-BA 2.0 mg·L-1和NAA 0.2 mg·L-1,每个处理接种60瓶,每瓶1个外植体。
40 d后观察和统计外植体腋芽的萌芽率和外植体的形态变化,筛选出最佳诱导培养基。其中:萌发率(%)=(萌芽外植体数/外植体接种数)×100%。
1.2.3 芽丛继代增殖 采用正交试验L9(34)设计方法研究不同植物生长调节剂及蔗糖组合对红吉利芽增殖的影响,以MS+卡拉胶6.8 g·L-1为基本培养基,添加不同浓度的6-BA、NAA和蔗糖。将茎段诱导出来的芽丛分成单芽转接到继代增殖培养基中,每个处理接种20瓶,每瓶接种1个小芽。
40 d后观察丛芽的增殖情况和生长状况,相同培养基连续转接3代,继代周期40 d。
1.2.4 生根壮苗培养 采用正交试验L9(34)设计研究不同培养基对红吉利诱导生根的影响,以MS、1/2 MS、1/3 MS为基本培养基,分别添加不同浓度的IBA和蔗糖。切出增殖过程中生长健壮、叶片舒展、苗高2.0 cm以上的单株,分别接入培养基中,每个处理20瓶,每瓶5株,3次重复。
培养30 d后调查生根率、生根数以及生长状况,确定红吉利最佳生根培养基。
1.2.5 培养条件 培养温度为25~27 ℃、光照时间12 h·d-1、光照强度1500~2000 lx。
2 结果与分析
2.1 消毒时间对外植体的影响
由表1可知,HgCl2为消毒剂,在一定范围内,随着消毒时间延长,污染率降低,但死亡率明显升高。HgCl2消毒15 min时,外植体的污染率较高,达到58%。死亡率较低,合格率只有38.3%。当消毒时间为20 min时,污染率明显下降,但死亡率增加,合格率达到63.3%;当消毒时间为25 min时,污染率进一步降低,但死亡率明显升高,达到28.3%,合格率为48.3%。因此,从外植体合格率来看,用75%酒精消毒60 s后再用0.1% HgCl2消毒20 min,对于红吉利外植体消毒效果最好。
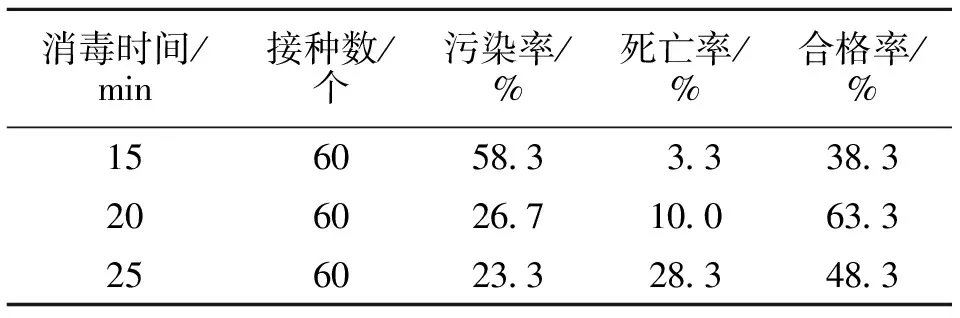
表1 HgCl2消毒时间对外植体的影响
2.2 基本培养基对腋芽诱导的影响
将消毒后的红吉利茎段接入到3种基本培养基中,培养10 d后,3种基本培养基中红吉利茎段上的腋芽开始萌动,20 d后茎段开始膨大,渐渐的形成愈伤组织,随着腋芽的萌发,其周边愈伤组织出现绿色芽点,慢慢长出小芽,说明红吉利在3种基本培养基中都能萌发出健壮的腋芽,但是腋芽基部形成的愈伤组织形态特征以及腋芽萌发情况存在差异(表2)。在MS培养基中,腋芽萌发率最高,达到96.7%,腋芽基部形成愈伤是绿色的、致密的,萌发出的小芽最多,平均达到3.8个;B5培养基次之,腋芽萌发率为93.3%,愈伤组织呈绿色、黄绿色,平均萌芽2.3个;WPM培养基效果最差,形成的愈伤组织呈黄绿色,较为疏松,萌发的小芽最少。这说明MS比B5、WPM更适合作为红吉利腋芽萌发的诱导培养基。
2.3 不同植物生长调节剂及蔗糖组合对芽增殖的影响
正交试验结果(表3)表明,6-BA浓度、NAA浓度、蔗糖浓度3个因素的R值分别为1.49、0.66、0.17,即这3个因素对红吉利芽增值影响程度依次为6-BA浓度>NAA浓度>蔗糖浓度,说明以MS作为红吉利继代增殖基本培养基,6-BA浓度对红吉利芽增殖起主要作用,其次是NAA浓度,蔗糖浓度对红吉利芽增值的影响最小。

表2 基本培养基对腋芽萌发的影响
通过方差分及多重比较(表3)可知,6-BA浓度(F=36.14>F0.05(2,2)=19)对于红吉利芽增值的影响差异显著,而NAA浓度(F=7.1 表3 红吉利丛芽诱导正交试验 *:ki为水平i的平均值;R为极差;F为方差值;F0.05(2,2)=19,F0.01(2,2)=99;同列数值后小写字母为差异达0.05显著水平;下同。 由表4可知,生根培养基中,IBA浓度、蔗糖浓度以及基本培养基配比这3个因素中对红吉利生根影响程度依次为:IBA>基本培养基>蔗糖,其中IBA对红吉利生根影响达极显著水平(F=784>F0.01(2,2)=99),蔗糖和基本培养基对红吉利生根影响不显著(F=1 表4 红吉利生根诱导正交试验 本研究以红吉利带腋芽的茎段为外植体,对其组织培养技术进行初步探索。试验结果表明,采用75%酒精消毒60 s后,再用0.1% HgCl2消毒20 min,外植体合格率最高;红吉利腋芽萌发的最佳诱导培养基为MS,腋芽萌发率达到96.7%,萌发出的小芽生长健壮且数量最多,平均达到3.8个;红吉利继代增殖最佳培养基为MS+6-BA 3.0 mg·L-1+NAA 0.1 mg·L-1+蔗糖20 g·L-1,生根诱导最佳培养基为1/2 MS+IBA 0.2 mg·L-1+蔗糖20 g·L-1。 外植体消毒是植物离体组织培养所要进行的第一步,是愈伤组织诱导和丛生芽诱导的基础。本研究外植体消毒合格率最高仅为63.3%。现有的研究表明,不同种类的灭菌剂组合,对粗肋草外植体的灭菌效果与单一灭菌剂不同[8]。这意味着粗肋草外植体消毒处理方法还有很大的改进和提升空间,可采用多种灭菌剂进行组合配比,然后对消毒效果进行比较,进而筛选出更优的消毒方法。培养基种类和生长调节剂种类与浓度、蔗糖浓度均影响着粗肋草的诱导增殖与生根,也会对粗肋草组织培养过程中的褐化产生影响。生产时,常常通过添加抗坏血酸、L-半胱氨酸等抑制褐化现象的发生,而抗褐化剂的添加,一定程度上又会影响到粗肋草继代增殖效果。本试验所得到的最佳培养基配方是基于诱导、继代增殖或生根某一特定环节的,因此,从试验得出的最佳培养基配方,应用到生产实践,还需进一步探索粗肋草组培育苗过程中的各种因素的平衡点,使粗肋草在实现诱导率最高的同时,能顺利进入继代增殖环节获得最高的增殖系数,进入生根培养环节能获得生根较好、个体壮实的组培苗,同时还能兼顾生产成本,实现粗肋草组培育苗生产效益最大化。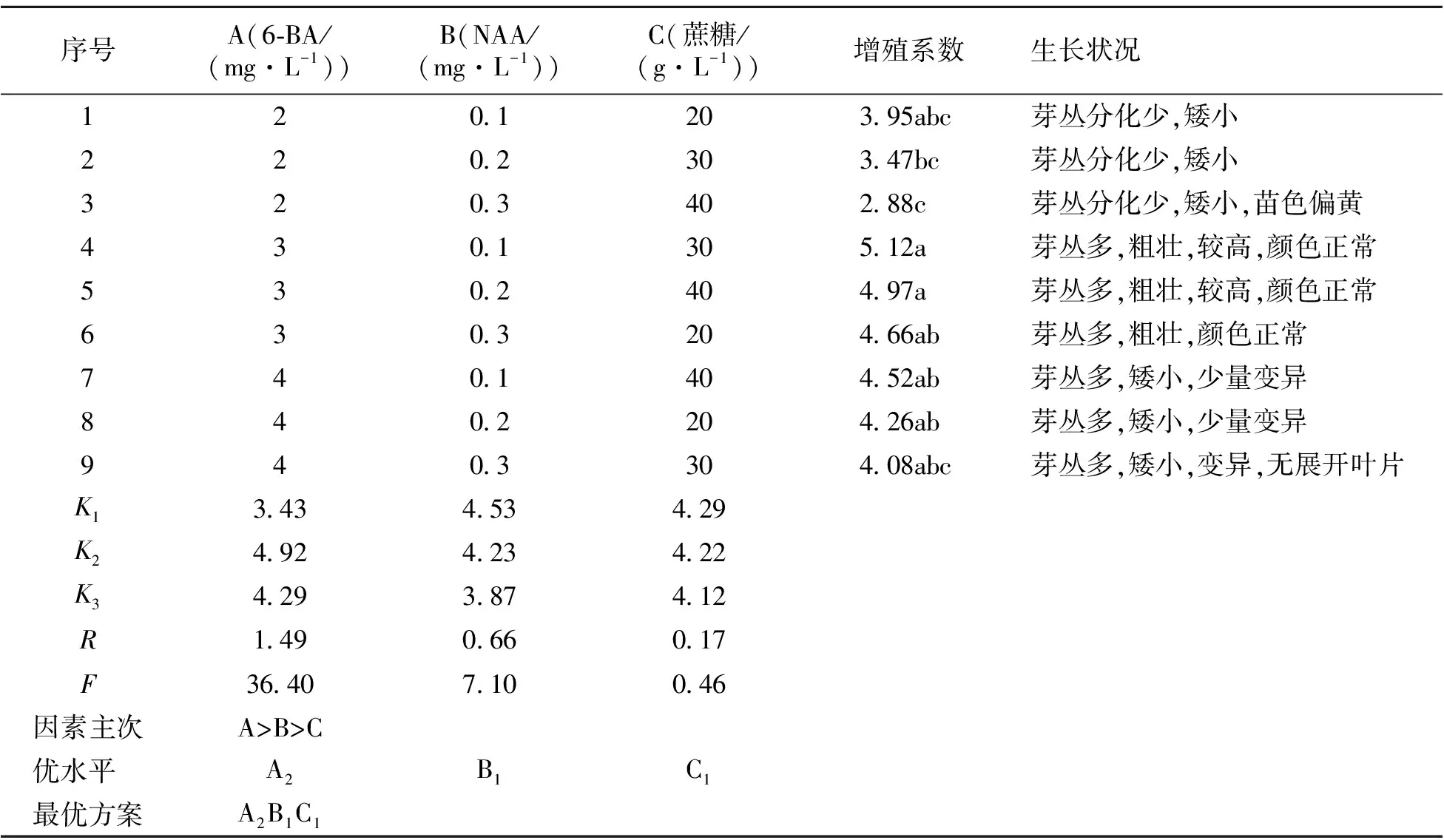
2.4 不同培养基对生根的影响
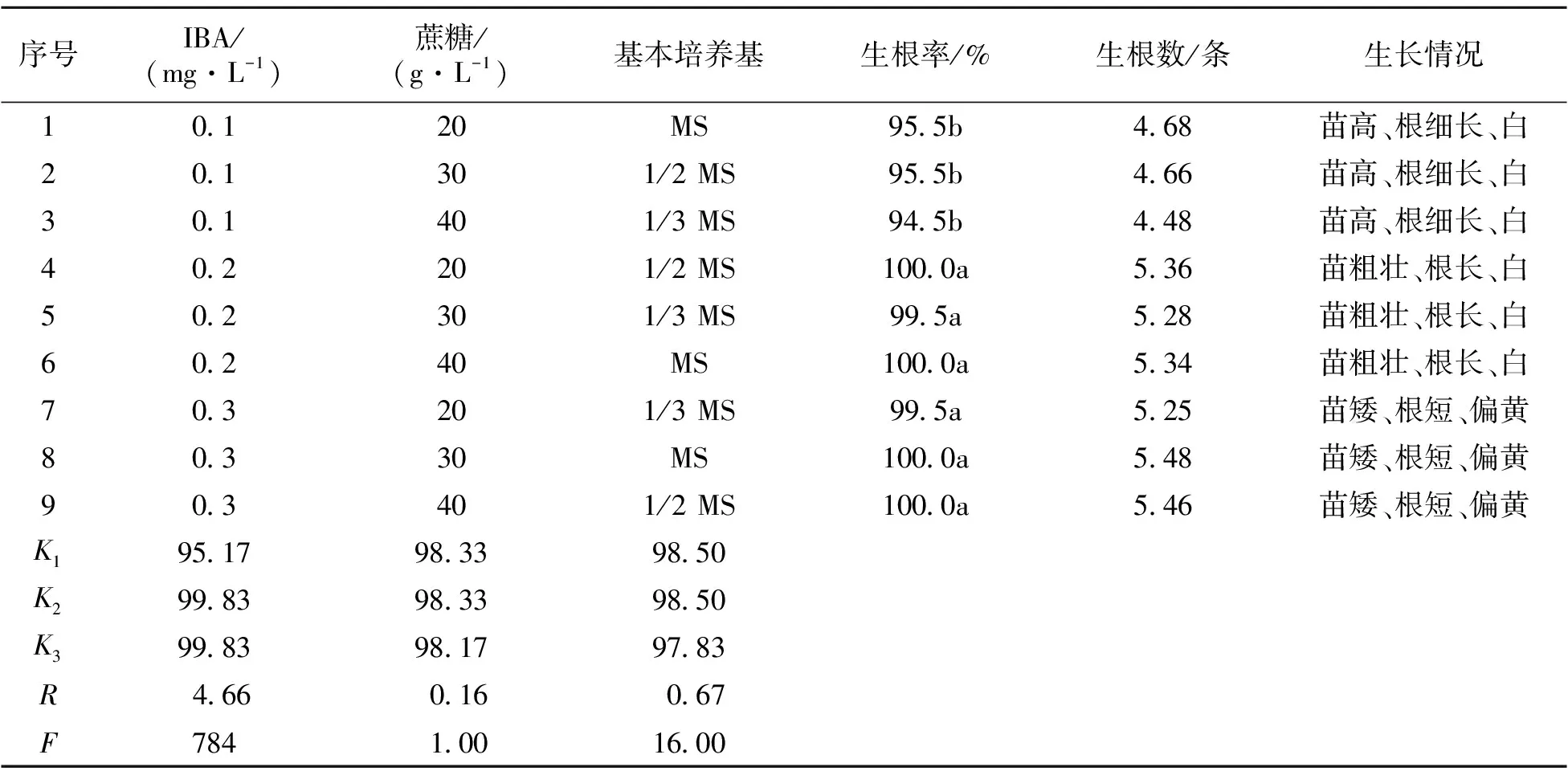
3 结论与讨论
