基于DCE-MRI定量参数的胶质瘤自动分级研究
2018-10-08南海燕张欣颜林枫杨洋韩宇王文崔光彬
南海燕,张欣,颜林枫,杨洋,韩宇,王文,崔光彬
作者单位:
空军军医大学唐都医院放射诊断科,西安 710038
胶质瘤是危害人类健康的主要恶性肿瘤之一[1]。世界卫生组织根据病理组织学标准将其分为Ⅰ~Ⅳ四个级别,其中Ⅰ级和Ⅱ级为低级别胶质瘤(low grade glioma,LGG),Ⅲ级和Ⅳ级为高级别肿瘤(high grade glioma,HGG)。胶质瘤分级与治疗和预后密切相关,但病理组织学检查是有创的,且不能全面反映肿瘤的异质性及恶性程度,亟需开发一种无创、高效的胶质瘤术前诊断技术[2]。
磁共振成像(magnetic resonance imaging,MRI)以无创性、高组织分辨力等优势成为肿瘤诊断常用技术,但常规MRI检查难以明确胶质瘤的级别。研究表明,HGG血管内皮细胞增生明显,瘤内新生微血管生成速率更快,新生不成熟的微血管较LGG增多,通透性更高。动态对比增强磁共振成像(dynamic contrast-enhanced MRI,DCEMRI)技术通过动态监测对比剂在体内的吸收、代谢等药代动力学过程,可以获得反映组织微循环通透性的定量参数,因此,在胶质瘤分级诊断中具有重要的应用潜力[3-8]。然而,现有的DCEMRI影像诊断研究多采用受试者工作曲线(receiver operating characteristic curve,ROC)方法,对各参数的诊断性能进行评估,难以对肿瘤进行个体化预测[9]。随着人工智能技术的快速发展,基于机器学习技术的计算机辅助诊断日益受到重视[10-11]。机器学习能自动挖掘数据内在的差异化模式,筛选与分类目标相关的特征信息,得到自适应的分类预测模型。因此,基于DCE-MRI定量参数信息,结合高效的机器学习分类技术,构建胶质瘤术前自动分级诊断系统,对于胶质瘤诊断、治疗具有很大的指导意义[12]。
1 材料与方法
1.1 资料
本研究共搜集了98例在我院经手术病理证实的胶质瘤患者,其中,LGG患者28例(Ⅰ级3例,Ⅱ级25例),HGG 患者70例(Ⅲ级20例,Ⅳ级50例)。所有患者均在病灶穿刺或手术切除前行常规MRI扫描及DCE-MRI检查。该研究经唐都医院伦理委员会批准同意,所有患者检查前均被告知检查内容,自愿参与扫描,并签署知情同意书。
1.2 方法
1.2.1 研究方案
本研究主要分析流程见图1。首先,基于DCE-MRI图像进行定量参数的计算;然后,在每一幅参数图像上,对整个肿瘤区域进行基于像素水平的直方图统计,得到各参数的特征信息;接着,采用特征选择方法对特征集进行筛选,挑选与胶质瘤分级相关的最优特征组合,并使用支持向量机(support vector machine,SVM)分类和10-fold交叉验证的方式,对定量参数的分类性能进行评估与比较。
1.2.2 MRI数据采集
本实验扫描采用GE公司的Discovery MR750 3.0 T超导型磁共振仪,头颅8通道相控阵线圈,均行常规MRI和DCE-MRI序列扫描。常规序列包括:T1WI及T1WI增强图像(contrast-enhanced T1WI,T1ce),T1ce扫描在DCE-MRI扫描之后进行。其扫描参数如下:TR 1750 ms,TE 24 ms,层厚5 mm,层间距1.5 mm,矩阵大小为256×256,视野240 mm×240 mm,激励次数为1。DCE-MRI扫描采用动态梯度回波T1,其成像参数为:TR 2.9 ms,TE 1.3 ms,反转角12°,视野240 mm×240 mm,层厚2.5 mm,层间距为0 mm,矩阵大小为128×128,时间分辨率为4 s,连续扫描50个时相,第1~4个时相位蒙片,第5个时相开始经肘静脉由高压注射器以2 ml/s的速度注入钆双胺对比剂(0.2 ml/kg),对比剂注射完毕后,即刻以同样速度注入15 ml生理盐水冲洗导管,以减少团注后对比剂的残留,总扫描时长为3 min 20 s。
1.2.3 图像处理
将DCE-MRI图像数据导入NordicICE软件(版本号4.0,NordicNeuroLab,Bergen,Norway),使用DCE模块进行定量参数的计算[9]。计算中,在动态增强序列图像由时间亮度信号转换到时间浓度信号时,使用固定T1值(1000 ms)。在评估动脉输入函数(arterial input function,AIF)时,使用软件自带的基于群组水平(population-based)的AIF曲线。这里,选用Extended Tofts双室模型模拟对比剂在血管(血浆)空间与血管外细胞外空间(extravascular extracellular space,EES)之间的交换过程[13]。共得到5个定量参数,分别为:AIF曲线下面积(AUCAIF)、容积转运系数(Ktrans)、返流系数(Kep)、血管外细胞外间隙容积分数(Ve)和血浆容积分数(Vp)(图2)。
接着,进行肿瘤感兴趣区域的分割。为了得到更为准确的肿瘤参数信息,将层数较少的T1ce图像(20层)配准到层数较多的DCE-MRI图像(64层)上,在配准后的T1ce图上手工逐层勾勒感兴趣区域,并避开明显的坏死和水肿区域。
1.2.4 机器学习分类
(1)特征提取:基于Matlab软件平台,采用基于像素水平的直方图统计分析方法对肿瘤区域内的各参数信息进行统计,计算各参数的均值、中位数、众数、标准差、方差、标准误、峰度、偏度、最小值、最大值、上百分位数、下百分位数、四分位数、第5、10、90、95百分位数、上百分之五均值、下百分之五均值、能量、熵、峰值高度、峰值对应X轴坐标等23个统计指标,作为相应参数图的特征集合。(2)特征选择:这里采用SVM递归剔除特征(support vector machine recursive feature elimination,SVM-RFE)方法,基于Weka (版本号3.8.0)软件平台实现[14]。具体地,根据SVM训练时生成的权重构造特征排序系数,每次迭代去掉排序系数最小的一个特征,最后得到所有特征的递减排序结果,根据分类性能选择最优特征个数。(3)数据均衡化和归一化:本实验的LGG和HGG样本存在严重的不均衡,这会使得训练的SVM分类模型明显地偏向于大样本所属类别,模型的泛化能力很差,需要对数据进行均衡化。本实验采用合成少数类过采样技术(synthetic minority oversampling technique,SMOTE),对样本数少的一类(即LGG)进行扩增。归一化操作是将每一特征根据其所有样本的变化范围线性变换到“0、1”区间,进一步提高模型的训练速度和泛化能力。(4)SVM分类:SVM方法是基于统计学习理论的一种机器学习方法,能够在统计样本量少的情况下获得数据良好的统计规律。将上述各参数的特征数据集作为输入样本,使用SVM分类器进行学习、训练。采用10-fold交叉验证方法,对各分类模型的性能进行评估,主要统计以下评价指标:正确率(accuracy)和ROC曲线下面积(area under the curve,AUC)。
2 结果
2.1 使用所有特征数据集分类
首先,使用每一参数的原始特征数据集(未均衡化)及五种参数特征数据集合分别作为输入样本,进行SVM学习训练;然后,采用SMOTE技术对少类样本扩增(LGG:70,HGG:70)后,再进行SVM模型的训练。两组数据构建的分类模型其性能见表1。
可以看到,当使用原始未经过均衡化的特征数据集进行分类训练时,由于样本分布的不平衡性(LGG:28,HGG:70),各分类模型的accuracy虽然都大于0.7,但AUC非常低(接近0.5),说明建立起来的分类模型几乎没有任何意义,无法对胶质瘤进行准确分级。对数据进行SMOTE处理后,训练得到的各参数模型的AUC都有显著提升。除Vp参数的分类性能较差外,其他四种参数的分类性能都相对较高(accuracy和AUC都在0.75左右)。此外,当将五种参数的特征集合并在一起进行学习训练时,其分类模型的accuracy和AUC都明显增加(0.821)。这说明综合利用各参数的特征表达信息,可以构建更为准确的胶质瘤分级模型。

图1 本研究主要流程图Fig. 1 Flow chart of this study.
2.2 结合SVM-RFE分类
根据SVM-RFE特征递减排序结果,步长为1,依次选择前1,2,…,n个(特征总数)特征用于SVM分类训练,得到的分类模型accuracy随特征数目的变化情况分别如图3(a)~(f)所示。其中,横轴代表特征个数,纵轴代表accuracy,红色圆球表示使用最优特征组合分类accuracy,蓝色圆球代表使用所有特征的分类accuracy。比较发现,经SVMRFE特征选择后,除AUCAIF参数的分类性能没有变化外,其他参数(Ktrans、Kep、Ve、Vp)分类模型的accuracy都有显著提高(0.771、0.786、0.779、0.621)。使用五种参数特征组合训练得到的分类模型accuracy仍然是最高的,其accuracy也明显增加,即从0.821增加到0.864。此外,这些模型的AUC也同步增加(表2)。
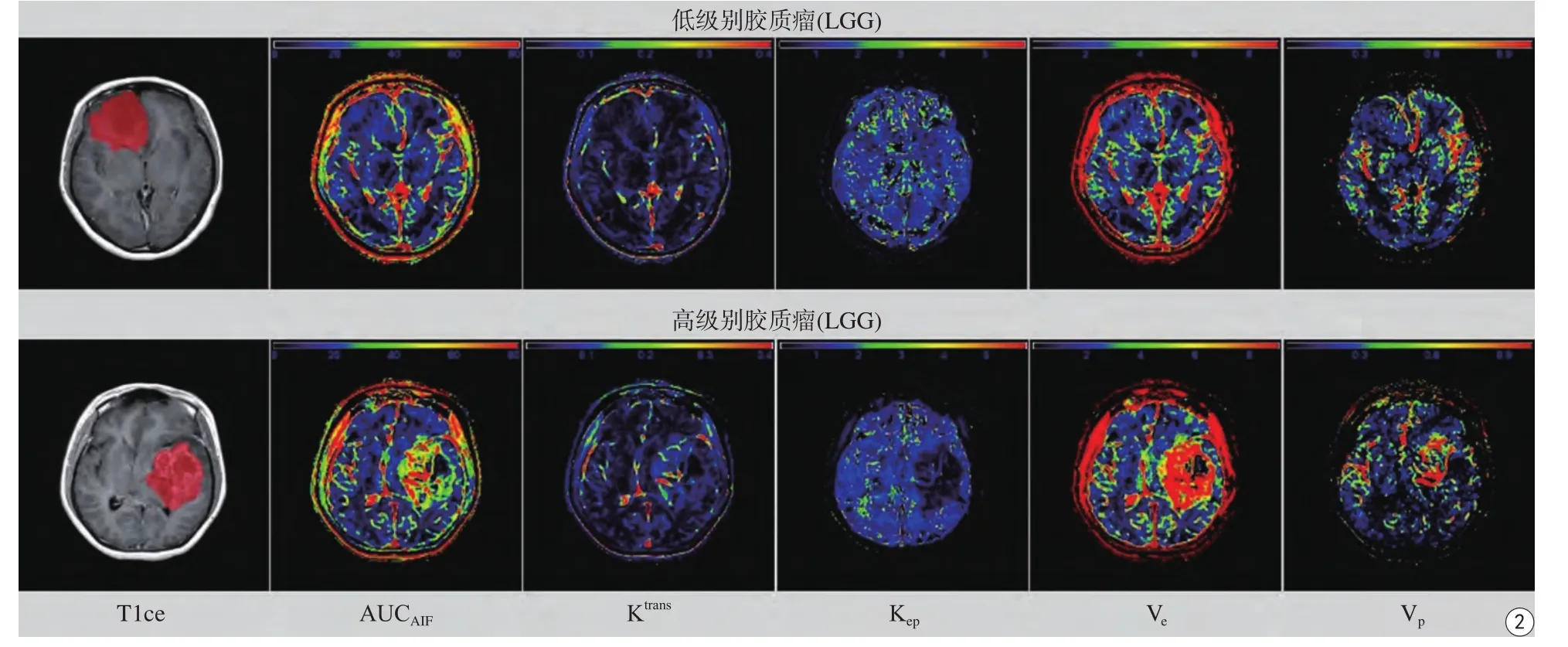
图2 1例27岁女性低级别胶质瘤患者(Ⅱ级)和1例64岁男性高级别胶质瘤患者(Ⅳ级)的定量参数示意图Fig. 2 The parameter maps from a 27-year-old female with low grade glioma (Grade Ⅱ) and a 64-year-old male with high grade glioma.

图3 经SVM-RFE特征递减排序后,使用不同数目的参数特征SVM分类的正确率。A~F依次为:AUCAIF参数特征、Ktrans参数特征、Kep参数特征、Ve参数特征、Vp参数特征、五种参数组合特征Fig. 3 The classification accuracy of SVM using different number of features after SVM-RFE feature decrement sorting. A—F represents: AUCAIF, Ktrans, Kep,Ve, Vp and the combination of these 5 parameters.

表1 使用各参数的原始特征与SMOTE特征数据集进行LGG与HGG分类性能Tab.1 Classification of LGG and HGG using original features and features applied SMOTE
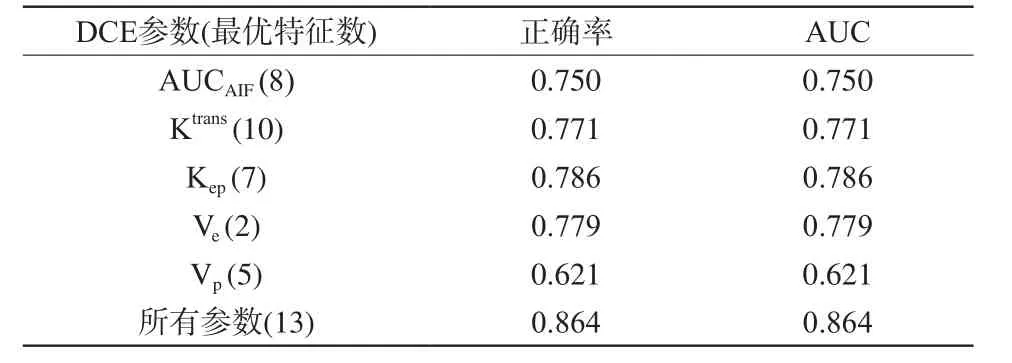
表2 经SVM-RFE特征选择后,LGG与HGG (70和70)分类模型性能Tab. 2 The performance of LGG and HGG classification model after SVM-RFE feature selection
与2.1中结果类似,使用五种参数特征组合构建的分类模型的性能最高,其正确率以及AUC值都达到0.864(表2),说明联合五种参数构建的胶质瘤分级模型效果更佳。该模型共使用13种参数特征,分别包括:Ktrans参数的下百分位数/四分位数/标准误、Kep参数的标准误、四分位数、最小值、峰值对应X轴坐标、Ve参数的偏度第95百分位数、Vp参数的标准误、峰值高度、标准差和AUCAIF参数的熵。
3 讨论
胶质瘤是颅内最常见的原发性恶性肿瘤,级别不同,治疗方式及预后差别很大。在组织学分级中,胶质瘤血管内皮增殖程度是诊断肿瘤恶性程度的标准,但是病理检查具有创伤性和采样误差,寻找一种无创的术前准确诊断肿瘤级别的方法尤为重要。
DCE-MRI技术能够定量测算肿瘤血管的渗透性参数,真实反映胶质瘤血管的血脑屏障破坏程度,进一步反映肿瘤的恶性程度以及生物学行为,在胶质瘤分级诊断中具有重要价值[4]。另一方面,采用先进的机器学习技术,能够自动挖掘数据内在的联系,训练高效、自动化的分类预测模型。因此,本研究提出了一种基于DCE-MRI定量参数的术前胶质瘤自动分级技术。实验结果表明:(1)除Vp参数外,使用AUCAIF、Ktrans、Kep、Ve等参数直方图特征构建的SVM分类模型,可以较好地对胶质瘤进行分级;(2)联合使用肿瘤的AUCAIF、Ktrans、Kep、Ve、Vp等参数信息,可以有效地提高分级模型的准确度;(3)联合肿瘤的多参数特征信息,结合SVM-RFE特征选择和SVM分类器,其分级模型的性能有显著的提升。
本研究尚有一定的局限性:(1)胶质瘤分级样本的不均衡。虽然本实验采用了SMOTE处理,并不能完全代表少类样本数据的真实分布,须引入更多真实LGG样本进行测试;(2)定量参数的计算采用的是Extended Tofts模型,后续将尝试其他模型进行综合比较,寻求适用于胶质瘤分级的最优计算模型;(3)对参数图像仅提取了直方图特征[15],考虑到肿瘤的异质性特点,后续引入图像的纹理分析[16]、小波分析等提取更多特征信息,寻求胶质瘤分级的最优特征组合。
总之,本研究利用DCE-MRI定量参数提供的肿瘤血管生成及破坏方面的特征信息,采用高效的机器学习技术,构建了一套较为准确的胶质瘤分级诊断技术,为临床准确判定胶质瘤术前级别提供了新思路。
