蓝细菌基因组拷贝数的研究进展与展望
2018-10-08王立娜王家林朱涛吕雪峰
王立娜,王家林,朱涛,吕雪峰
蓝细菌基因组拷贝数的研究进展与展望
王立娜1,2,王家林1,朱涛2,吕雪峰2
1 青岛科技大学 海洋科学与生物工程学院,山东 青岛 266042 2 中国科学院青岛生物能源与过程研究所 中国科学院生物燃料重点实验室,山东 青岛 266101

王立娜, 王家林, 朱涛, 等. 蓝细菌基因组拷贝数的研究进展与展望. 生物工程学报, 2018, 34 (9): 1386–1397.Wang LN, Wang JL, Zhu T, et al. Progress and perspectives on cyanobacterial ploidy. Chin J Biotech, 2018, 34 (9): 1386–1397.
蓝细菌是一类古老的光合原核微生物。就基因组拷贝数 (倍性) 而言,蓝细菌是原核生物中基因组低、中、高拷贝共存的典型类群之一,而基因组多拷贝特性是制约蓝细菌高效遗传改造的瓶颈。已有研究表明,蓝细菌的基因组拷贝数表现出生长周期的依赖性并受多种遗传、环境因子的影响。文中综述了蓝细菌基因组拷贝数的国内外最新研究进展、分析方法及影响因素,并讨论了蓝细菌基因组多拷贝研究的环境生态和生物技术意义。最后,对未来蓝细菌基因组拷贝数相关的研究方向作出展望。
蓝细菌,基因组拷贝数,理化因子,细胞工厂
生物基因组的拷贝数,在真核生物中称之为倍性 (Ploidy),指细胞核中所含有的染色体组 () 的套数。正常的配子细胞中所包含的染色体数称为一套单倍染色体 (单倍体,Haploid),用符号表示。具有两个染色体组的细胞或个体称为二倍体 (2,Diploid),具有两个以上整套染色体组的细胞或个体则称为多倍体 (Polyploid),包括三倍体 (3,Triploid)、四倍体 (4,Tetraploid) 等。
在自然界中,许多真核生物如纤毛虫、两栖动物、鱼类、开花植物等,都是多倍体生物[1]。受早期大肠杆菌 (,革兰氏阴性菌)[2]和枯草芽胞杆菌 (,革兰氏阳性菌)[3]等模式生物相关研究的影响,传统观点认为原核生物仅有一个基因组拷贝,其基因组单拷贝特征在文献中也称之为单倍性 (Monoploidy)[1]。但是,近年来对细菌最大的类群——变形菌门 (Proteobacteria) 的分析发现,涵盖其α-、β-、γ-、δ-、ε-变形杆菌纲的多数菌株并非只拥有单个拷贝的基因组[4]。大肠杆菌 (γ-变形杆菌纲) 在最优培养条件下快速生长时,其胞内也可含有多个复制起始位点。这里需要指出的是,原核生物的基因组多拷贝现象,在许多文献中也称之为“多倍性” (Polyploidy),但是此处的Polyploidy是与原核生物的寡倍性 (Oligoploidy,数个基因组拷贝)、单倍性 (Monoploidy,单个基因组拷贝) 相呼应的概念,与真核生物的多倍性所表达的生物学意义并不相同。通常中文表述中所指的原核生物的倍性即细胞所含有的基因组DNA的拷贝数。
原核生物界还有另外一个大的类群叫作蓝细菌 (Cyanobacteria),其细胞壁具有革兰氏阴性菌特征,由内外两层构成,外层为外膜,由外侧的脂多糖层和内侧的磷脂层构成,内层为肽聚糖,许多蓝细菌还可分泌胶状物质,在细胞群体或丝状体外形成胶被。蓝细菌的膜系统包括细胞膜和类囊体膜,细胞膜包裹细胞质,细胞质内有平行或卷曲方式分布的类囊体膜结构,是光合作用发生的场所。与其他原核生物类似,蓝细菌缺乏其他膜结构的细胞器,没有真正意义的细胞核、线粒体等[5-6]。蓝细菌既是研究光合作用、碳氮固定、叶绿体进化等基础科学问题的优良模式生物,又是合成新型生物燃料和化学品的重要底盘细胞[7-10]。多年来,原核生物基因组多拷贝现象未能引起足够的重视,而最近的研究表明蓝细菌是原核生物中基因组低、中、高拷贝共存的典型类群之一[1]。
基因组多拷贝现象可能涉及多个胞内过程,有其潜在优势,如全局调控基因表达、控制细胞体积、调节基因剂量、减少自发突变、辅助DNA修复等[1,11],并且有报道指出蓝细菌的基因组DNA表现出依赖于昼夜节律的时空分布特征[12-13]。
然而,就生物技术应用而言,基因组多拷贝则可能是制约蓝细菌高效遗传改造的潜在障碍[14]。目前已有研究发现蓝细菌的基因组拷贝数与细胞生长周期及多种理化因子相关[11]。从根本上认识蓝细菌的基因组拷贝数特征并发掘其可能的影响和控制因素,还面临着巨大的挑战。而以蓝细菌作为研究模式解析原核生物基因组多拷贝现象的形成机制仍具有较为广阔的研究空间。
本文对蓝细菌基因组拷贝数的相关研究进行简要综述,将有助于在全局水平上认识蓝细菌基因组的多拷贝现象,优化依赖标签基因频率对微生物群落结构的评价体系,加速推动以蓝细菌作为“细胞工厂”合成生物能源和高附加值化学品的进程。
1 蓝细菌基因组拷贝数的相关研究
1.1 蓝细菌是基因组低、中、高拷贝共存的代表性原核微生物之一
早在20世纪六、七十年代,Marvin Edelman、Rosmarie Rippka等学者就对巴斯德菌种保藏中心 (Pasteur Culture Collection,PCC) 的200多株蓝细菌的基因组大小进行系统研究[15-17]。近年来,随着高通量测序技术的快速发展,越来越多蓝细菌的基因组被测序分析,这使得对蓝细菌基因组大小的整体认识变得更为全面精确[10,18]。相对而言,关于蓝细菌基因组拷贝数的研究却比较匮乏。现对目前已报道的关于蓝细菌基因组拷贝的相关研究总结于表1。
其中聚球藻sp. WH 7805和sp. WH 8101为目前已鉴定的基因组单拷贝菌株,其余菌株的基因组均为多拷贝。细长聚球藻和sp. PCC 6301的基因组拷贝数在2−6之间,有报道称集胞藻sp. PCC 6803等菌株的基因组拷贝数可达几十甚至上百,而实验室纯培养的红海束毛藻IMS101平均每个细胞的基因组拷贝数最高可达600多个拷贝。因此,蓝细菌是基因组低、中、高拷贝共存的代表性的原核微生物类群之一。

表1 蓝细菌基因组拷贝数及相关分析参数[1]
aStationary phase;bLight-dark cycles;cExponential phase/linear phase/stationary phase;dLonger doubling times correspond to lower genome copy numbers;eCalculated from relative fluorescence and genome size of PCC 6301;fField-collected samples.
1.2 蓝细菌基因组拷贝数的研究方法
早期对蓝细菌基因组拷贝数的关注主要是为了认识其细胞分裂过程和特性,而后随着分子生物学的兴起,科学家开始发掘和改造模式蓝细菌,并藉此探索光合作用、碳氮代谢和细胞分化等基础科学问题。而基因组多拷贝时常导致一些基因不能被完全敲除,因此为深入认识蓝细菌的基因组拷贝数特性,各种分析方法应运而生。近年来,代谢工程和合成生物学技术飞速发展,发展蓝细菌光合“细胞工厂”,合成生物能源和高附加值化合物,精确分析其基因组复制过程和基因组拷贝数特性,则是整体提高其遗传改造效率的必然选择。蓝细菌基因组拷贝数的研究方法分述如下并总结于表2。
1.2.1 分光光度法 (Spectrophotometry)
分光光度法是较为简单易行的分析原核生物基因组拷贝数的方法。该方法的基本原理是提取一定数量细胞的基因组DNA,利用分光光度法 (260 nm波长处的吸收峰) 对其定量 (m),并计算其相对分子质量 (M),结合细胞计数,可推算单位细胞的基因组拷贝数 (N=NA*m/M,N为菌株基因组拷贝数,NA为阿伏伽德罗常数)[1,4]。分光光度法的优点是对设备要求低,数据分析简单,缺点是因涉及DNA提取,因此分析通量低,要求基因组纯度高、提取损失率小,且要排除RNA和内源质粒对测试结果的影响。
德国法兰克福大学Jörg Soppa教授实验室曾以分光光度法证实细长聚球藻PCC 7942和聚球藻WH 7803的基因组拷贝数与早期用其他方法所得结果一致,但集胞藻PCC 6803的基因组拷贝数可高达218,与前人的报道相差较大[1]。后来该实验室系统分析了集胞藻PCC 6803的6株亚株的基因组拷贝数,分光光度法所得结果与前述其实验室报道结果仍有较大差异[11]。
1.2.2 流式细胞仪分析法 (Flow cytometry)
流式细胞仪分析法可以与DNA荧光染色结合,对单细胞进行高通量、多参数的定性定量分析。该方法首先需要确定一个合适的对照菌株 (如经抑制剂处理后细胞处于基因组单拷贝状态的大肠杆菌),经过荧光补偿后,根据前向散射 (FSC)、侧向散射 (SSC) 等参数,得到基因组单拷贝大肠杆菌的荧光强度值。再将目的菌株的基因组DNA染色、进样分析,根据目的菌株荧光强度值与大肠杆菌单拷贝荧光强度值对比,计算获得目的菌株基因组拷贝数[30]。
目前关于蓝细菌基因组拷贝数的研究结果多数来自流式细胞分析法。20世纪90年代,麻省理工学院Sallie W. Chisholm教授实验室在研究聚球藻PCC 6301胞内基因组DNA复制循环与细胞生长速率关系时,就以此方法证实该菌株的基因组拷贝数为2−6[25]。此后,该实验室还以流式细胞法系统分析了4株海洋菌株的基因组拷贝数,发现聚球藻WH 8101和聚球藻WH 7805为单拷贝,聚球藻WH 8103为1−2拷贝,聚球藻WH 7803为2−4拷贝[26]。日本东京农业大学Hirofumi Yoshikawa教授实验室建立了基于流式细胞分析的精确的蓝细菌基因组DNA拷贝数的分析方法,并比较了细长聚球藻 PCC 7942光照和黑暗条件下流式细胞仪分析信号的显著差别和基因组拷贝数的差异[30]。
1.2.3 荧光定量PCR法 (qPCR)
qPCR技术分析菌株基因组拷贝数的流程是:提取待分析菌株的完整基因组DNA,并选取1 kb左右的标准片段进行普通PCR扩增。以已知浓度的PCR产物作为模板进行一系列浓度梯度稀释后,进行qPCR反应,并据其产物浓度和扩增特性制作标准曲线。同时,以待分析菌株基因组DNA作为模板进行浓度梯度稀释,再进行qPCR反应以扩增其内部300 bp左右的内参序列,所得t值代入标准曲线,结合菌株细胞数目即可获得该菌株的平均基因组拷贝数[1,4]。
qPCR技术是较为灵敏的测定蓝细菌基因组拷贝数的技术,为保证测定结果的准确性,该方法对目标菌株基因组DNA的要求较高,需要提取方法损失小、DNA完整无断裂且纯度较高。如前述分光光度法,Jörg Soppa实验室还以qPCR分析了各个菌株的基因组拷贝数,其实验数据表明qPCR法和分光光度法所得数据近似[1,11]。此外,Sargent等以单拷贝固氮基因作为标准片段,以qPCR法作为分析方法,发现实验室纯培养红海束毛藻的基因组拷贝数远高于海洋环境样品中同属的其他菌株[29]。
1.2.4 荧光蛋白分子显示系统 (Fluorescent reporter-operator system, FROS)
荧光蛋白标记结合显微成像技术是近年来发展起来的可以实时追踪分析微生物基因组复制、分配动态和基因组拷贝数的方法。该方法的基本原理是基于顺式作用元件和反式作用因子的结合,在目标物种基因组上插入、等的上百个串联重复 (中间以10 bp左右的随机序列隔开以减少同源重组),并在目标物种胞内表达荧光蛋白标记 (GFP、YFP等) 的LacI、TetR,在加入诱导剂的情况下,可标记目标物种的单个基因组的特定位置,并可实时分析其动态变化[31]。
荧光蛋白分子显示系统 (如LacO240/LacI- fluorescent protein tag、TetO240/TetR-fluorescent protein tag等) 用于分析基因组拷贝数具有极高的准确性,可同时标记基因组的复制起始位点和终止位点,因此还用于分析基因组DNA分子内和分子间的动态变化特征[32-33]。该方法的缺点是在基因组上引入了数百个串联重复序列,可能会扰乱DNA复制和细胞分裂,降低菌株的遗传稳定性,因此仅用于分析模式菌株[32-34]。
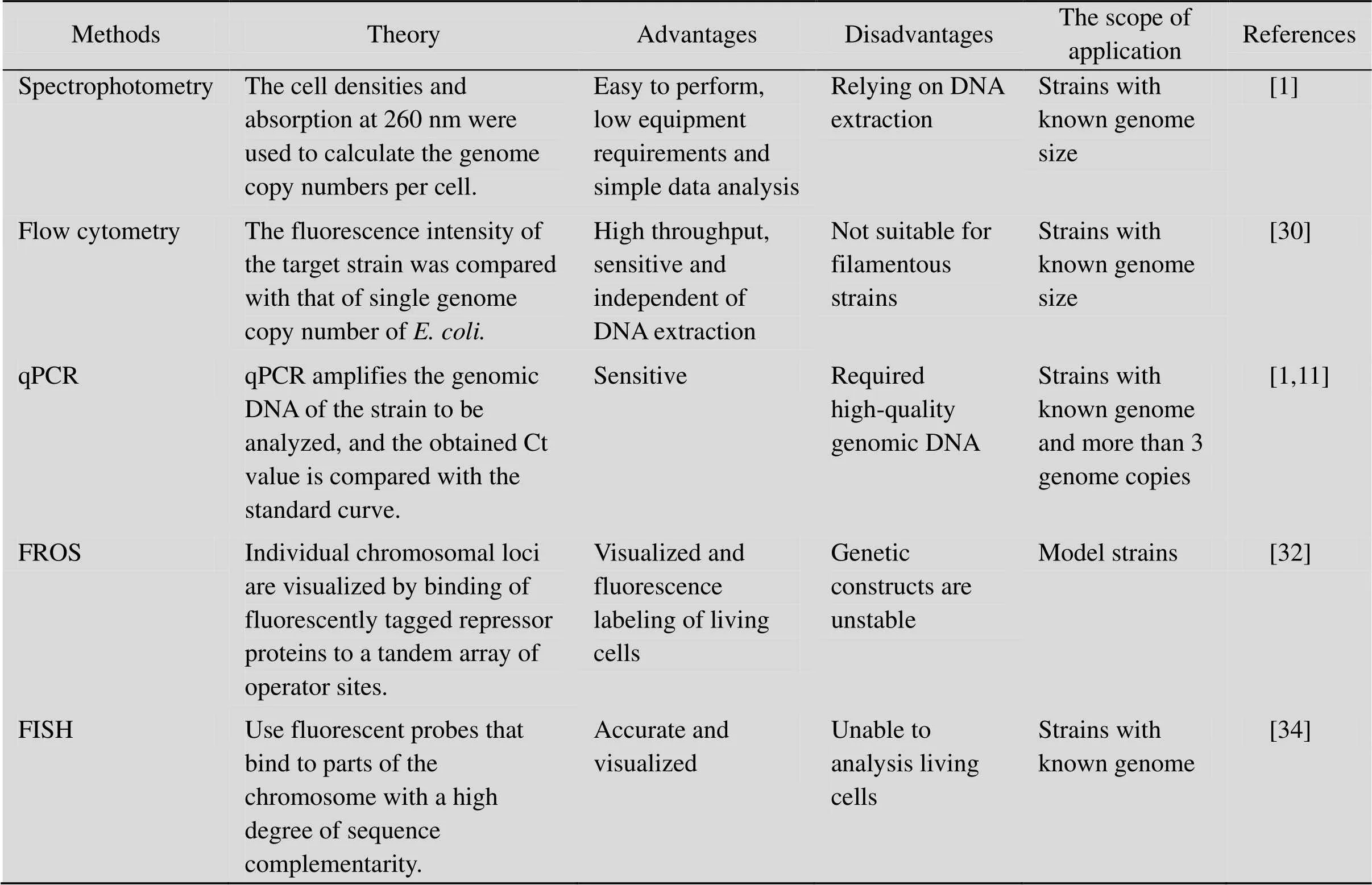
表2 蓝细菌基因组拷贝数的研究方法
霍华德休斯医学研究所的Erin K. O’Shea教授实验室[32]和哈佛大学的Pamela A. Silver教授实验室[33]曾分别采用荧光蛋白分子显示系统分析了细长聚球藻PCC 7942的基因组拷贝数及其复制和分配特性,发现该菌株可含有4−6个基因组拷贝,其基因组复制不依赖于细胞分裂,具有非同步复制、严谨型分配的特点。
1.2.5 荧光原位杂交法 (Fluorescenthybridization, FISH)
荧光原位杂交法的原理是:将荧光素标记探针与待检测菌株基因组DNA上特定片段杂交,经变性-退火-复性,即可形成靶DNA与核酸探针的杂交体。再利用荧光素与特异亲和素之间的免疫化学反应,可借助荧光检测体系在荧光显微镜下对目标物种基因组DNA进行定性、定量、定位分析。
FISH技术分析蓝细菌基因组拷贝数的优点是灵敏度高、不涉及复杂的遗传操作,可与流式细胞法相结合。与FROS技术相比,其缺点是涉及固定过程,不能进行活体标记。
最近,Hirofumi Yoshikawa 实验室以FISH技术标记了细长聚球藻PCC 7942的基因组,较全面地分析了影响其遗传分配的相关基因[34]。
综上所述,因蓝细菌种类丰富,是基因组低、中、高拷贝共存的典型类群,甚至同一株系的不同亚株间基因组拷贝数都有较大差异。因此,对于基因组拷贝数的分析,需要上述多种方法的结合,且要借助目标菌株的其他生理生化指标,才可获得特定菌株基因组拷贝数的概貌。而对蓝细菌基因组拷贝数的准确认识,也是分析其影响因素和调控机制的必要前提。
2 蓝细菌基因组拷贝数的影响因素
蓝细菌作为一类古老的光合原核微生物,在进化过程中形成了低、中、高拷贝类群共存的格局,反映出其极强的环境适应能力。原核生物的基因组多拷贝现象被认为在真核生物有丝分裂、减数分裂以及真核生物性的起源中发挥了重要作用[35]。现在已经证明真核生物的细胞分裂由细胞周期关键调控因子所控制,与此不同,蓝细菌细胞分裂中尚未发现类似的主控因子,因此,蓝细菌的细胞分裂和遗传物质分配可能是一个多维度的复杂事件。
已有研究表明蓝细菌的基因组复制与细胞分裂是非同步的,高拷贝菌株集胞藻PCC 6803的基因组DNA的遗传分配是非严谨型调控的,新生细胞和母代细胞所获基因组的拷贝数具有一定的随机性[36]。而细长聚球藻PCC 7942的基因组DNA沿其长轴与羧酶体间隔排列的特征,则被认为是完成其遗传物质严谨型分配的重要保障。蓝细菌基因组拷贝数伴随细胞生长发生较大变化,并且受多种环境因子和遗传因子的影响,下面将分别介绍。
2.1 蓝细菌的基因组拷贝数表现出生长周期 (Growth phase) 的依赖性
德国法兰克福大学Jörg Soppa实验室的实验结果显示集胞藻PCC 6803的基因组拷贝数是高度可变的,表现出生长周期的依赖性,在接种初期 (750≈0.1) 其平均拷贝数均值约为20,随着细胞生长其基因组拷贝数明显降低,在平台期 (750≈2.5) 均值约为4,前后相差4倍[11]。
细长聚球藻PCC 7942的基因组拷贝数也具有生长周期依赖的特点,Hirofumi Yoshikawa实验室证实在生长停滞期 (Lag phase) 其基因组DNA复制旺盛,基因组拷贝数高于指数生长期和线性期[30]。蓝细菌的整个生长周期涉及多种理化因子的参与,因此,蓝细菌基因组拷贝数在不同生长阶段表现出的巨大差别可能与此类理化因子相关。
2.2 影响蓝细菌基因组拷贝数的相关环境因子
2.2.1 光照强度
光照是蓝细菌生长的必需条件,已有研究表明蓝细菌的基因组DNA复制也是光依赖的。Hirofumi Yoshikawa教授实验室以细长聚球藻PCC 7942作为研究模式,深入解析了蓝细菌基因组DNA复制的光依赖性。通过在野生型细长聚球藻PCC 7942中引入单纯疱疹病毒来源的胸苷激酶 (Thymidine kinase, TK),构建了外加BrdU (5-bromo-2′-deoxyuridine) 条件下可示踪DNA从头合成的PCC 7942TK菌株。
进一步研究发现在黑暗条件下,DNA复制被阻断,而在光照条件下,DNA复制重新开始。基因组DNA复制能否正常起始,与胞内基因组的拷贝数息息相关。该实验室通过流式细胞分析证实细长聚球藻PCC 7942黑暗条件下的基因组拷贝数远小于光照[30]。
但是,Jörg Soppa教授团队对集胞藻PCC 6803的研究结果显示,相对于对照条件 (80 µmol photon/(m2·s)),30 µmol photon/(m2·s)低光照强度下其拷贝数提高了接近2倍[11]。有证据显示,光照会影响基因组DNA的胞内空间排布,在黑暗状态下,细长聚球藻PCC 7942的基因组DNA弥散于细胞质中,在光暗循环或者持续光照条件下,其基因组DNA空间上呈现膨胀/压缩交替的节律性变化[12-13]。光照引起的基因组DNA空间布局的节律性变化很可能是为即将进行的细胞分裂及基因组各拷贝的遗传分配做准备。
此外,Yasuko Kaneko教授实验室还通过高压低温电子层析成像技术捕捉到了细长聚球藻PCC 7942处于高度压缩状态下的基因组DNA[37]。DNA复制的光依赖性可能跟光合电子传递有关。线性电子传递可阻断DNA复制的起始和进程,而围绕光系统I的环式电子传递可推动已起始复制的DNA完成复制过程[38]。光照强度对蓝细菌基因组拷贝数的影响机制目前还不明确,有待深入解析。
2.2.2 磷元素
磷元素是DNA的重要组成部分,多个拷贝的基因组DNA的合成需要大量磷元素的参与。对集胞藻PCC 6803的研究结果显示,相对于标准培养条件 (0.13 mmol/L磷酸盐),高磷培养条件 (1.3 mmol/L磷酸盐) 下,其平均基因组拷贝数可由27变成35,提高近1/3。而在缺磷培养基中,集胞藻PCC 6803的基因组拷贝数迅速降低,其生长也受到一定程度的抑制,在培养6 d之后培养液光密度维持恒定,不再增加,但是其基因组拷贝数继续降低,最终甚至可变成单拷贝[11]。Jörg Soppa实验室的实验数据表明,缺磷在导致集胞藻PCC 6803基因组拷贝数仅下降5倍的同时,其细胞数目增加了近20倍。
因此,缺磷条件下细胞短期内的生长能力与基因组拷贝数的降低幅度的差距,暗示缺磷培养前期,依然有基因组DNA从头合成的进行。而这一过程中磷元素的来源可能涉及胞内的其他含磷组分,如多聚磷酸、RNA、ATP、NADP、磷脂等[11]。
Hirofumi Yoshikawa实验室通过分析细长聚球藻PCC 7942培养液的元素消耗,证实磷元素在接种96 h后即被细胞吸收完毕,是消耗最快的大量元素。而这一时期胞内基因组拷贝数快速增加[30];此外,他们还分析了磷元素吸收相关的双元信号转导组分 (和) 的转录情况,证实该系统在培养液磷元素含量较高的生长延滞期不表达,而在胞外磷浓度降低85%后大量表达[30]。因此,磷元素也是影响细长聚球藻PCC 7942基因组拷贝数的重要因素。
2.2.3 DNA自身作为磷、碳、氮等的贮藏物
已有研究结果表明,基因组高拷贝古菌 (如沃氏富盐菌) 的DNA除了充当遗传信息的载体外,富余的基因组DNA还可作为胞内磷的贮藏体,在体内磷元素匮乏时该古菌可降解其基因组DNA,从而维系细胞生长。
Jörg Soppa实验室在集胞藻PCC 6803的研究发现,外源添加鲱鱼精DNA可恢复缺磷引起的生长抑制,暗示外源DNA添加可逆转缺磷引起的基因组拷贝数的降低。另一有趣的现象是该实验室发现添加外源DNA还可恢复缺碳但不能恢复缺氮对集胞藻PCC 6803生长的抑制[11]。
如前所述,海洋固氮蓝细菌红海束毛藻的基因组拷贝数可达数百个,其基因组大小约为7.75 Mb,显著特点是40%左右的序列并不行使蛋白编码功能,且10%左右的编码基因为重复基因。Sargent等对红海束毛藻的研究同样认为基因组DNA作为贮藏物可调节物种基因组拷贝数,提高物种的生态竞争能力[29]。无论自身DNA还是外源添加DNA对某一物种基因组拷贝数的影响,可能涉及DNA吸收、降解、碳氮代谢等一系列复杂的过程。在许多野外环境中,DNA结合态磷的浓度要远高于游离无机磷酸的浓度,也从侧面说明了DNA作为磷贮藏体的可能性[11]。
2.3 影响蓝细菌基因组拷贝数的相关遗传因子
在大肠杆菌.、枯草芽胞杆菌、新月丙杆菌和天蓝色链霉菌等模式生物中,已经鉴定了维系类核结构、基因组DNA遗传分配、细胞分裂Z环形成等相关的多个关键基因,此类基因与他们新生细胞的基因组拷贝数密切相关[39]。近年来,对蓝细菌相关基因和作用机制的认识也取得了一定进展。可能影响蓝细菌基因组DNA遗传分配和拷贝数的相关遗传因子总结于表3,分述如下。
2.3.1 ParA对蓝细菌基因组DNA遗传分配的影响
ParA/MinD是微生物调节胞内组分 (如质粒、类核、细胞分裂相关因子等) 空间排布的一类ATP酶[32,34]。细长聚球藻PCC 7942中羧酶体和类核有沿长轴交替线性排列的特点,而ParA被证实影响羧酶体的空间排布,因此,ParA参与了细长聚球藻PCC 7942的胞内区间化调节[40]。
依赖FROS报告系统,Erin K. O’Shea实验室曾认为敲除不影响基因组DNA的空间排布[33]。而最近Hirofumi Yoshikawa实验室对进行了敲除、互补、过量表达等一系列遗传学实验,以荧光原位杂交技术 (FISH) 证实参与了细长聚球藻PCC 7942基因组DNA的遗传分配[34]。并通过酵母双杂交实验,鉴定了与ParA互作的多个蛋白,其中3个蛋白 (Synpcc7942_2009, Synpcc 7942_2653和Synpcc7942_2045) 属于SMC (Structural maintenance of chromosomes) 家族[34]。这些蛋白可能涉及基因组DNA的膨胀/压缩特性,ParA对细长聚球藻PCC 7942基因组DNA遗传分配的作用机制可能与其相关。
2.3.2 MreB对蓝细菌基因组DNA遗传分配的影响
MreB是肌动蛋白类似物,在细菌的细胞形态和基因组DNA遗传分配中发挥重要作用。赵进东教授实验室发现鱼腥藻sp. PCC 7120的可被完全敲除,且仅影响细胞形态并不影响其基因组DNA的遗传分配,鱼腥藻PCC 7120的基因组DNA的遗传分配方式可能是非严谨型调控的[22]。而细长聚球藻PCC 7942中仅能部分敲除,其突变株表现出基因组DNA的聚集现象,说明MreB影响了该菌株基因组DNA的遗传分配[32,34]。
大肠杆菌和霍乱弧菌的敲除会导致“无核”细胞的产生,但是细长聚球藻PCC 7942中无此现象。因此,MreB对细长聚球藻PCC 7942基因组DNA遗传分配的影响也可能是其影响细胞壁合成带来的次级效应。
蓝细菌基因组DNA的复制、组织和分配是个复杂的过程,对维系其基因组拷贝数至关重要。目前仅发现了少数影响蓝细菌基因组遗传分配的基因,且其作用机制还不清晰。但是当前研究进展证实,至少部分蓝细菌基因组DNA的分配是受特定遗传因子控制的,这为未来深入解析研究蓝细菌的基因组拷贝数特征奠定了基础。

表3 模式细菌中细胞分裂相关蛋白的分布
aBased on sequence alignment, no functional validation has been performed;bIt may involve mycelial growth rather than cell division.
3 蓝细菌基因组拷贝数相关研究的环境生态学和生物技术意义
3.1 环境生态学意义
以标签基因 (如16S rRNA基因、基因、基因、基因等) 结合高通量测序分析环境样品的微生物组成、结构和多样性克服了早期基于形态和培养方法的局限,推动了分子生态学的快速发展。当然,标签基因频率对微生物群落结构的映射也存在诸多的影响因素,如环境样品DNA提取效率、PCR扩增效率、标签基因多拷贝异质性、数据分析方法等,针对上述潜在影响因素业已发展出多种应对措施,在此不作赘述。
本文需要指出的是,环境样品中特定物种的基因组多拷贝现象也是影响微生物群落结构分析的重要因素。如Soppa教授所述,当同一群落中基因组单拷贝和多拷贝的物种共存时,以标签基因频率为评价指标的物种多样性分析,会大大高估基因组多拷贝物种的丰度[46]。因此,在水华、赤潮等蓝细菌相关的环境生态学研究中,菌株基因组拷贝数是一个不容忽视的问题,虽然当前还不能依赖传统技术对环境样品中各物种基因组拷贝数作出准确评价,伴随对特定生境中特色物种基因组拷贝数的深入认识,结合生物信息学手段直接预测环境样本中不同物种的基因组拷贝数在不久的未来将会实现。
3.2 生物技术意义
开发蓝细菌细胞工厂,发掘其光合固碳效率和生物合成潜力,需要从本质上认识蓝细菌的生命过程。在细胞结构层面,蓝细菌虽是原核生物,却有着高度协调的胞内时空组织性[12,32-33,37,45]。而要获得性状稳定的基因工程菌株,直接改造其基因组DNA是最佳选择。具有天然遗传转化系统是蓝细菌作为光合细胞工厂的优势,但是伴随漫长进化过程所获得的基因组多拷贝特性,却是高效遗传改造蓝细菌的障碍。较为矛盾的是,一旦目标合成途径被稳定整合到各基因组拷贝上,为提高目标产物的产量,其合成途径的高效表达时常又依赖于基因组DNA剂量的增加。
因此,理想的遗传改造过程是,在外源途径引入时尽可能降低宿主细胞的基因组拷贝数以提高同源重组和整合效率,在规模化培养基因工程菌株、表达外源途径时尽可能提高基因组拷贝数以提高目标产物产量。而这一过程的实现,最首要的是鉴定能够控制基因组拷贝数的遗传和环境因子,并在基因组拷贝数可控条件下发掘提高同源重组效率的方法。如前所述,目前已经发现多个遗传和环境因素影响蓝细菌的基因组拷贝数[11,34],暗示前述基于基因组拷贝数遗传改造和扩大培养蓝细菌的可行性。因此,认识蓝细菌这一类微生物基因组拷贝数的基本特征、解析其基因组的复制和遗传分配机制、协调其胞内大分子聚合物的时空格局,在蓝细菌生物技术利用方面具有重要意义。
4 展望
原核生物基因组多拷贝现象近年来被广泛关注,进化模型分析表明,基因组多拷贝可赋予原核生物短期的进化优势,但是对长期进化而言,基因组多拷贝容易积累隐性有害突变和致死突变。因此,对基因组多拷贝蓝细菌而言,必然有其适应策略以减少多拷贝的遗传成本同时保留其优势。蓝细菌家族的低、中、高拷贝特性,使其在基础研究和生物技术应用领域均具有无可比拟的优势。围绕蓝细菌基因组拷贝数特征,未来研究的主体内容可能集中在以下几个方面:1) 基于生态学和生物信息学的蓝细菌基因组拷贝数的分析和预测;2) 蓝细菌多拷贝基因组的复制、分配特性,及基因组DNA的时空分布格局;3) 蓝细菌基因组拷贝数的调节和控制机制;4) 基于蓝细菌拷贝数调控的遗传改造和生物合成。
建立稳定可靠的蓝细菌基因组拷贝数的评价和预测方法,获得此类微生物基因组拷贝数的概貌,将从本质上加深对这一光合体系的认识,可为蓝细菌在分子遗传、分子生态和基因工程方面的研究提供理论基础,必将推动绿色微型“细胞工厂”从“温室”走向“自然”的进程。
[1] Griese M, Lange C, Soppa J. Ploidy in cyanobacteria. FEMS Microbiol Lett, 2011, 323(2): 124–131.
[2] Skarstad K, Steen HB, Boye E. Cell cycle parameters of slowly growingB/r studied by flow cytometry. J Bacteriol, 1983, 154(2): 656–662.
[3] Webb CD, Graumann PL, Kahana JA, et al. Use of time-lapse microscopy to visualize rapid movement of the replication origin region of the chromosome during the cell cycle in. Mol Microbiol, 1998, 28(5): 883–892.
[4] Pecoraro V, Zerulla K, Lange C, et al. Quantification of ploidy in proteobacteria revealed the existence of monoploid, (mero-) oligoploid and polyploid species. PLoS ONE, 2011, 6(1): e16392.
[5] Stanier RY, Cohen-Bazire G. Phototrophic prokaryotes: the cyanobacteria. Annu Rev Microbiol, 1977, 31: 225–274.
[6] Smith AJ, London J, Stanier RY. Biochemical basis of obligate autotrophy in Blue-Green algae and thiobacilli. J Bacteriol, 1967, 94(4): 972–983.
[7] Lu XF. A perspective: photosynthetic production of fatty acid-based biofuels in genetically engineered cyanobacteria. Biotechnol Adv, 2010, 28(6): 742–746.
[8] Wang B, Wang JX, Zhang WW, et al. Application of synthetic biology in cyanobacteria and algae. Front Microbiol, 2012, 3: 344.
[9] Lindblad P, Lindberg P, Oliveira P, et al. Design, engineering, and construction of photosynthetic microbial cell factories for renewable solar fuel production. AMBIO, 2012, 41(S2): 163–168.
[10] Hagemann M, Hess WR. Systems and synthetic biology for the biotechnological application of cyanobacteria. Curr Opin Biotechnol, 2018, 49: 94–99.
[11] Zerulla K, Ludt K, Soppa J. The ploidy level ofsp. PCC 6803 is highly variable and is influenced by growth phase and by chemical and physical external parameters. Microbiology, 2016, 162(5): 730–739.
[12] Smith RM, Williams SB. Circadian rhythms in gene transcription imparted by chromosome compaction in the cyanobacterium. Proc Natl Acad Sci USA, 2006, 103(22): 8564–8569.
[13] Vijayan V, Zuzow R, O’shea EK. Oscillations in supercoiling drive circadian gene expression in cyanobacteria. Proc Natl Acad Sci USA, 2009, 106(52): 22564–22568.
[14] Berla BM, Saha R, Immethun CM, et al. Synthetic biology of cyanobacteria: unique challenges and opportunities. Front Microbiol, 2013, 4: 246.
[15] Herdman M, Janvier M, Rippka R, et al. Genome size of cyanobacteria. J Gen Microbiol, 1979, 111: 73–85.
[16] Rippka R, Deruelles J, Waterbury JB, et al. Generic assignments, strain histories and properties of pure cultures of cyanobacteria. Microbiology, 1979, 111: 1–61.
[17] Edelman M, Swinton D, Schiff JA, et al. Deoxyribonucleic acid of the blue-green algae (). Bacteriol Rev, 1967, 31(4): 315–331.
[18] Shih PM, Wu DY, Latifi A, et al. Improving the coverage of the cyanobacterial phylum using diversity-driven genome sequencing. Proc Natl Acad Sci USA, 2013, 110(3): 1053–1058.
[19] Simon RD. Macromolecular composition of spores from the filamentous cyanobacterium. J Bacteriol, 1977, 129(2): 1154–1155.
[20] Simon RD. DNA content of heterocysts and spores of the filamentous cyanobacterium. FEMS Microbiol Lett, 1980, 8(4): 241–245.
[21] Kurmayer R, Kutzenberger T. Application of real-time PCR for quantification of microcystin genotypes in a population of the toxic cyanobacteriumsp. Appl Environ Microbiol, 2003, 69(11): 6723–6730.
[22] Hu B, Yang GH, Zhao WX, et al. MreB is important for cell shape but not for chromosome segregation of the filamentous cyanobacteriumsp. PCC 7120. Mol Microbiol, 2007, 63(6): 1640–1652.
[23] Vaulot D, Marie D, Olson RJ, et al. Growth of, a photosynthetic prokaryote, in the equatorial pacific ocean. Science, 1995, 268(5216): 1480–1482.
[24] Mori T, Binder B, Johnson CH. Circadian gating of cell division in cyanobacteria growing with average doubling times of less than 24 hours. Proc Natl Acad Sci USA, 1996, 93(19): 10183–10188.
[25] Binder BJ, Chisholm SW. Relationship between DNA cycle and growth rate insp. strain PCC 6301. J Bacteriol, 1990, 172(5): 2313–2319.
[26] Binder BJ, Chisholm SW. Cell cycle regulation in marinesp. strains. Appl Environ Microbiol, 1995, 61(2): 708–717.
[27] Armbrust EV, Bowen JD, Olson RJ, et al. Effect of light on the cell cycle of a marinestrain. Appl Environ Microbiol, 1989, 55(2): 425–432.
[28] Labarre J, Chauvat F, Thuriaux P. Insertional mutagenesis by random cloning of antibiotic resistance genes into the genome of the cyanobacteriumstrain PCC 6803. J Bacteriol, 1989, 171(6): 3449–3457.
[29] Sargent EC, Hitchcock A, Johansson SA, et al. Evidence for polyploidy in the globally important diazotroph. FEMS Microbiol Lett, 2016, 363(21): fnw244.
[30] Watanabe S, Ohbayashi R, Kanesaki Y, et al. Intensive DNA replication and metabolism during the lag phase in cyanobacteria. PLoS ONE, 2015, 10(9): e0136800.
[31] Lau IF, Filipe SR, Søballe B, et al. Spatial and temporal organization of replicatingchromosomes. Mol Microbiol, 2003, 49(3): 731–743.
[32] Jain IH, Vijayan V, O’shea EK. Spatial ordering of chromosomes enhances the fidelity of chromosome partitioning in cyanobacteria. Proc Natl Acad Sci USA, 2012, 109(34): 13638–13643.
[33] Chen AH, Afonso B, Silver PA, et al. Spatial and temporal organization of chromosome duplication and segregation in the cyanobacteriumPCC 7942. PLoS ONE, 2012, 7(10): e47837.
[34] Watanabe S, Noda A, Ohbayashi R, et al. ParA-like protein influences the distribution of multi-copy chromosomes in cyanobacteriumPCC 7942. Microbiology, 2018, 164(1): 45–56.
[35] Markov AV, Kaznacheev IS. Evolutionary consequences of polyploidy in prokaryotes and the origin of mitosis and meiosis. Biol Direct, 2016, 11: 28.
[36] Schneider D, Fuhrmann E, Scholz I, et al. Fluorescence staining of live cyanobacterial cells suggest non-stringent chromosome segregation and absence of a connection between cytoplasmic and thylakoid membranes. BMC Cell Biol, 2007, 8: 39.
[37] Murata K, Hagiwara S, Kimori Y, et al. Ultrastructure of compacted DNA in cyanobacteria by high-voltage cryo-electron tomography. Sci Rep, 2016, 6: 34934.
[38] Ohbayashi R, Watanabe S, Kanesaki Y, et al. DNA replication depends on photosynthetic electron transport in cyanobacteria. FEMS Microbiol Lett, 2013, 344(2): 138–144.
[39] Angert ER. Alternatives to binary fission in bacteria. Nat Rev Microbiol, 2005, 3(3): 214–224.
[40] Savage DF, Afonso B, Chen AH, et al. Spatially ordered dynamics of the bacterial carbon fixation machinery. Science, 2010, 327(5970): 1258–1261.
[41] Donachie WD. Co-ordinate regulation of thecell cycle or the cloud of unknowing. Mol Microbiol, 2001, 40(4): 779–785.
[42] Wu LJ, Errington J. Coordination of cell division and chromosome segregation by a nucleoid occlusion protein in. Cell, 2004, 117(7): 915–925.
[43] Skerker JM, Laub MT. Cell-cycle progression and the generation of asymmetry in. Nat Rev Microbiol, 2004, 2(4): 325–337.
[44] Bentley SD, Chater KF, Cerdeño-Tárraga AM, et al. Complete genome sequence of the model actinomyceteA3 (2). Nature, 2002, 417(6885): 141–147.
[45] Gehring AM, Nodwell JR, Beverley SM, et al. Genomewide insertional mutagenesis inreveals additional genes involved in morphological differentiation. Proc Natl Acad Sci USA, 2000, 97(17): 9642–9647.
[46] Soppa J. Polyploidy and community structure. Nat Microbiol, 2017, 2: 16261.
(本文责编 陈宏宇)
Progress and perspectives on cyanobacterial ploidy
Lina Wang1,2, Jialin Wang1, Tao Zhu2, and Xuefeng Lü2
1 College of Marine Science and Biological Engineering, Qingdao University of Science and Technology, Qingdao 266042, Shandong, China 2 Key Laboratory of Biofuels, Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, Shandong, China
Cyanobacteria are a phylum of bacteria which are believed to be the oldest photosynthetic prokaryotic microorganisms on earth. The phylogenetic group of cyanobacteria was thought to be one of the prokaryotes that contain monoploid, oligoploid and polyploid species, and one obstacle to engineering cyanobacteria is their polyploidy genome. In recent years, the ploidy level of cyanobacteria was found to be influenced by growth phase and by multiple genetic and environmental factors. In the present article, we reviewed the progress, analytical methods and influencing factors on the cyanobacterial ploidy, and discussed the significance of cyanobacterial polyploidy regarding to environmental ecology and biotechnology. Based on this observation, the future research directions in this field are prospected.
cyanobacteria, ploidy, physical and chemical factors, cell factory
December 24, 2017;
February 13, 2018
National Natural Science Foundation of China (No. 31570068), Shandong Provincial Key Laboratory of Energy Genetics (No. SDKLEG201804).
s: Tao Zhu. Tel: +86-532-80662711; E-mail: zhutao@qibebt.ac.cn
国家自然科学基金(No. 31570068),山东省能源生物遗传资源重点实验室开放基金(No. SDKLEG201804) 资助。
2018-03-06
10.13345/j.cjb.170513
http://kns.cnki.net/kcms/detail/11.1998.Q.20180306.0833.001.html
