聚磷腈微球搭载生长因子时间缓释对骨髓间充质干细胞粘附和增殖的影响
2018-09-28任博胡晓青程锦史尉利赵逢源杨朋余慧镭石媛媛敖英芳
任博 胡晓青 程锦 史尉利 赵逢源 杨朋 余慧镭 石媛媛 敖英芳
北京大学第三医院运动医学研究所(北京100191)
北京市运动医学关节伤病重点实验室(北京100191)
不断创新的组织工程技术是临床方法治疗软骨损伤的有力支持[1]。骨髓来源间充质干细胞具有多向分化潜能并且易获得、易扩增,是软骨修复中比较理想的种子细胞来源[2,3]。在促进细胞增殖和粘附的研究中转化生长因子(TGF-β超家族)的表达不仅涉及到细胞黏附分子的激活和整合,其信号受体的调节在干细胞增殖和分化过程中同样非常重要[4]。而目前控释领域已经出现许多可以多种生物活性因子缓释的复杂控释系统[5],通过联合缓释策略能够激活众多信号传导通路共同调控细胞增殖从而促进更好的组织工程治疗效果。在这其中上调合成代谢的胰岛素样生长因子(IGF-1)在促进细胞增殖和软骨基质合成过程有明显的促进作用[6],我们希望建立双重释放TGF-β1和IGF-1实现不同的释放动力学特征。
在大多数缓释生长因子的策略中,多种生长因子共同释放难以完全超越单一生长因子释放的优势,需要改进生长因子随时间变化的表达[7]。最近相关的应用进展特别强调在释放方式中增加时间控制[8,9]。本研究使用的生物可降解聚膦腈在结构和性能上有着明显优于其它传统生物可降解高分子的优势,尤其是功能化改性和调控相对简单易行[10]。聚磷腈主链由磷氮原子以交替的单双两键连接而成,其主链中两侧很容易引入不同的功能集团,其侧链集团的亲疏水性设计导致不同的降解速率和缓释特性[11]。因此,我们制备出具有不同侧链氨基酸取代比例的聚磷腈微球,根据其不同降解速率达到时间调控的多重缓释策略,并且初步探讨其在体外实验中装载生长因子通过缓释作用刺激骨髓间充质干细胞粘附和增殖。
1 材料与方法
1.1 制备聚磷腈聚合物
首先制备丙氨酸乙酯溶液、甘氨酸乙酯溶液、氨基乙酯盐酸盐和三乙胺四氢呋喃混合物200 ml,在真空250°C下除去未反应的残留并溶于200 ml无水四氢呋喃连续搅拌,然后在丙氨酸乙酯溶液中加入在四氢呋喃200 ml[12]。氨基酸酯盐酸盐分别和三乙胺按1∶2.3的比例分散于250 ml四氢呋喃中回流6小时,冷却后过滤去除不溶物。在持续搅拌下将丙氨酸乙酯溶液缓慢加入上述溶液中。降至室温后抽滤除去反应中生成的三乙胺盐酸盐,溶液采用旋转蒸发仪浓缩后转移到分子量为3500的透析袋中,3天后通过真空旋转蒸发浓缩和纯化透析得到两种聚磷腈聚合物,分别为0.076 mol PAGP70和0.038 mol PAGP30聚磷腈聚合物。
1.2 制备缓释微球
双乳液法(W1/O/W2)制备聚磷腈多孔微球:分别将0.6 g PAGP70或PAGP30溶于20 ml二氯甲烷(5%w/v)溶液中。然后分别在水溶液中加入40 μg/ml转化生长因子(TGF-β1)和200 μg/ml胰岛素样生长因子(IGF-1),磁力搅拌以保证溶解完全。再加入2 ml 1%司班80溶液、2 ml去离子水并将配制好的初乳液进行超声处理(功率200 W/3min),然后在准备搅拌的烧杯中加入200 ml 1%的PVA溶液,2 ml 10%吐温60溶液,搅拌1000转/分,待溶剂挥发4小时后停止搅拌。去离子水洗涤、过滤后再离心,如此反复操作3~5遍,直至将多于的PVA清除。最后放到冷干机中干燥24 h以上并收集微球粉末待用。空白微球使用同法制备但不加入生长因子。
1.3 微球粒径分布、形态观察
取两种不同聚磷腈聚合物制备微球样品送离子溅射喷金后用扫描电子显微镜观察(SEM,S-4800型,日立公司)。电镜下观察微球的表面形态,并随机计数100个微球的粒径,从图像软件分析测量的微球的直径并计算出两种微球的平均粒径。
1.4 微球缓释曲线测定
将载生长因子的缓释微球5 mg加入EP管后混悬于1 ml PBS溶液中,置于37℃摇床震荡中,分别于各时间点(4小时,1、3、5、7、10、14、21天)高速离心后取上清液1 ml备用,再补充1 ml新鲜PBS后继续37°培养,酶联免疫仪吸附法(依据ELISA试剂盒说明书),酶标仪在450 nm吸光度处测定其OD值。根据标准曲线的标准方程计算样品中生长因子浓度,并由此绘制出21天内的生长因子累积释放曲线。
1.5 间充质干细胞来源
6周龄SD大鼠乙醚麻醉后脱颈处死,然后在超净台下无菌切开后肢皮肤,仔细剔除股骨周围的肌肉、筋膜等组织,用无菌PBS反复冲洗骨髓腔并转移至15 ml离心管中1200转离心4 min,弃上清后加入α-DMEM培养基重新混悬,然后在37℃、5%CO2孵箱中培养镜下观察原代间充质干细胞贴壁融合度达到90%以上进行传代。本研究采用P3代细胞进行后续实验。
1.6 体外细胞粘附及增殖试验
将空白微球和间充质干细胞联合单层培养24小时后行吖啶橙染色检测观察细胞粘附现象,每皿加入100 μl 0.1%(w/v)的吖啶橙染液,室温下避光孵育30 min,置于激光共聚焦显微镜下观察:绿光代表DNA染色,红光代表RNA染色,设定三维体积(X,Y,Z;600 μm;600 μm;60 μm)3D重建出范围内细胞分布和存活情况。于96孔中每个孔接种5×103个BMSCs,空载微球PAGP70或PAGP30按照剂量梯度(0.125、0.25、0.5、1、2毫克/毫升浓度)设定分组。然后孵育 1、3、5天后将10 μL CCK-8(Dojindo美国)和200 μL新鲜培养基混合后加入,利用波长为450 nm的酶标仪测定吸光度,细胞的存活率与吸光度(OD)呈线性相关。对结果进行标准化处理。
1.7 统计学分析
采用SPSS 20统计软件进行统计分析和处理,数据以(均数±标准差)表示,多组均数间的比较采用单向方差分析(One-Way ANOVA),以P<0.05为差异有统计学意义。
2 结果
2.1 微球形貌学表征及平均粒径
扫描电镜对两种聚磷腈微球进行形貌观察(图1)。在获得的SEM图像中PAGP70微球外表面光滑并且布满许多不规则的孔(图1A),微球的平均粒径为54.22±19.19 μm。而PAGP30微球表面粗糙且密集的多孔分布(图1B),微球的平均粒径为34.11±18.82 μm。

图1 两种聚磷腈微球电镜照片
2.2 微球体外缓释特征
绘制生长因子体外缓释曲线,可观察到搭载两种生长因子的微球均有爆发释放,PAGP30微球搭载的TGF-β1在第1天内有较低的爆发突释(48.24%±6.91%),最初的3~5天作为一个平台期,随后其药物释放逐渐平稳并持续释放至21天(图2A)。而搭载IGF-1的PAGP30微球释放速度明显较快,第1天内累计释放达59.75%±9.22%,第7天时累计释放率达97.52%±1.16%(图2B)。这两种释放动力学的区别主要是两种聚磷腈聚合物氨基酸取代比例不同导致两种微球亲疏水性不同。比较这两种微球最重要的结果是,两种微球合并使用时具有不同时间段释放不同生长因子组合的特点。根据释放21天的生长因子总量,计算出微球载药量,PAGP70(TGF-β1)微球为90.34 ng/mg,PAGP30(IGF-1)微球为569.57 ng/mg。
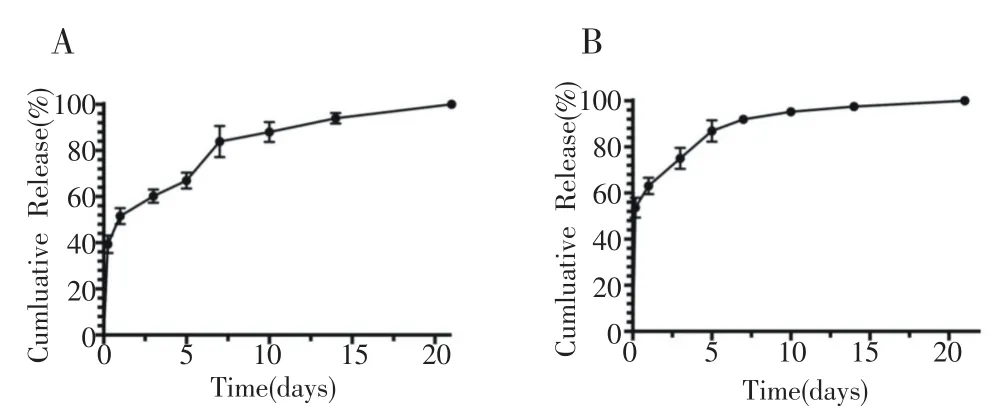
图2 聚磷腈微球生长因子缓释曲线
2.3 细胞粘附及生物相容性检测
从吖啶橙染色图像中可以观察到骨髓间充质干细胞在微球表面粘附,呈典型的梭形形态(图3)。当采用CCK-8法检测相对细胞活性时,发现随着微球用量增加(0.125~2.0 mg/ml)细胞活性无明显下降趋势。5天培养后各组的细胞存活率均在70%以上。这些结果证明了聚磷腈材料微球表面能够为细胞粘附提供适宜的环境,支持细胞保持相应表型,并表示2 mg/ml以下为安全浓度。
2.4 生长因子缓释对骨髓间充质干细胞增殖的影响
通过激光共聚焦吖啶橙染色发现释放生长因子的三个微球组均表现出促进细胞增殖的能力(图4),通过三维成像技术进行细胞计数,发现空白对照组(未缓释生长因子)的细胞计数最少,而搭载生长因子的微球三组细胞数目均明显增多,相比于单纯TGF-β1或者IGF-1组,两种缓释微球组合形成的时空缓释组细胞增殖能力明显增加(P<0.05)(图5)。说明多种生长因子时间缓释调控对骨髓基质干细胞的增殖具有更好的促进作用。

图3 吖啶橙细胞染色检测聚磷腈微球表面细胞粘附和形态。生物相容性检测采用CCK-8法检测空载聚磷腈微球0.125、0.25、0.5、1、2 mg/ml浓度对骨髓间充质干细胞增殖影响
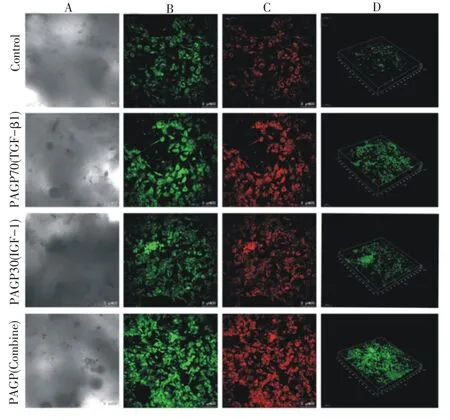
图4 激光共聚焦显微镜显示微球缓释生长因子对间充质干细胞增殖的影响
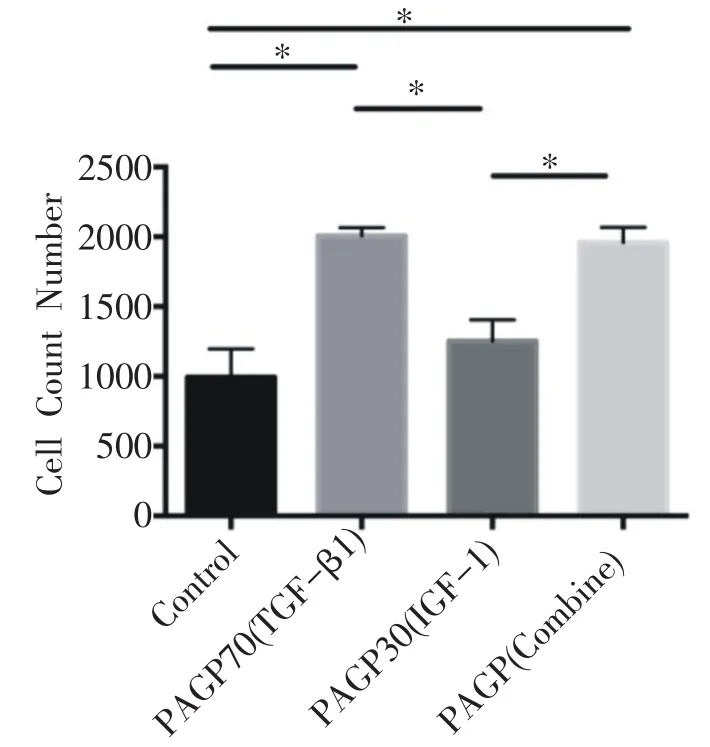
图5 激光共聚焦显微镜3D重建图下4组之间细胞计数比较
3 讨论
生物制剂释放系统在一个相对较短的时间跨度中从简单到复杂,从单一模式到多功能模式发展[8]。我们也逐步认识到生长因子在时间的调控缓释方式下可以引起更好的治疗效果。类似的利用微球不同共聚合物比例和微球直径尺寸达到多重突发释放的方式已经在硫酸软骨素治疗骨关节炎中应用[13]。最近一项研究使用IGF-1和TGF-β3在骨软骨缺损部位联合释放进行组织修复,通过改变加载阶段的TGF-β3的释放动力学变化从而促进骨软骨缺损区的修复[14]。
在临床治疗软骨损伤中使用的微骨折技术就是释放骨髓腔内的骨髓间充质干细胞,以此细胞为种子细胞进行缺损区域的细胞增殖和分化从而促进软骨愈合[15]。之前的研究已经证明软骨组织在损伤后的急性恢复期其自身调控生长因子的表达[7]。其特点也是在初始阶段以自分泌或者旁分泌的方式促使TGF-β1和IGF-1表达增加,而后期通过持续增加TGF-β1的表达维持修复过程[16,17],这也是我们实验设计中遵循的释放策略。因此,在体外实验中模拟软骨组织自身对损伤区的自身分泌特点,使用两种生长因子联合时间缓释策略刺激间充质干细胞的生物活性具有重要意义。
本实验中应用的聚磷腈聚合物是一种医用合成高分子材料[18],本研究根据聚合物合成过程中不同甘氨酸和丙氨酸使用比例,通过扫描电镜展示出其形貌学表征。而两种聚磷腈微球不同的亲疏水性特点也在ELISA检测生长因子释放过程中决定了药物释放动力学特点,比较这两种PAGP微球最重要的结果是最初的爆发释放,在最初的5天微球释放比较中,PAGP30微球高亲水性和微球粒径较小从而快速发生降解导致更快的释放,PAGP70微球疏水性氨基酸比例较高导致良好的控制释放速率。通过材料和细胞共培养试验观察到聚磷腈表面的细胞粘附,后续又通过吖啶橙染色比较不同生长因子缓释作用对细胞增殖的影响。这种微球释药特点可以在局部形成持续的有效浓度,有助于间充质细胞的增殖。当我们将两种微球同时使用时,形成对缓释体系的时间调控。本实验证明两种生长因子对细胞增殖均产生促进作用,并且两种材料联合使用的时间缓释组表现出最好的促进增殖效果,说明持续释放中具有生物活性的TGF-β和IGF-I具有协同效应,并对间充质干细胞起到持续的促增殖作用。
4 结论
应用不同氨基酸取代比例设计的聚磷腈微球具有良好的生物相容性,微球表面利于细胞粘附,其搭载生长因子的缓释功能在体外实验中得到初步验证,尤其时间调控缓释在组织工程支架材料改性、构建等研究中具有良好前景。
