室旁核内花生四烯酰乙醇胺对心衰大鼠的心脏功能和交感神经活动的影响*
2018-09-27王仁俊未晓巍赵永斌齐云峰周晓馥
王仁俊, 周 琴, 未晓巍, 李 华, 赵永斌, 齐云峰, 栾 剑, 周晓馥
(吉林师范大学生命科学学院生物技术系, 吉林 四平 136000)
慢性心力衰竭(chronic heart failure,CHF)作为当代人类健康的杀手,其重要病理特征之一为交感神经兴奋性增强[1]。研究报道显示中枢神经系统中相关作用机制改变是导致心衰时交感神经兴奋性增强的重要原因之一,如CHF时下丘脑室旁核(paraventricular nucleus,PVN)内内源性物质(如神经递质、调质等)的整合作用失衡均可导致交感活动亢进[2]。我们最近研究发现微小核苷酸[3]、前列腺素[4]和γ-氨基丁酸等的整合作用失衡亦可导致交感传出活动亢进,恶化心衰。但PVN内大麻素类物质是否参与心衰交感神经活动的调节过程,迄今为止,相关报道甚少。
花生四烯酰乙醇胺(arachidonylethanolamide,AEA)是内源性大麻素样物质,也被称作“内源性香草酸物质”,其合成途径主要是通过磷脂酰乙醇胺与磷脂在Ca2+依赖性N-酰基转移酶(N-acyltransferase)催化作用下产生N-arachidonoyl phosphatidylethanolamine (NArPE),随后又在磷脂酶D (phospholipase D,PLD)作用下最后生成AEA。已有报道显示在心肌缺血和心律失常等疾病中AEA均发挥重要的保护作用。AEA具有扩血管降血压的作用,但该作用在瞬时受体电位香草酸亚型1(transient receptor potential vanilloid type 1,TRPV1)基因敲减后消失;在右心房中TRPV1抑制剂能够阻断AEA所增强的肺迷走传入神经的敏感性;在急性心肌梗死后,激活TRPV1受体对心肌起保护作用[5],还可增加平滑肌细胞内Ca2+浓度。以上研究结果提示在外周组织中AEA与TRPV1具有保护心血管的作用,且AEA与TRPV1受体密切相关。
在中枢神经系统中,中脑导水管周围灰质AEA可诱导一氧化氮[6]产生,促进心肌舒张,且该效应与钙/钙调蛋白依赖性蛋白激酶II(calcium-calmodulin-dependent protein kinase II,CaMKII)密切相关[7]。另有文献报道AEA在孤束核(nucleus tractus solitarii,NTS)中可延长压力反射时间,抑制交感神经活性。进一步研究发现AEA在麻醉大鼠PVN内可明显降低动脉血压,同时在突触处可激活TRPV1受体。也有报道指出AEA激活TRPV1受体,引起细胞内Ca2+浓度增加[8],从而激活CaMKII[9]。然而,当脂肪酸酰胺水解酶(fatty acid amide hydrolase,FAAH)水解AEA后,TRPV1的活性将受到抑制。有报道显示CaMKII不仅能调节TRPV1的磷酸化而且能致其功能敏感化,CaMKII活性增强可使细胞内Ca2+浓度增加,进而激活小电导钙激活钾通道(small-conduc-tance calcium-activated potassium channel, SK channel)[10]。此外,CaMKII也参与 2型SK (type 2 SK,SK2)功能的调控,当抑制CaMKII 时,SK2对apamin的敏感性也会降低[11]。AEA也能够通过调控胞内Ca2+浓度来调节SK活性。另有报道称CaMKII介导的磷酸化能够调控通道的激活,在心肌细胞中KN-93(CaMKII的选择性抑制剂)能够阻断SK电流的增强,SK2过表达则减弱了心衰大鼠的肾交感神经活性[12]。综上所述,我们提出如下假说: 心衰大鼠交感活动的亢进可能与PVN内AEA和Ca2+浓度降低,CaMKII、SK2及磷酸化TRPV1蛋白表达下调密切相关。
材 料 和 方 法
1 实验材料
1.1实验动物 雄性Wistar大鼠,体重180~220 g,购于长春市亿斯实验动物技术有限责任公司,许可证号为SCXK(吉)2011-0004。大鼠饲料购自长春市亿斯实验动物技术有限责任公司,生产许可证号为SCXK(吉)2010-0001。恒温(23±2)℃,常规24 h昼夜循环。
1.2药品试剂与实验设备 氨基甲酸乙酯、α-氯醛糖、肝素钠、KN-93和辣椒平(capsazepine,CPZ)购自长春鼎国生物技术有限公司。仪器设备包括脑立体定位仪(NARISHIGE,SR-5M-HT)、多通道生理信号采集系统(成都泰盟有限公司)、激光共聚焦显微镜系统(ZEISS, LSM 710)等。
2 方法与过程
2.1构建心衰模型与假手术模型 30%氨基甲酸乙酯经腹腔麻醉大鼠,固定于鼠板上,消毒完成后,切开颈部皮肤,分离气管连接大鼠呼吸机,待呼吸均匀后,于3~4肋骨间开胸,暴露心脏,剪开心包膜后用0号带线缝合针结扎心衰组动物的冠状动脉,假手术组不结扎,手术缝合。术后3 d 每天注射1次青霉素抗感染,常规饲养。
2.2植入微渗透泵 将麻醉的大鼠固定于脑立体定位仪上,参照大鼠Paxions & Waston脑图谱,于下丘脑室旁核(前囟后1.7 mm,L和R 0.5 mm,H7.2 mm)插入微渗透泵导管,牙科水泥固定,然后将含药物的Alzet 1004号微渗透泵[人工脑脊液(artificial cerebrospinal fluid,aCSF): 0.11 μL/h; apamin: 5 μg·kg-1·h-1; AEA: 100 ng·kg-1·h-1; KN-93、CPZ和BAPTA-AM均为 10 μg·kg-1·h-1]埋于颈部皮下,另选麻醉大鼠在其腹腔植入同样型号的微渗透泵(aCSF: 0.22 μL/h; apamin: 10 μg·kg-1·h-1; AEA: 200 ng·kg-1·h-1; KN-93、CPZ和BAPTA-AM均为20 μg·kg-1·h-1),手术缝合。常规饲养4周。
2.3超声心动图及血流动力学检测 本研究选用冠脉结扎4周的心衰大鼠进行微渗透泵给药,连续灌注4周后,检测心功能、血流动力学和交感驱动指标。30%乌拉坦及α-氯醛糖腹腔注射麻醉实验动物,采用超声心动图仪检测左心室射血分数(ejection fraction,EF)、左心室舒张末期容积(left ventricular end-diastolic volume,LVEDV)和左心室舒张末期内径(left ventricular end-diastolic diameter,LVDd);分离动脉并插管,通过压力换能器连接到多道生理记录仪,采集平均动脉压(mean artery blood pressure,MAP)、左心室收缩压(left ventricular systolic pressure,LVSP)和左心室舒张末期压(left ventricular end-diastolic pressure,LVEDP)等各项指标;俯卧固定麻醉大鼠,分离肾交感神经,通过生物神经元放电记录仪记录肾交感神经放电(renal sympathetic nerve discharge,RSND),记录大鼠Ⅱ导联心电图,并同步得到心率(heart rate,HR)。
2.4NG108细胞的培养 NG108细胞为小鼠的神经母细胞瘤和大鼠的神经胶质细胞瘤融合后形成的杂交细胞,常作为工具细胞在研究神经系统与疾病发生机制过程中使用。在无菌环境中将NG108细胞接种到DMEM培养基中,培养基中含10%胎牛血清、1% HAT、1×105U/L青霉素和100 mg/L链霉素。分别添加5、10、15、20和25 μmol/L AEA于培养瓶中进行孵育实验,5% CO2、95%过滤空气于37 ℃恒温培养48 h。
2.5胞内钙离子浓度(intracellular Ca2+concentration,[Ca2+]i)的测定 DMEM培养基清洗细胞并用胰酶消化制备细胞悬液(终密度为1×109/L), 37℃恒温水浴5 min后加入Fura 2-AM(终浓度为5 μmol/L),于37 ℃恒温摇床负载45 min, 离心后去上清(200×g, 8 min),用平衡盐溶液(balanced salt solution,BSS;mmol/L:NaCl 130.0,KCl 5.46,CaCl21.33,葡萄糖5.56,HEPES 20.0, 0.2%牛血清蛋白)冲洗细胞3次,BSS悬浮细胞(细胞密度保持在1×109/L),0 ℃避光保存待测。
荧光测定方法:激发狭缝5 nm,发射狭缝10 nm,激发波长为340 nm和380 nm (2 s更换一次,交替出现),发射波长为480 nm,响应因子0.02,记录从60 s~100 s的荧光比值。按照常规公式:[Ca2+]i=Kd·(F-Fmin)/(Fmax-F),即可求得各组细胞内钙离子浓度。Kd: 解离常数(224 nmol/L); F: 不同实验条件下的荧光强度; Fmax: 加入Triton X-100后测得的最大荧光值; Fmin: 加入EGTA后测得的最小荧光值。
2.6Western blot检测蛋白水平 取PVN组织及NG108细胞,加入蛋白提取缓冲液(10 mmol/L Tris、1 mmol/L 蛋白酶抑制剂、1 mmol/L 磷酸酶抑制剂、1% SDS、0.1% Triton X-100和1 mmol/L PMSF),超声粉碎,4 ℃、12 000 r/min离心8 min;上清液即为全细胞蛋白,BCA法测蛋白浓度;SDS-PAGE分离蛋白,滤纸-胶-膜-滤纸样的三明治法电移膜;5%脱脂奶粉4 ℃封闭过夜;I 抗4 ℃孵育过夜后,TBS洗涤3次,每次10 min,暗室中荧光素标记的 II 抗孵育1 h,再用TBS洗涤2次,每次min,蒸馏水洗10 min,ECL曝光,最后显影定影,拍照。
2.7高效液相色谱法测AEA的含量 精密称量PVN组织后,加入含水解酶抑制剂PMSF的玻璃瓶中,加入乙腈溶剂20 mL,匀浆打碎后,进行为时1 h 的超声。4 ℃静置过夜,弃上清。将沉淀物全部放入离心机(10 000 r/min)离心10 min,收集上层有机相。利用固相萃取技术,2 mL流动相,乙酸乙酯和丙酮(比例1∶1)共5 mL进行洗脱,收集滤液,再用氮气吹干洗脱液。加入1 mL 乙腈复溶,-80 ℃冰箱保存备用。
取上述样品,精密吸取0.5 mL于离心管,加入0.5 mL AEA衍生化试剂DBD-COCl, 50 ℃恒温反应 2 h。100 μL去离子水终止反应。进样,高效液相色谱分析检测。
2.8PVN组织Ca2+浓度的测定 用脱臼的方法处死大鼠,分开颅骨,在冰台上用打孔法快速取出PVN组织,精密称重后,按0.1 g∶1 mL的脑∶生理盐水比例制备组织匀浆,设定参数4 ℃、2 500 r/min离心10 min后取上清。723型分光光度计参数设定为610 nm,光径为1 cm,蒸馏水调零,记录各管吸光度(A)值,计算Ca2+含量。
3 统计学处理
所有实验数据通过GraphPad Prism 5.0软件进行统计分析。所有数据用均数±标准误(mean±SEM)表示,单因素方差分析(one-way ANOVA)用于分析心功能和血流动力学等指标,多组数据两两比较用Bonferroni法,以P<0.05为差异有统计学意义。
结 果
1 心衰模型的成功建立
冠脉结扎术后 8周,检测假手术组及心衰组大鼠各项指标,结果显示与假手术组相比,心衰组大鼠肺体比(lung/body weight, lung/BW)、心脏重量(heart weight,HW)及体重(body weight,BW)均明显增加(P<0.05),提示心衰大鼠有肺淤血等迹象。心衰组大鼠左心室压力最大上升/下降速率(±dp/dtmax)及左室短轴缩短率(fractional shortening,FS)等明显下降;而心衰组大鼠的LVEDP显著升高(P<0.05);其次,较假手术组而言,心衰组大鼠心肌梗死面积(infarct size,IS)明显增加(P<0.05),梗死面积在32%~41%之间,而假手术组大鼠心肌未出现梗死的现象,见表1。以上结果均显示心衰大鼠心脏功能发生显著变化,心衰模型构建成功。
表1CHF组与假手术组大鼠解剖学、血流动力学和交感驱动指标检测
Table 1. The indexes of anatomy, hemodynamics and sympathe-tic drive in CHF group and sham group (Mean±SEM.n=12)

IndexShamCHF BW (g)366.0±4.5391.0±7.0 HW (g)1.38±0.031.66±0.06∗ RV/BW (mg/g)0.65±0.051.59±0.12∗ Lung/BW (mg/g)6.22±0.2714.01±0.32∗ IS (%)039.1±2.8∗ LVEDV (mL)0.31±0.100.85±0.05∗ LVDd (mm)6.29±0.219.81±0.33∗ FS (%)41.30±1.2827.80±1.38∗ EF (%)65.00±1.8938.00±2.13∗ LVSP (mmHg)122±5 100±5∗ LVEDP (mmHg)3.63±0.02 20.90±2.20∗ +dp/dtmax (mmHg/s)7 325±437 5 621±446∗ -dp/dtmax (mmHg/s)6 311±201 4 084±351∗ MAP (mmHg)99.5±3.4 91.6±3.8 HR (min-1)378.4±18.7 400.5±11.5 Basal RSND (% of maxinum)21.8±1.9 34.9±3.5∗ NE (ng/L)288.4±11.2 498.7±17.8∗
*P<0.05vssham group.
2 PVN内微量灌注AEA降低心衰大鼠死亡率
麻醉大鼠PVN内微量灌注AEA和对照溶剂(vehicle,VEH),一周后进行冠脉结扎手术,手术结束开始记录存活率,结果显示心肌梗死(myocardial infarction,MI)+AEA组大鼠的存活率达80%,而MI+VEH组大鼠的存活率仅64%,sham+VEH组和sham+AEA组大鼠存活率均为100%,即AEA仅增加了CHF大鼠存活率,但未对sham组大鼠存活率产生显著影响,见图1,提示PVN内微量灌注AEA能显著降低心衰大鼠死亡率。

Figure 1. The survival curves of CHF and sham rats at the end of the study.
图1CHF和sham组大鼠在研究结束时的存活曲线
3 PVN内微量灌注AEA、KN-93、CPZ、BAPTA-AM和apamin对心功能、血流动力学和解剖学指标的影响
选用结扎后4周的大鼠进行为期4周的PVN微量灌注实验。PVN分别微量灌注AEA、KN-93、CPZ、BAPTA-AM和apamin后,进行超声心动图、血流动力学和解剖学等指标检测。结果显示AEA能够显著降低心衰大鼠的LVDd、LVEDV、LVEDP、Lung/BW和RV/BW,显著提高±dp/dtmax、EF和FS,从而改善心功能。然而,KN-93、CPZ、BAPTA-AM和apamin则分别显著降低心功能,恶化心衰,见表2~4。
4 PVN内微量灌注AEA、KN-93、CPZ、BAPTA-AM和apamin对交感驱动指标的影响
与溶剂对照组相比,PVN内微量灌注AEA导致心衰组及假手术组的MAP、HR、RSND和血浆去甲肾上腺素(norepinephrine,NE)均显著降低(P<0.05);PVN内分别微量灌注KN-93、CPZ、BAPTA-AM和apamin导致心衰组及假手术组的MAP、 HR、 RSND和NE均显著增强(P<0.05),但假手术组较心衰组反应更为明显,见图2。这些结果提示PVN内CaMKII/TRPV1/Ca2+/SK2信号通路可能参与了AEA对心衰大鼠交感神经活动的抑制作用。
5 皮下微量灌注AEA、KN-93、CPZ、BAPTA-AM和apamin对交感驱动指标的影响
与溶剂对照组相比,分别在假手术组和CHF组大鼠皮下微量灌注2倍于PVN内微量灌注剂量的AEA、KN-93、CPZ、BAPTA-AM和apamin对MAP、HR、RSNA和NE均无明显影响(数据未在文中显示)。这些结果提示AEA、KN-93、CPZ、BAPTA-AM和apamin分别对交感驱动指标的影响是由下丘脑室旁核介导,而非药物扩散至外周组织产生的效应。
表2PVN内微量灌注AEA、KN-93、CPZ、BAPTA-AM和apamin对心功能指标的影响
Table 2. The effects of PVN microinfusion of AEA, KN-93, CPZ, BAPTA-AM and apamin on cardiac function indexes (Mean±SEM.n=6)

TreatmentLVDd (mm)ShamCHFLVEDV (mL)ShamCHFEF (%)Sham CHFFS (%) Sham CHFaCSF6.27±0.309.78±0.21∗0.34±0.070.87±0.05∗83.50±2.0150.70±1.98∗41.70±1.0227.50±1.23∗AEA3.97±0.23∗8.92±0.37∗†0.22±0.05∗0.77±0.03∗†97.20±1.98∗61.10±1.74∗†64.90±0.97∗41.20±1.28∗†KN-938.74±0.14∗11.25±0.18∗†0.56±0.10∗0.99±0.03∗†61.70±1.95∗40.50±2.01∗†30.20±0.89∗21.60±0.78∗†CPZ8.69±0.12∗11.80±0.20∗†0.59±0.08∗1.01±0.02∗†60.90±2.03∗41.10±1.85∗†30.90±1.01∗20.90±0.74∗†BAPTA-AM8.61±0.14∗11.30±0.17∗†0.60±0.06∗1.06±0.08∗†61.20±1.78∗40.80±1.54∗†31.20±1.12∗20.70±0.76∗†Apamin8.89±0.21∗11.70±0.24∗†0.58±0.02∗1.02±0.09∗†62.30±2.11∗41.20±1.36∗†31.80±1.28∗21.30±0.71∗†
*P<0.05vssham+aCSF group;†P<0.05vsCHF+aCSF group.
表3PVN内微量灌注AEA、KN-93、CPZ、BAPTA-AM和apamin对血流动力学指标的影响
Table 3. The effects of PVN microinfusion of AEA, KN-93, CPZ, BAPTA-AM and apamin on haemodynamic indexes (Mean±SEM.n=6)

TreatmentLVSP (mmHg)ShamCHFLVEDP (mmHg)ShamCHF+dp/dtmax (mmHg/s)ShamCHF-dp/dtmax (mmHg/s) Sham CHFaCSF120±3 100±4∗ 3.29±0.03 21.20±1.98 7 790±201 5 621±187∗ 6 301±207 4 124±310∗AEA141±2∗113±5∗† 2.01±0.04∗20.30±1.32∗†8 145±124∗5 949±162∗†7 991±198∗5 721±223∗†KN-93102±3∗91±2∗†6.61±0.04∗24.10±1.34∗†5 438±198∗3 318±132∗†5 012±211∗3 025±196∗†CPZ101±4∗90±3∗†6.54±0.05∗23.10±1.28∗†5 325±201∗3 321±146∗†5 106±209∗3 054±203∗†BAPTA-AM102±5∗91±4∗†6.23±0.02∗23.80±1.19∗†5 384±189∗3 315±139∗†5 099±196∗3 009±301∗†Apamin100±2∗89±6∗†6.79±0.04∗22.90±1.09∗†5 345±179∗3 319±201∗†5 014±184∗3 015±297∗†
*P<0.05vssham+aCSF group;†P<0.05vsCHF+aCSF group.
表4PVN内微量灌注AEA、KN-93、CPZ、BAPTA-AM和apamin对心脏解剖学指标的影响
Table 4. The effects of PVN microinfusion of AEA, KN-93, CPZ, BAPTA-AM and apamin on anatomical indexes (Mean±SEM.n=6)

TreatmentHW (g)RV/BW (mg/g)Lung/BW (mg/g)ShamCHFShamCHFShamCHFaCSF1.37±0.041.68±0.03∗0.66±0.051.61±0.08∗6.21±0.2714.07±0.31∗AEA1.21±0.07∗1.55±0.02∗†0.39±0.03∗1.48±0.04∗†5.02±0.21∗12.96±0.29∗†KN-931.98±0.03∗1.86±0.04∗†0.97±0.02∗1.79±0.10∗†8.74±0.21∗15.85±0.22∗†CPZ1.96±0.04∗1.90±0.02∗†0.98±0.01∗1.81±0.14∗†8.71±0.13∗15.75±0.34∗†BAPTA-AM1.99±0.07∗1.91±0.03∗†0.97±0.03∗1.89±0.13∗†8.80±0.15∗15.80±0.37∗†Apamin2.01±0.06∗1.93±0.02∗†0.98±0.09∗1.90±0.14∗†8.83±0.20∗15.81±0.28∗†
*P<0.05vssham+aCSF group;†P<0.05vsCHF+aCSF group.
6 心衰大鼠PVN内AEA含量、Ca2+浓度及CaMKII、SK2和磷酸化TRPV1蛋白水平的检测
冠脉结扎8周后,检测大鼠PVN内AEA含量、Ca2+浓度及CaMKII、SK2和磷酸化TRPV1蛋白水平,结果发现与假手术组相比,心衰组大鼠PVN内AEA含量、Ca2+浓度及CaMKII、SK2和磷酸化TRPV1蛋白水平均显著降低(P<0.05),见图3。这些结果提示PVN内AEA含量、Ca2+浓度及CaMKII、SK2和磷酸化TRPV1蛋白水平降低可能与心衰发生发展密切相关。

Figure 2. The effects of microperfusion of AEA, KN-93, CPZ, BAPTA-AM and apamin in PVN on the sympathetic drive indexes. A: original tracings of artery blood pressure (ABP) and renal sympathetic nerve discharge (RSND); B: heart rate (HR); C: mean arterial pressure (MAP); D: RSND; E: plasma norepinephrine (NE). Mean±SEM.n=6.*P<0.05vssham+VEH group;†P<0.05vsCHF+VEH group.
图2PVN内微量灌注AEA、KN-93、CPZ、BAPTA-AM和apamin对交感驱动指标的影响
7 AEA孵育NG108细胞后细胞内Ca2+浓度及CaMKII、SK2和磷酸化TRPV1蛋白水平的检测
离体培养NG108细胞,分别用5、10、15、20和25 μmol/L的AEA孵育NG108细胞24 h后,与正常组相比,AEA孵育可剂量依赖性增加NG108细胞内Ca2+浓度及CaMKII、SK2和磷酸化TRPV1蛋白水平(P<0.05),见图4、5。这一结果提示CaMKII/TRPV1/Ca2+信号通路可能介导了AEA对NG108细胞内SK2通道蛋白表达的抑制作用。
讨 论
本研究运用神经核团微量灌注、神经电生理、细胞培养及Western blot等技术,首次发现在心衰大鼠PVN内AEA含量、Ca2+浓度及CaMKII、SK2和磷酸化TRPV1蛋白水平均显著减少,PVN内微量灌注AEA能显著降低交感驱动指标(包括HR、MAP、RSND和NE);然而,分别微量灌注KN-93、CPZ、BAPTA-AM和apamin能显著增强交感驱动指标。

Figure 3. AEA content (A), intracellular Ca2+concentration ([Ca2+]i; B), and CaMKII (C), SK2(D) and phosphorylated TRPV1 (E) protein levels in PVN of the rats with CHF. Mean±SEM.n=6.*P<0.05vssham group.
图3大鼠PVN内AEA含量、胞内Ca2+浓度及CaMKII、SK2和磷酸化TRPV1蛋白水平的比较

Figure 4. The effect of AEA on intracellular Ca2+concentration ([Ca2+]i) in NG108 cells. A: representative confocal images showing the changes of [Ca2+]i; B: the quantitative analysis of [Ca2+]i. Mean±SEM.n=6.*P<0.05vs0 μmol/L group.
图4AEA孵育NG108细胞对胞内Ca2+浓度的影响
在离体实验部分,AEA孵育可剂量依赖性增加NG-108细胞内Ca2+浓度及CaMKII、SK2和磷酸化TRPV1蛋白水平。以上结果提示室旁核内CaMKII/TRPV1/Ca2+/SK2信号通路可能介导了AEA对心衰大鼠交感神经活动的影响。
本研究对AEA、CaMKII选择性抑制剂KN-93、TRPV1通道特异性阻断剂CPZ、Ca2+螯合剂BAPTA-AM和SK通道阻断剂apamin的溶剂都进行了心衰及假手术大鼠PVN注射,记录了各种溶剂对交感驱动指标的影响,结果发现各种溶剂对交感驱动指标均无显著影响,因此,本文展示的数据中选取aCSF组作为溶剂对照组。在离体实验部分,本研究采用AEA孵育NG108细胞后,发现AEA诱导了磷酸化TRPV1蛋白水平的增加,同时也增加了CaMKII和SK2蛋白表达量,提示CaMKII活性增强可能诱导了TRPV1磷酸化,进而激活SK2,这一结果与Liu等[13]的报道相一致。本研究还发现当分别微量灌注AEA、KN-93、CPZ、BAPTA-AM和apamin时,虽然心衰组及假手术组交感驱动指标均发生显著变化,但假手术组反应更为明显。这可能与心衰大鼠减压反射发生钝化有关;另外,心衰大鼠PVN内的CaMKII/TRPV1/Ca2+/SK2信号通路功能钝化也可能是导致心衰大鼠交感驱动指标对AEA、KN-93、CPZ、BAPTA-AM和apamin的敏感性降低的主要原因之一。
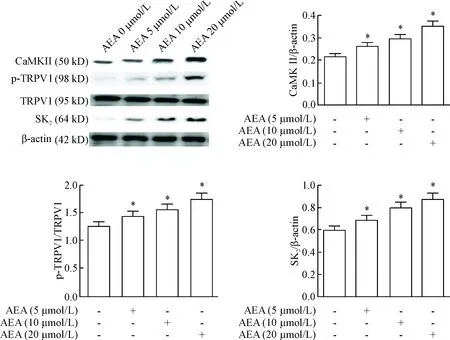
Figure 5. The results of Western blot showed the effects of AEA on the protein levels of CaMKII, SK2, TRPV1 and phosphorylated TRPV1 in the NG108 cells. Mean±SEM.n=6.*P<0.05vscontrol (without treatment) group.
图5AEA孵育NG108细胞后对CaMKII、SK2及磷酸化的TRPV1蛋白水平的影响
与本研究结果相矛盾的是,另一课题组的研究显示AEA注入兔脑室可导致交感神经活动亢进[14],但该课题组采用的给药方式是脑室注射,因脑室注射法无法定位到具体的神经核团,所以不能确定AEA具体是通过哪个神经核团发挥作用;此外,虽然兔与鼠都属于小型哺乳动物,但因二者基因差异较大,所以很可能是因遗传背景不同导致交感神经活动对AEA的反应不一致,但确切机制仍有待进一步深入研究。另有研究报道长期使用低剂量辣椒素激活TRPV1后,交感神经兴奋性未发生显著改变,其原因可能与长期辣椒素刺激引起生物耐受性有关。值得注意的是,有报道显示抑制CaMKII对阿尔茨海默症大鼠有神经保护作用[15],但在心衰模型与阿尔茨海默症发病机制不同,药物作用核团亦不相同,所以在CHF大鼠PVN内CaMKII发挥作用如何,有待进一步研究。陈佳等[16]曾指出心衰患者血浆中AEA含量有所升高,然而,本研究发现心衰大鼠PVN内AEA含量显著降低,其中矛盾的原因很可能与我们在研究中采用的心衰动物模型与陈佳等在临床研究中心衰患者的疾病严重程度不完全一致有关;此外,也可能与中枢PVN内AEA与外周血浆中的AEA在心血管系统中调控机制存在差异有关。但在心衰状态下中枢和外周AEA参与心血管活动调节的确切机制如何仍有待进一步深入研究。有趣的是,也有研究显示CaMKII可调节TRPV1受体通道蛋白的磷酸化水平,AEA进入细胞后可激活TRPV1受体,引起细胞内Ca2+浓度增加;钙内流增加及CaMKII介导的磷酸化作用均能介导SK信号通路激活,且在NTS中微量注射AEA能够延长压力反射时间,抑制交感神经活性;PVN内注射AEA可明显降低动脉血压等,这部分研究结论均与本研究中AEA介导TRPV1磷酸化从而抑制交感神经兴奋性的结果相一致。
当然,本研究中也存在着许多的不足之处,我们将其归纳为以下几点:(1)本研究虽然证实在心衰大鼠PVN内AEA能抑制交感神经兴奋,但是否有其它因子辅助AEA对交感神经兴奋性产生影响,目前仍无法排除;(2)本研究中虽然证实AEA对心衰大鼠交感神经兴奋性产生影响与SK信号通路密切相关,但SK通道存在4种亚型(即SK1~SK4),这些通道亚型是否分别或共同参与调控交感神经兴奋,在本研究中未进行分类探究,需要进一步研究。
综上所述,本研究结果提示在心衰状态下,PVN内AEA含量降低,进而抑制了CaMKII/TRPV1/Ca2+/SK信号通路,最终导致交感神经兴奋亢进。本研究所证实的心衰状态下PVN内CaMKII/TRPV1/Ca2+/SK信号通路介导AEA对心衰大鼠交感神经激活产生抑制作用,虽不能直接应用于临床,但本研究所验证的假说可为心衰治疗提供实验室理论依据,为心衰疾病的治疗提供新的靶点。
